Introduction
El sevoflurano es un anestésico general ampliamente utilizado, especialmente adecuado en los procedimientos quirúrgicos cortos y en cirugía ambulatoria 1. Sus principales ventajas son la inducción rápida de la anestesia mientras se mantiene la respiración espontánea y su contribución a la estabilidad hemodinámica del paciente 2. Su toxicidad fue inicialmente descubierta mientras se buscaban los efectos del sevoflurano en la función hepática 3. Se ha implicado en la producción de metabolitos tóxicos, y en la inducción de hipertermia maligna 4.
La exposición a la inhalación de anestésicos genera activaciones de pequeñas cantidades de especies reactivas de oxigeno (ROS), ya sea directamente, mediante la interacción con la cadena de transporte de electrones mitocondriales; o indirectamente, a través de una cascada de señalización en la que receptores-G acoplados a la proteína, proteinquinasas, y canales mitocondriales de potasio sensibles a ATP (KATP) juegan un papel importante. Esta atenuación de la respiración puede causar una fuga de electrones desde la matriz mitocondrial interna y aumentar la generación de ROS 5,6.
El Sevofluorano también puede desencadenar directamente la formación de peroxinitritos y aumentar significativamente el H2O2 intracelular y/o el peróxido, superóxido y óxido nítrico (NO) en los neutrofilos polimorfonucleares periféricos tras 1 h de tratamiento. Por otra parte, también se ha demostrado la intensificación del agotamiento del glutatión intracelular (GSH) en neutrófilos. Estos resultados son importantes ya que demuestran el estrés oxidativo inducido por la administración de sevoflurano que se realiza por medio del incremento de la concentración de ROS 6,7.
El estrés oxidativo inducido por el aumento de los niveles de ROS también es el mecanismo clásico por el cual las radiaciones ionizantes inducen su daño genotóxico. El test de micro núcleos se ha utilizado con éxito para evaluar este daño genotoxico 8,9 tanto in vivo como in vitro 9. Además, usando esta técnica se han descrito que la administración de diversas sustancias antioxidantes tiene efectos genoprotectores contra el daño cromosómico inducido por la radiación ionizante 10-12.
En este estudio pretendemos determinar un posible efecto genotóxico del sevoflurano mediante el ensayo de micro núcleos. Para ello, vamos a cuantificar el número de micronucleos por cada 1,000 células binucleadas en muestras de sangre expuestas a sevofluorano y compararla con las muestras de sangre controles y expuestas a radiación ionizante, cuyo efecto genotóxico esta asumido por numerosos autores.
Materiales y Métodos
Productos químicos y reactivos
Sevofluorano se obtuvo de Abbot (Madrid, España) y se administró puro en diferentes volúmenes (5-40 μL). RPMI 1640, F10, PHA, DMSO, citocalasina B, estreptomicina, penicilina, fosfato salino tamponado (PBS) y 3-(4,5-dimetil-2-tiazolil) - 2,5-difenil-2Htetrazoilo bromuro (MTT), se obtuvieron de Sigma-Aldrich Química S.A (Madrid, España). El suero fetal bovino se obtuvo de Gibco (EE.UU.); el ácido acético glacial y el etanol se obtuvieron de Scharlao SL (Madrid, España), el metanol se obtuvo de Panreac (Madrid, España); la heparina sódica al 5% se obtuvo de Laboratorios Rovi (Madrid, España) y el ácido rosmarínico (RO) al 95% se obtuvo de Extrasynthese (Genay, Francia).
Curva de supervivencia celular y cuantificación de viabilidad: prueba de MTT Condiciones de la línea y de cultivo celular
La línea celular PNT2 utilizada se obtuvo de la Colección Europea de Cultivos Celulares (ECACC) Colección de Cultura, Agencia de Protección de la Salud (Catalogo n° 95012613, HPACC, Reino Unido). Se realizaron ensayos durante todo el estudio para confirmar la ausencia de Mycoplama spp. Las células PNT2 (células epiteliales normales de próstata humana) fueron cultivadas en medio RPMI 1640 suplementado con suero bovino fetal (FBS) (10%), glutamina (2 mM) y estreptomicina más penicilina (100 μg/mL y 100 UI/mL, respectivamente). Todos los procesos se realizaron en una cámara de flujo laminar vertical Cultair ASB tipo II. Los cultivos de células PNT2 se mantuvieron a 37° C y una humedad relativa del 95%, en atmosfera de CO2 al 5%, en una incubadora CytopermR. El medio de cultivo se cambió cada dos días o cuando la acidificación lo recomendaba mediante el indicador de pH (rojo fenol). Tras la irradiación, todas las placas se incubaron durante 24, 48 y 72 h, sin realizar cambios del medio de cultivo. Para determinar los posibles efectos radioprotectores se incluyeron pocillos de control positivo conteniendo 20 μL de DMSO (0.2%) y RO al 25 μM en los estudios de supervivencia celular.
Prueba de MTT
Para analizar los efectos del sevoflurano sobre la viabilidad celular y la supervivencia celular en las células PNT2, se utilizó el test de 3 (4,5-dimetiltiazol-2-il) -2,5-tetrazolio bromuro de difenil (MTT) para periodos de incubación de 24, 48 y 72 h. Brevemente: los cultivos celulares se incubaron en 200 μL de medio y se dejaron adherir durante 24 h. Después del tratamiento con las dosis antes mencionadas de sevoflurano, y para los tiempos de incubación mencionados, se añadió medio de crecimiento suplementado y 50 μl de MTT (5 mg/mL) a cada pocillo en placas de 96 pocillos que se incubaron a 37° C durante 4 h en una atmosfera de CO2 al 5%. Posteriormente, las placas se centrifugaron a 900 rpm durante 8 min para eliminar cuidadosamente el medio y el MTT no metabolizado y se añadieron 100 μL de DMSO a cada pocillo para solubilizar el MTT adquirido por las células vivas. Tras agitar durante 30 min a temperatura ambiente, las placas se leyeron con un espectrofotómetro MultiskanR MCC/340P utilizando 570 nm para la lectura y 690 nm para las longitudes de onda de referencia. Los pocillos de control negativo se utilizaron para determinar la línea de base cero. Cada experimento se repitió en tres ocasiones.
Efecto Genotoxico: MN (MNCB)
Las muestras de sangre y el procedimiento de irradiación: las muestras de sangre periférica humana fueron donadas por seis mujeres jóvenes supuestamente sanas no fumadoras que fueron heparinizadas. El sevofluorano se administró al 100% en tres volúmenes diferentes (5, 20 y 40 μL); 20 μL de RO (25 μM) y de DMSO (0.2%), respectivamente se añadieron a 2 mL de sangre para determinar sus posibles efectos genoprotectores y se incluyeron como controles positivos. Las muestras se homogeneizaron inmediatamente antes de la irradiación con rayos X.
Técnica de cultivo
El test de micronúcleos (MN) se llevó a cabo en linfocitos irradiados y bloqueados cito cinéticamente tras la irradiación con rayos X (MNCB), siguiendo el método descrito por Fenech (1985) 13 y adaptado por la Agencia Internacional de Energía Atómica (2011). Brevemente: las muestras de sangre (0.5 mL) se cultivaron a 37° C durante 72 h en 4.5 mL de medio F-10 que contenía suero bovino fetal al 15%, 1.6 μg/mL de fitohemaglutinina, 1% de penicilina/estreptomicina y 1 μg/mL de glutamina. Cuarenta y cuatro horas después de la iniciación de los cultivos de linfocitos, se añadieron 150 μL de citocalasina B a una concentración de 6 μg/mL. A las 72 h, los linfocitos se trataron con una solución hipotónica (KCl 0.075 M) durante 3 min y se fijaron usando metanol: ácido acético (3:1). Las preparaciones se secaron al aire y se tiñeron con May-Grunwald Giemsa 24 h más tarde. Cada experimento se repitió en tres ocasiones.
Recuento de micronucleos
Se analizaron los cultivos por triplicado para cada volumen de sevofluorano o muestra estudiada. En cada una, se analizaron 3,000 células citocineticamente bloqueadas (3,000 CB/muestra estudiada) para determinar la frecuencia de micronucleos (MN/500 CB) que fueron examinadas por dos especialistas a doble ciego utilizando un microscopio óptico Zeiss (Oberkochem, Alemania), con un aumento de 400x para examinar las preparaciones y una amplificación de 100x para confirmar la presencia o ausencia de MN en las células, de acuerdo con criterios previamente recomendados 8,9.
Irradiación
Las muestras fueron expuestas a rayos X con un aparato Andrex de SMART 200E (YXLON International, Hamburgo, Alemania) con 4.5 mA, 36 cm distancia foco objeto (FOD) y temperatura ambiente. Las dosis de radiación fueron monitorizadas mediante un dosímetro universal UNIDOSR con cámaras de ionización PTW FarmeR TW 30010 (PTW-Freiburg, Freiburg, Alemania) en el interior de la cabina de irradiación y las dosis de rayos X fueron confirmadas posteriormente mediante dosímetros de termoluminiscencia (TLD) (GR-200R, Conqueror Electronics Technology Co. Ltd, China). Los TLDs fueron suministrados y medidos por el CIEMAT (Ministerio de Industria y Energía, España). En el ensayo de micronucleos de linfocitos humanos con bloqueado cito cinético (CBMN) se irradiaron con 2 Gy de rayos X, mientras que para obtener la curva de supervivencia celular y la cuantificación de la viabilidad celular (prueba de MTT) se administraron diferentes dosis de rayos X (5, 10, 15, 20 y 0 Gy como control).
Análisis estadístico
En el estudio de genotoxicidad, se ha determinado el grado de dependencia y correlación entre variables mediante análisis de varianza complementado por contraste de medias (p <0.05). Las medias cuantitativas se compararon mediante análisis de regresión y correlación lineales. Además, se utilizó la formula descrita por Sarma y Kesavan (1993) 8,9 para determinar la capacidad de protección mediante la expresión: Magnitud de Protección (%) = ((F control irradiado - F irradiadas-tratadas)/F control irradiado) x 100. Donde F control irradiado=frecuencia de MN en linfocitos de sangre no tratados pero irradiados y F irradiadas-tratadas=frecuencia de MN en linfocitos de sangre tratadas con las sustancias e irradiada.
En los ensayos de citotoxicidad, se utilizó un análisis de varianza (ANOVA) de medidas repetidas para comparar los porcentajes de superviviencia celular en los cultivos con diferentes concentraciones de sevoflurano, complementado con la menor deferencia significativa analizada con contraste de pares y medias. Los análisis se llevaron a cabo mediante la transformación logarítmica de los datos para cumplir con las condiciones de ANOVA.
Resultados
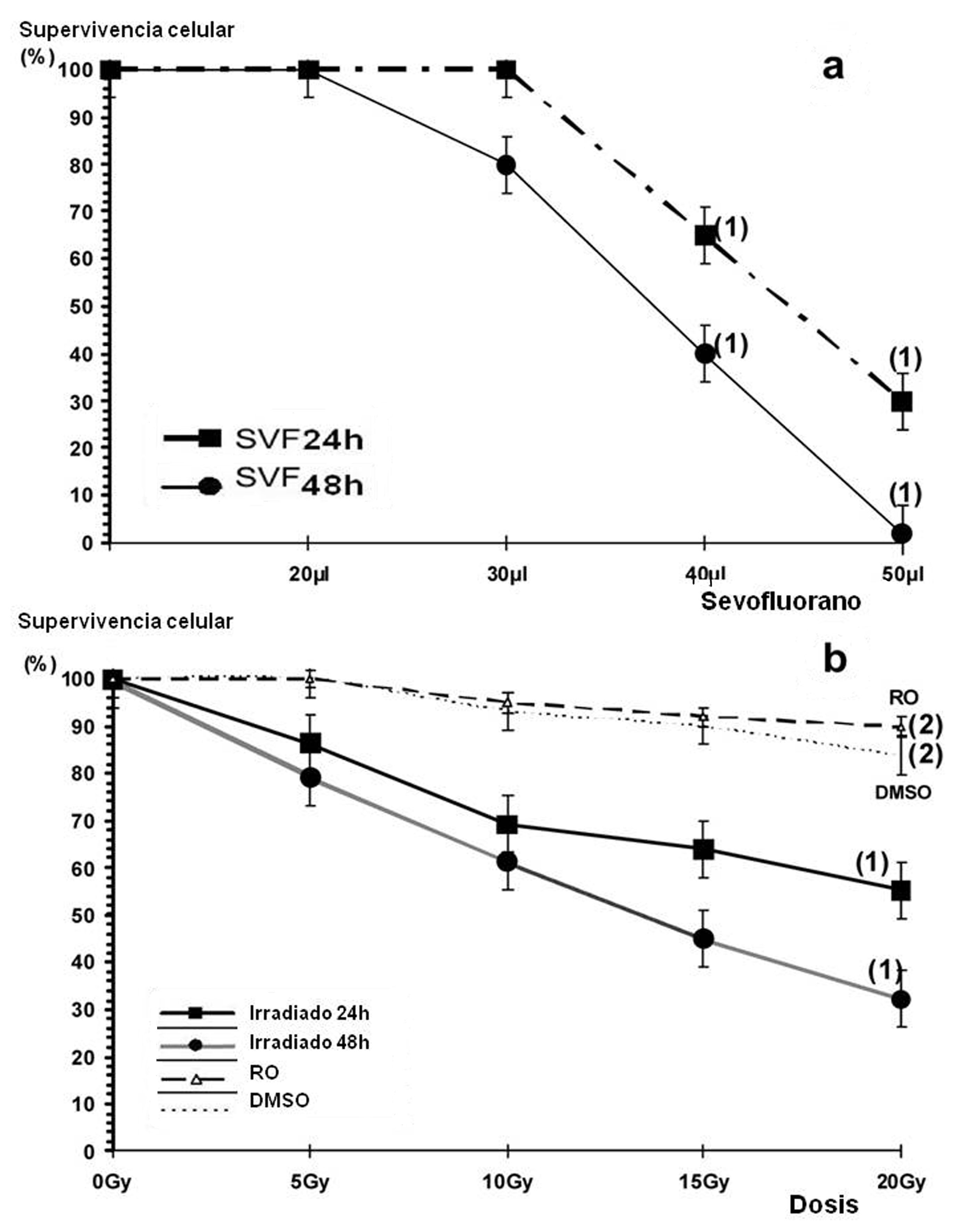
En los estudios de citotoxicidad, el tratamiento de células PNT2 con volúmenes crecientes de sevoflurano durante 24 y 48 h muestra una disminución de la viabilidad celular, dosis y tiempo dependiente (p <0.001) (Fig. 1a). Todos los volúmenes superiores a 30 μL de sevofluorano mostraron un grado significativo de citotoxicidad (Fig. 1a). La exposición a rayos X sola también muestra una disminución de la viabilidad celular, dosis y tiempo dependiente (p <0.001) (Fig. 1b). La administración de 20 μL de RO (25 μM) o DMSO (0.2%) antes de la irradiación con rayos X aumento la supervivencia de las células PNT2 de forma significativa, lo que expresa una significativa capacidad radio protectora (p <0.001) (Fig. 1b).
Figura 1.
a) Efecto de diferentes volúmenes de sevoflurano sobre la viabilidad celular de las células PNT2. b) efectos de las dosis de radiación sobre la viabilidad celular de PNT2 después de 24 y 48 h de incubación. Los resultados se expresan como un porcentaje de células PNT2 supervivientes respecto al control (RO: ácido rosmarínico 25 μM irradiado e incubado durante 48 h; DMSO: dimetil sulfóxido al 0.2% irradiado e incubado durante 48 h) (1) p <0.001 versus control, (2) p <0.001 versus control irradiado.
En el estudio genotóxico, la frecuencia basal de MN/500 CB fue de 10±2 MN/500 CB para los controles no irradiados de los linfocitos humanos utilizados en el ensayo citogenetico. La irradiación con 2 Gy de rayos X produce un aumento significativo en la aparición de MN, que llego a 28±4 MN/500 CB (p <0.001), lo que expresa un daño genotóxico inducido por los rayos X (Fig. 2). La administración de RO y DMSO utilizado como controles positivos de un agente radio protector, muestra una disminución significativa en la frecuencia de aparición de MN cuando se administra antes de la irradiación (p <0.001 y p <0.01, respectivamente). Esto expresa la capacidad genoprotectora de estas sustancias contra el daño cromosómico inducido por los rayos X (Fig. 2); determinándose magnitudes de protección de 53.6% y 18.0%, respectivamente.
Figura 2.
El efecto genotoxico (Frecuencia de MN/500CB) de diferentes volúmenes de sevoflurano y rays X: C control, RO ácido rosmarínico, DMSO dimetil sulfóxido y S5, S20, S40 son diferentes volúmenes de sevoflurano (en μL) administrado solo o antes de la irradiación ((1) p <0.001 versus control no irradiado, (2) p <0.001 versus control irradiado, (3) p <0.01 versus control irradiado, (4) p <0.001 frente a S5 no irradiada.
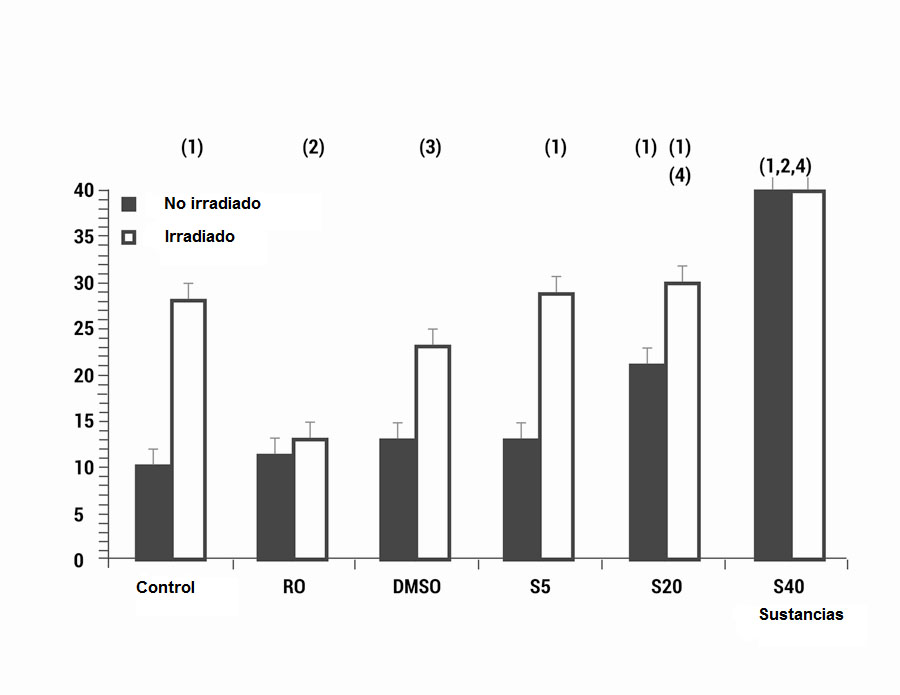
La administración de sevoflurano muestra un incremento significativo de la frecuencia de aparición de MN dosis-dependiente, en comparación con la frecuencia en sus controles (p <0.001) (Fig. 1b), lo que expresa la existencia de un efecto genotoxico inducido por el sevoflurano. El efecto genotoxico producido por la administración de sevoflurano no muestran diferencias significativas con el inducido por la administración de sevoflurano junto con la irradiación, excepto cuando se utilizan las dosis o volúmenes de sevofluorano mas pequeños (5 μL) (p <0.01).
Discusión
La frecuencia de aparición de micronucleos es una medida fiable tanto de la rotura cromosómica como de la pérdida de fragmentos en los cromosomas; lo que la caracteriza de otras pruebas o ensayos citogeneticos. Este daño cromosómico es un indicador de genotoxicidad y en última instancia, puede dar lugar a la inducción de aneuploides, constituyendo también un acontecimiento importante en la carcinogénesis 6,13. Nuestro objetivo ha sido comparar el daño cromosómico inducido por el sevoflurano con el daño inducido por los rayos X mediante la evaluación de su capacidad genotóxica utilizando el ensayo de micronucleos.
En estudios previos, nosotros hemos utilizado este ensayo de micronucleos para determinar la capacidad genotóxica de la radiación ionizante in vivo con rayos X 14,15, e in vitro con radiación gamma 10-12,16 tanto con dosis altas de radiacion 17 como en el umbral de sensibilidad del test (48 cGy) 18,19. También hemos utilizado el ensayo de MN para determinar el efecto genoprotector de diferentes sustancias antioxidantes frente al daño cromosómico inducido por los rayos X in vivo en medula ósea de ratón (PCEs) 14,15 o in vitro con radiación gamma en cultivos de linfocitos bloqueados con citocalasina B 9,16,18 en presencia o ausencia de diferentes sustancias que proporcionan una protección química con/sin presencia de tioles 10,14,15. Nuestros resultados en este estudio muestran capacidades genotoxicas similares a las descritas para los rayos X y unas capacidades genoprotectoras de las sustancias antioxidantes ensayadas similares a las que hemos descrito previamente, especialmente cuando los antioxidantes están presentes en el medio biológico antes de la irradiación in vivo en medula ósea de ratón 10,14 e in vitro en linfocitos humanos bloqueados mediante citocalasina-B 8,9.
Nuestros resultados en este estudio muestran un efecto genotoxico dosis-dependiente del sevoflurano determinado mediante el ensayo CBMN tras haber corregido las dosis de sevofluorano que eran citotóxicas en las curvas de supervivencia (MTT) en las células PNT2. Nosotros hemos identificado un efecto genotoxico del Sevofluorano con las características de un poderoso agente muta génico y con características similares a las descritas para la radiación gamma o los rayos X. En este sentido, los primeros estudios determinaron un incremento en la frecuencia de aparición de MN, por lo que se sugirió un posible efecto genotoxico del sevoflurano 20. Sin embargo, otros estudios posteriores describieron resultados contradictorios.
Se ha descrito un incremento de cromatides hermanas (SCE) en pacientes adultos sometidos a anestesia tras una exposición de 60 min al anestésico 21,22. Este incremento de SCE en el grupo expuesto a las sustancias anestésicas se obtuvo al compararlos con otro grupo de personal médico tomado como grupo control 22; sin embargo, en otro estudio, el incremento de la SCE en niños sometidos a anestesia con sevoflurano durante 50 min de exposición no pudo establecer incremento significativo de MN, sumándose a algunas descripciones realizadas sobre personas ocupacionalmente expuestas a la inhalación de gases anestésicos y a otros pacientes expuestos a sevofluorano 23 en donde no se muestra efecto genotoxico.
Diferentes autores describen que los resultados obtenidos por el ensayo de MN (ensayo de CBMN y Cometa) se contradicen con los obtenidos mediante el ensayo de SCE 24. En estos estudios, el ensayo de MN bajo condiciones de exposición ocupacional con un nivel bajo de sevoflurano no se asocia con un aumento en la frecuencia de aparición de MN 24. Nuestro estudio muestra que las dosis pequeñas de sevoflurano (5 μL) no son capaces de inducir un incremento en la frecuencia de MN, lo que podría interpretarse como que no tiene un efecto genotoxico a esta dosis. Sin embargo, nosotros hemos sugerido que el ensayo de MN tiene una limitación cuando se utiliza para evaluar la genotoxicidad del sevofluorano: el ensayo de MN tiene un umbral de sensibilidad muy alta (límite de detección), por lo que los agentes (químicos o físicos) que no son intensamente genotoxicos pueden no ser detectados. En realidad, el principal inconveniente del ensayo de micronucleos (CBMN) está en la variabilidad de la frecuencia basal de micronucleos, por lo que solo en la exposición a radiaciones ionizantes in vivo superiores a 20-30 cGy pueden ser detectadas por la técnica 25. Así, como también ocurre en nuestro estudio, agentes físicos o dosis ligeramente tóxicos de sevofluorano en exposiciones a corto plazo, pueden no inducir un incremento en la frecuencia de MN y tener un efecto genotoxico indetectable bajo numerosas condiciones experimentales, lo que podría llevar a la conclusión de que no tienen ninguna capacidad mutagénica o genotóxica. Posiblemente por ello, algunos autores han descrito la ausencia de efecto genotoxico de pequeñas dosis de sevoflurano utilizando el ensayo Cometa 23,24. Además, también se debe reseñar que la incubación de PBL con 1% de DMSO, como el que se utiliza como un disolvente para los anestésicos en los procedimientos de rutina, puede producir una disminución de la longitud del cometa dificultando la determinación de su efecto 23. En este estudio 23 se describe que el daño del ADN por sevofluorano no era diferente al observado para sus controles realizados con DMSO; y por lo tanto, concluyo que pequeñas dosis de sevoflurano no ejercen actividad genotóxica in vitro. Sin embargo, los autores también describen una disminución en la longitud media del cometa en una disolución con DMSO del anestésico, y sugieren que podrían explicarse de dos formas: (i) por la estabilización de las paredes celulares por el DMSO, o (ii) por la influencia inhibidora de la isoforma CYP2E del citocromo P450 responsable de la activación de componentes del sevofluorano y otros análogos 23.
Nuestros resultados con DMSO y con las dosis más bajas de sevoflurano (5 μL) son también similares entre si y no presentan diferencias significativas. El DMSO es un potente antioxidante con las características clásicas similares a los radioprotectores más potentes que contienen azufre (thioles) y muestran una significativa capacidad de genoprotección, tanto in vivo como in vitro, disminuyendo el daño inducido por la radiación ionizante. Esta capacidad genoprotectora podría atribuirse a su capacidad antioxidante, eliminadora de radicales libres, en los sistemas biológicos cuando se administra antes de la irradiación 8,9.
Dado que el efecto de sevoflurano también podría ser debido a la inducción de un estrés oxidativo, el DMSO utilizado para disolverlo podría ayudar a ocultar su efecto genotóxico sobre todo con las dosis más bajas de sevoflurano. Cuando las dosis de sevoflurano son suficientemente altas, provoca una genotoxicidad significativa in vivo que se asemeja con la respuesta descrita con el ensayo del Cometa 6, en donde se describe un aumento sustancial de la frecuencia de MN en linfocitos de sangre periférica en todos los grupos de animales expuestos. Nuestros resultados también demuestran una genotoxicidad significativa del sevoflurano cuando se administra a altas dosis, que alcanza un máximo de incremento de aparición de MN con dosis pre-toxicas (40 μL); lo que es comparativamente es muy parecido a la capacidad genotóxica inducida por la exposición a 2 Gy de rayos X.
Diferentes estudios han descrito que el pretratamiento con sevofluorano ayuda a la genoprotección frente a las especies reactivas de oxigeno (ROS). Pero además, el sevofluorano también pueden desencadenar directamente la formación de peroxinitritos aumentando significativamente el H2O2 intracelular, el anión superóxido y los niveles de óxido nítrico (NO) en PMN tras 1 h de tratamiento, incrementando así el agotamiento de glutatión endógeno intracelular (GSH)7. Así, el estrés oxidativo sería el mecanismo de acción utilizado por el sevofluorano para inducir el daño cromosómico, de una forma similar al mecanismo de acción de los rayos X.
Nuestros resultados demuestran que el tratamiento combinado de sevofluorano+rayos X produce un efecto aditivo o sinérgico, lo que explicaría el aumento de la genotoxicidad observada en el presente estudio. Las especies reactivas derivadas del NO inhiben enzimas, fragmentan el ADN, modifican bases, destruyen los lípidos de membrana oxidándolos, y consumen antioxidantes celulares; lo que explica el efecto que hemos descrito en el tratamiento combinado de sevofluorano+IR. La GSH, el más importante tiol intracelular es considerado como un radioprotector por su capacidad para actuar como básico en un importante número de reacciones de desintoxicación 9. Una disminución de los niveles intracelulares de GSH, por lo tanto, aumenta la sensibilidad de las células a una posterior acción de la radiación. La observación de los resultados de nuestros tratamientos combinados utilizando sevoflurano e IR, sugiere que podría actuar el sevofluorano de una manera similar al efecto de radio sensibilización que se produce con el cisplatino cuando se administra junto con radiaciones ionizantes, como se ha descrito previamente por diferentes autores 6.
Los mecanismos de acción descritos en el estrés oxidativo, la formación de radicales libres y una caída en los niveles endógenos de antioxidantes celulares inducidos por el sevofluorano son similares a los mecanismos de acción descritos para explicar el efecto mutagénico de los rayos X 9 y la radiación γ con cesio radiactivo 8 en lo que respecta a la muerte celular y a su capacidad genotóxica.
Diferentes autores han sugerido el uso de suplementos alimentarios con antioxidantes para reducir el daño genotoxico causado por los gases anestésicos residuales en la exposición ocupacional, con objeto de reducir el efecto genotoxico y el estrés oxidativo producidos. Del mismo modo, otros autores también han descrito que el uso de diferentes sustancias antioxidantes incluidas dentro una la dieta humana (como conteniendo RO) puede ofrecer protección contra el daño biológico inducido por IR en los trabajadores expuestos a la radiación y pacientes sometidos a los exámenes radiológicos en radiodiagnóstico y medicina nuclear 8,9.