Introducción
La enfermedad de Parkinson (EP) es el segundo desorden neurodegenerativo más común después de la enfermedad de Alzheimer (EA). La EP afecta a todos los grupos raciales y tiene una distribución uniforme alrededor del mundo 1,2. En Europa, la prevalencia de la EP es 1.6/100 3, mientras en Colombia la prevalencia es de 4.7/1,000 4.
Las características predominantes de la EP es el enlentecimiento progresivo del movimiento (bradiquinesia). Los pacientes inicialmente presentan temblor de reposo, dificultad en la iniciación de los movimientos en ausencia de parálisis (akinesia), y rigidez muscular, finalmente conduce a una estabilidad postural 5. Un subgrupo de pacientes también desarrolla demencia 6,7. Las principales características patológicas de la EP son la pérdida progresiva y selectiva de las neuronas dopaminérgicas en la sustancia Nigra, zona compacta del cerebro medio, degeneración del sistema nigrostriatal y la presencia de cuerpos de Lewy 8.
La contribución de factores genéticos al desarrollo de la EP ha sido pobremente estimada por muchos años, aunque el 15% de los casos tienen una historia familiar de la enfermedad 9. Con la reciente descripción de mutaciones en varios genes asociados a casos familiares autosómico dominantes y recesivos de inicio temprano de la enfermedad, se ha sugerido que la EP tiene una fuerte base genética 10,11. Sin embargo, la amplitud de la contribución genética y la interacción entre factores ambientales y genéticos permanece sin esclarecerse 12.
A la fecha, las mutaciones en varios genes se han asociado con la EP: PARK 1 a PARK 15. Algunas de estas mutaciones están asociadas a casos familiares autosómico dominantes (PARK 1/4: alpha-synucleina, PARK 8: LRRK2) o recesivos (PARK 2: Parkina, PARK 6: DJ-1 y PARK 7: PINK1, PARK 13: ATP13A2) de la EP 10,13,14.
Recientemente, diversos estudios en varias poblaciones han identificado mutaciones en el gen leucine-rich repeat kinase 2 (PARK 8: LRRK2 o Dardarina) en casos autosómico dominantes y esporádicos de la EP 15,16. Mutaciones en LRRK2 causan EP en diferentes poblaciones y su prevalencia en casos familiares y esporádicos varía entre estos grupos 17,18. Estudios de la frecuencia de las mutaciones en LRRK2 en poblaciones Latino Americanas son escasos. En Brasil, la prevalencia de la mutación p.G2019S en LRRK2 es cercana al 2%, siendo más prevalente entre casos de EP familiares que en casos esporádicos (8.7% vs 0.76%) 19. En la población chilena la prevalencia de esta mutación es cercana al 3% 20.
En el presente artículo se analizó la prevalencia de la mutación p.G2019S en LRRK2 en una muestra de casos de EP no relacionados, de origen Caucásico-mestizo de Colombia.
Materiales y Métodos
Analizamos la frecuencia de la mutación p.G2019S (c.6055G>A transición) en un estudio de casos y controles de 154 pacientes con EP y 162 controles. Los casos de EP fueron 92 hombre y 62 mujeres (edad promedio: 59.53 años; DE: 15.01); los controles fueron 60 hombres y 102 mujeres (edad promedio: 74.89 años; DE: 12.33). Veintiocho pacientes tuvieron EP de inicio temprano (menores de 40 años: edad promedio de inicio: 29.39 años; DE: 7.76). De inicio tardío de EP fueron 126 pacientes (edad promedio de inicio: 58.17 años; DE: 10.52), los casos esporádicos fueron 130 casos (edad promedio de inicio: 53.41 años; DE: 14.84) y 24 casos familiares (edad promedio de inicio: 48.70 años; DE: 16.61).
Tanto los pacientes como los controles fueron analizados por un grupo interdisciplinario en la Clínica de Movimientos Anormales de la Universidad Nacional de Colombia entre 2005-2014. El diagnóstico se realizó siguiendo los criterios del United Kingdom Parkinson's Disease Society Brain Bank (UK PDSBB) 21. Los controles estuvieron libres de cualquier alteración motora o cognitiva y no tenían historia familiar de la enfermedad. El protocolo fue aprobado por el comité de ética de la Facultad de Medicina, Universidad Nacional de Colombia y tanto pacientes como controles firmaron un consentimiento informado autorizando su participación en este estudio.
EL ADN fue extraído a partir de sangre periférica utilizando el kit de aislamiento Wizard Genomics DNA (Promega Corporation, Madison WI). Las mutaciones en LRRK2 fue genotipificado siguiendo la metodología descrita por Nichols 16. El ADN genómico fue amplificado usando los primers forward (5´-TTTTGATGCTTGACATAGTGGAC-3') y reverse (5´-CACATCTGAGGTCAGTGGTTATC-3'), en una reacción de amplificación con 50 ng de ADN, 25 pmol de cada primer, 250 µM de cada dNTP, 1.5 mM de MgCl2, 2.5 µL de buffer de reacción 10X y 1U de Taq polimerasa, en un volumen final de 25 µL. Las condiciones de amplificación fueron las siguientes: un paso inicial de desnaturalización a 94º C por 5 min seguido por 35 ciclos de 94º C por 30 s, 60º C por 30 s, 72º C por 45 s, y una extensión final de 10 min a 72º C. Los productos de PCR fueron sujetos a digestión y análisis por la endonucleasa de restricción Sfc1 (New England BioLabs, USA), resueltos en electroforesis en gel de agarosa al 70% NuSieve y 30% SeaKeam agarose y visualizado con bromuro de etidio bajo la luz ultravioleta. Los fragmentos de amplificación fueron de 228 y 101 bp para los no mutados, y 228, 207, 101 y 21 bp para los mutados heterocigotos. El secuenciamiento del ADN se realizó usando BigDye terminator siguiendo las recomendaciones del fabricante y analizado en el secuenciador automático ABI-PRISM 3500 (Applied Biosystems, USA). El software NovoSNP se usó para el análisis de las mutaciones.
Resultados
La frecuencia de la mutación p.G2019S en LRRK2 fue del 1.3% en pacientes (2/154) y 0.6% en controles (1/162) (p= 0.9777). Los dos casos con mutación p.G2019S en LRRK2 fueron heterocigotos para la mutación y exhibieron los signos clásicos de EP (Tabla 1). Ambos tenían Buena respuesta a L-Dopa y experimentaron disquinesias inducidas por L-Dopa. El control con la mutación p.G2019S en LRRK2 no presentó ni alteraciones motoras ni cognitivas a los 77 años, y no tiene historia familiar de EP.
| Caracteristicas | Paciente 1 | Paciente 2 | Control |
| Sexo | Femenino | Masculino | Masculino |
| Origen etnico | MC | MC | MC |
| Historia familiar | no | si* | no |
| Edad al examen (años) | 79 | 67 | 77 |
| Edad al inicio (años) | 71 | 60 | n/a |
| Bradiquinesia | si | si | no |
| Temblor de reposo | si | no | no |
| Rigidez | si | si | no |
| Inestabilidad postural | si | si | no |
| Asimetría al inicio | si | si | no |
| Distonía | no | no | no |
| Alteraciones comportamiento | no | no | no |
| Respuesta a L-DOPA | si | si | n/a |
| Decline Cognitivo | no | no | no |
| Disquinesia inducida por L-DOPA | si | si | n/a |
| MC= mestizo caucasico *Madre y medio hermano afectado n/a= no aplicable | |||
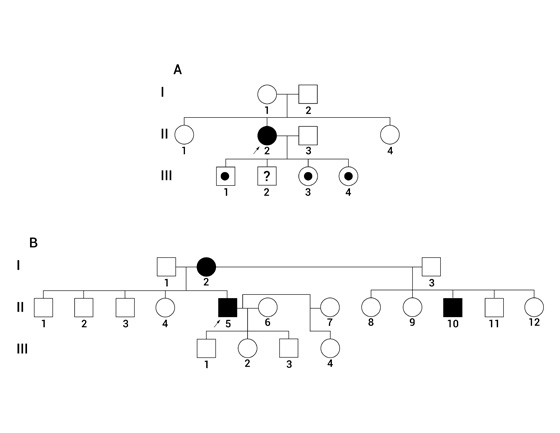
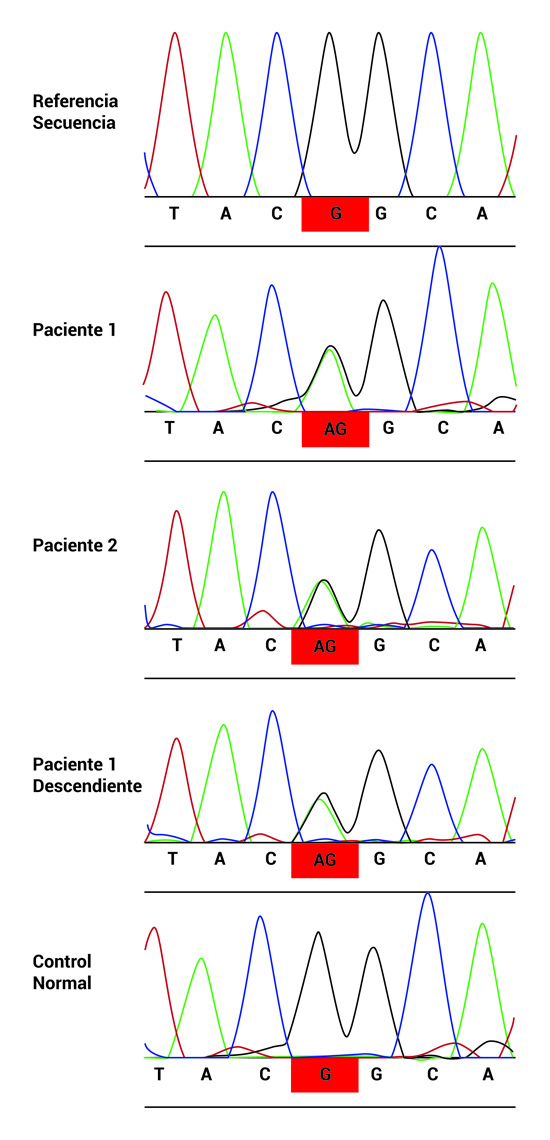
El estudio familiar de uno de los casos positivos para la mutación p.G2019S en LRRK2 (sin historia familiar para la enfermedad) reveló la presencia de la mutación en 3 de 4 de sus descendientes, ninguno de los cuales ha sido afectado con la enfermedad. Sin embargo, debe considerarse que se ha descrito una penetrancia de la mutación dependiente de la edad de p.G2019S en LRRK2. El mayor de ellos tenía 42 años al momento del examen y los otros, un hombre de 40 años, una mujer de 39 años, y el menor de 36 años. Todos ellos son heterocigotos (Figs. 1A y 2). La familia del otro paciente positivo para la mutación p.G2019S en LRRK2, quien tiene historia familiar para la EP, se rehusó a participar en el estudio (Fig. 1B). El control positivo para la mutación no tiene descendientes ni hermanos.
Figura 1.
Pedigrí de los pacientes positivos para la mutación pG2019S en LRRK2. A. Pedigrí de paciente femenina en la que no se reportó historia familiar. Se encontró una mujer afectada (Generación II, individuo 2) B. Pedigrí de un paciente masculino con historia familiar de EP. Se observan múltiples individuos afectados (Generación I, individuo 2; Generación II, individuo 5 y 10). Cuadrado o círculo vacío: Hombre o mujer no afectado; Cuadrado o círculo lleno: Hombre o mujer afectado; punto dentro de cuadrado o circulo: portador asintomático. Los pedigrí fueron realizados utilizando el software Pelican.
Figura 2.
Secuencias del gen LRRK2 que confirma la mutación pG.2019S en LRRK2 pG.2019S en pacientes 1 y 2, y descendientes del paciente 1 (Sólo se muestra uno de ellos, pero la mutación estaba presente en 3 de 4 descendientes).
Aunque la mutación pG2019S en LRRK2 es un factor infrecuente causal para la EP en Colombia, se observa una tendencia al incremento en el riesgo (OR= 2.118, CI 95%= 0.190-23.616), que es de poco poder para considerarlo significante.
Discusión
La etiología de la EP es compleja y no ha sido totalmente clarificada 10,13. Las mutaciones en LRRK2 han sido descritas en diversas poblaciones, con variaciones en su frecuencia. La mutación más frecuente en LRRK2 es la p.G2019S. La frecuencia de esta mutación es alta en norte Africanos (41%) 18, seguido por los Judíos Askenazi (18.3%) 22; en Europa y Norte América es cercana al 0.8-6% 23;24;25, mientras que es menor entre Latino Americanos 19,20,26 y ausente en Asiáticos 27 (Tabla 2). La más probable explicación de las diferencias observadas en la frecuencia es la base genética de cada muestra, siendo Latino América y Colombia en particular, una población altamente mezclada 28, que define su susceptibilidad específica al desarrollo de la enfermedad. De hecho, la mutación ha sido analizada en diferentes poblaciones y los hallazgos sugieren la posibilidad de un ancestro común para esta mutación, considerándose un patrón de evolución demográfico y geográfico 29.
p>
| Población | Frecuencia p.G2019S (%) | Referencia | |
| Chile | 5/166 (3.0) | Perez-Pastene et al.20 | |
| Brasil | 3/154 (2.0) | Pimentel et al.19 | |
| Brasil | 3/83 (3.5) | Munhoz et al.26 | |
| España | 16/302 (5.3) | Gaig et al.31 | |
| España | 8/105 (7.6) | Infante et al.32 | |
| España | 5/225 (2.7) | Mata et al.33 | |
| Italia | 5/513 (0.8) | De Rosa et al.25 | |
| Uruguay y Perú | Uruguay 5/125 (0.04); Perú 1/240 (0.4) | Mata et al.29 | |
| Argentina | 3/55 (5.5) | Gatto et al.30 | |
| Arabes Norte Africanos | 4/17 (41.0) | Lesage et al.18 | |
| Judios Azkenashi | 22/120 (18.3) | Ozelius et al.22 | |
| Población Asiática | 0/675 (0.0) | Tan et al.27 | |
| Colombia | 2/154 (1.3) | Estudio presente |
La frecuencia de la mutación p.G2019S en LRRK2 en la población Colombiana es una de las menores observadas entre las poblaciones Latino Americanas y una de las menores en el mundo. Reportes en Perú, Chile y Brasil han descrito frecuencias de esta mutación entre 0.4-3.5% 19,20,30, y mayores en Argentina y Uruguay (4-5%) 30,31. Sin embargo, las pequeñas diferencias observadas en la frecuencia de esta mutación entre el presente estudio y otras poblaciones Latino Americanas y Europeas podría estar más asociadas a característica metodológica, como el tamaño y la composición de las muestras analizadas (número de casos familiares y esporádicos en cada estudio).
Las características clínicas de los casos positivos para la mutación p.G2019S en LRRK2 no difieren de otros casos de EP, lo que coincide con el fenotipo descrito previamente para portadores de la mutación en otras poblaciones 15,32,33,34. El control positivo para la mutación es completamente asintomático a los 77 años.
No se hallaron ni signos motores, ni cognitivos, ni otros cambios neurológicos. Esto puede explicarse por un proceso de penetrancia incompleta de la mutación, como se ha descrito previamente para los portadores de la mutación pG2019S en LRRK2 por encima de los 70 años de edad 15,32.