Introducción
La tuberculosis (TB) es una enfermedad altamente contagiosa causada por la bacteria Mycobacterium tuberculosis, que amenaza actualmente una proporción significativa de la población mundial, principalmente gracias a su capacidad para inducir una infección latente. Se ha estimado que esta enfermedad causa aproximadamente 9 millones de casos nuevos y 1.4 millones de muertes cada año, lo que ubica a la tuberculosis en el segundo lugar en mortalidad entre todas las enfermedades infecciosas en el mundo 1. Después de la infección, la tuberculosis activa se desarrolla en el 5% de los individuos mientras que el 90% porta la infección latente por el resto de sus vidas, ya que son incapaces de lograr la completa erradicación del patógeno 2,3. Durante el encuentro con el hospedero, los bacilos entran a los pulmones en partículas en aerosol, causando la infección y activando a los macrófagos alveolares y células dendríticas. Los macrófagos infectados liberan citoquinas y quimiocinas que disparan una fuerte respuesta inflamatoria que conduce a la formación de un granuloma.
El granuloma es una acumulación celular organizada que se forma alrededor de los bacilos 4. Se ha sugerido que la respuesta inmune del hospedador es capaz de ajustarse y responder al estado fisiológico de la bacteria, causando una modulación en la expresión de genes directamente en el sitio de la infección 5. La completa erradicación de los bacilos no se lleva a cabo, ya que la bacteria ha desarrollado estrategias que le permiten persistir dentro del granuloma por largo tiempo, pudiendo en algunas ocasiones escapar del granuloma y diseminarse local y sistémicamente 6. Por lo tanto, bajo ciertas condiciones fisiológicas (desnutrición, envejecimiento, etc.) ó patológicas (infección por VIH, diabetes, cáncer, etc.), M. tuberculosis es capaz de reactivarse y escapar del granuloma y diseminarse 7. Un mejor entendimiento de los mecanismos involucrados en la formación y mantenimiento del granuloma puede ayudar en el desarrollo de terapias dirigidas contra la tuberculosis 4.
Diversos modelos animales 8,9 y humanos in vitro 10-12 han sido desarrollados para tratar de entender la compleja secuencia de eventos moleculares tempranos involucrados en la formación del granuloma. Los modelos in vitro en particular representan un valioso instrumento para la identificación de los mecanismos implicados en la respuesta inmune temprana dirigida contra micobacterias definidas 13. En el presente estudio hemos utilizado el modelo in vitro para el desarrollo del granuloma propuesto y caracterizado por Puissegur et al. 11, el cual ha demostrado su utilidad para el estudio de las interacciones moleculares entre la micobacteria y las células hospedadoras humanas usando micobacterias vivas y células mononucleares de sangre periférica (PBMCs: peripheral blood mononuclear cells). Usando este modelo, en el presente estudio hemos determinado los perfiles globales de la expresión génica que se inducen durante la formación in vitro de granulomas en respuesta a la infección con la cepa M. tuberculosis H37Ra. El análisis de genes y vías alteradas durante el desarrollo de estos granulomas in vitro puede ser de gran utilidad para entender los eventos moleculares tempranos que tienen lugar durante la interacción hospedador-patógeno.
Materiales y Métodos
Células inmunes y bacteria
Se obtuvo sangre periférica a partir de donantes sanos luego que los mismos aceptaron participar del estudio y firmaron un consentimiento informado. Las células mononucleares de sangre periférica (PBMCs) se aislaron usando un gradiente de centrifugación en Ficoll-Hipaque 1077 (Sigma Chemical Co., St Louis MO, USA) y luego se resuspendieron en medio RPMI 1640 suplementado con 10% de suero fetal bovino. Las células bacterianas de la cepa H37Ra de M. tuberculosis se cultivaron en el medio basal modificado de Lowenstein-Jensen. Las bacterias fueron recolectadas en caldo Middlebrook 7H9 (BD Difco Biosciences, Mountain View, CA, USA) y mezcladas extensivamente con agujas de jeringa, para ser posteriormente cultivadas con diluciones seriadas en medio Lowenstein-Jensen modificado. La viabilidad de las células se determinó mediante conteo de unidades formadoras de colonias (CFU) en el medio basal.
Inducción de los granulomas in vitro
Las PBMCs se transfirieron a platos de cultivo celular de 24 pozos a una concentración de 1×105 células por pozo en RPMI 1640 suplementado con 10% FBS. Seguidamente se agregó a cada pozo una suspensión de células frescas de M. tuberculosis H37Ra o BCG con una multiplicidad de infección (MOI) de 0.1. Las células fueron de inmediato cultivadas a 37 °C y monitoreadas en periodos de 24 h durante 5 dias. Se hizo recambio del medio de cultivo cada 48 h. Para evaluar la especificidad de la reacción del granuloma, se hicieron cultivos adicionales de PBMCs en presencia de Escherichia coli ATCC 25922 o Staphylococcus aureus ATCC 25923, con MOI de 0.1. También se incluyeron como controles PBMCs cultivadas en ausencia de bacterias.
Microscopía óptica y monitoreo celular
Para monitorear el progreso de la agregación celular, las células cultivadas fueron observadas bajo un microscopio invertido (Nikon, Chiyoda-ku, Tokyo, Japan) y se tomaron fotografías con un sistema de captura Nikon. Cada 24 h durante un total de 5 días de cultivo, las células fueron sometidas a tinción Wright-Giemsa (W-G) modificada (Sigma-Aldrich, St Louis, MO, USA) siguiendo las instrucciones del fabricante.
Microscopía de transmisión electrónica
A las 48 h post-infección, los agregados celulares fueron recolectados cuidadosamente, fijados por 4 h a 4 oC en 2% glutaraldehído en 0.1 M de bufer de cacodilato con 6 mM CaCl2, pH 7.4. Después de lavar con bufer cacodilato, los granulomas fijados fueron tratados durante una hora con tetróxido de osmio al 1% en 0.1 M bufer cacodilato, luego se deshidrataron y se embebieron en una resina Epon-araldita. Secciones de 0.5 µm se obtuvieron en un microtomo y se montaron en rejillas de cobre, se tiñeron con acetato de uranilo y citrato de plomo al 3%, y se examinaron con un microscopio de transmisión electrónica Zeiss 10 C.
Perfiles de expresión con micromatrices
Para los estudios con micromatrices, los granulomas fueron preparados in vitro por triplicado, mediante infección de las PBMCs con Mtb H37Ra durante 24 h. Al cabo de este tiempo, los granulomas se recolectaron y se sometieron a extracción de ARN. Como control del experimento, PBMCs fueron también cultivadas por triplicado en las mismas condiciones. El ARN total de los granulomas inducidos por H37Ra y de las PBMCs controles fueron procesadas en las instalaciones de micromatrices del New York Medical College e hibridizadas en forma individual a chips de Affymetrix Human Genome GeneChip U133 plus2 (Affymetrix, Santa Clara, CA). Los archivos escaneados resultantes fueron analizados con el programa dChip v1.3 (www.dchip.org) y con Affymetrix MicroArray Suite 5.0 (MAS 5.0). Los datos de las micromatrices fueron normalizados con el programa dChip v1.3 usando el método de normalización del grupo invariante 14, y se obtuvieron los estimados de expresión génica basados en modelo y algoritmo de detección de "valores atipicos" de acuerdo al modelo "perfect-match-only" desarrollado por Li-Wong 14; los transcritos considerados como "valores atipicos" fueron excluidos de los análisis subsiguientes. El programa Affymetrix MAS 5.0 fue usado para determinar si los transcritos fueron detectados como presentes, ausentes, marginal, o no detectados. Para el nivel de expresión significativo, se usó un punto de corte de 500 unidades. Los datos de ADN generados por las micromatrices a partir de los granulomas in vitro fueron comparados a los datos generados por las micromatrices a partir de PBMCs no infectadas usando el programa dChip v1.3 y los archivos de expresión resultantes fueron sometidos a análisis de vías biológicas y de grupos funcionales para determinar la significancia de los cambios en un contexto biológico. Todos los datos generados por las micromatrices siguieron las normas MIAME (Minimum Information about a Microarray Experiment) y los datos crudos fueron depositados en la base de datos GEO (Gene Expression Omnibus, Accession Number: Series GSE16250).
Análisis de las vías biológicas
Para identificar las vías biológicas afectadas durante la formación in vitro de los granulomas, los datos de micromatrices fueron analizados con los programas GenMAPP (Gene Map Annotator and Pathway Profiler) y MAPPFinder desarrollados en los Institutos Gladstone de la Universidad de California en San Francisco 15 (www.genmapp.org). Los criterios usados para el análisis GenMAPP/MAPPFinder para la expresión aumentada fueron: una intensidad promedio mínima de 500 unidades, un porcentaje de detección de P (presente) de 100, un "fold change" ≥2.0 entre los granulomas comparados con las PBMCs no infectadas. Los criterios para la expresión disminuida fueron un mínimo de intensidad de 500 unidades, un porcentaje de P (presente) de 100, y un "fold change" de ≤2.0 entre los granulomas comparados con las PBMCs no infectadas. Los programas generaron un valor Z basado en la distribución hiper-geométrica.
Validación de los datos de las micromatrices por PCR cuantitativa en tiempo real
Para validar los datos de expresión generados por las micromatrices, se realizó una PCR cuantitativa en tiempo real (qRT-PCR) para genes seleccionados utilizando los mismos RNAs individuales usados en los experimentos con las micromatrices 16. Acido ribonucleico total (1 µg) de cada muestra fue sometido a una transcripción inversa para generar cADN de primera cadena en un volumen de reacción de 20 µL, usando QuantiTect Reverse Transcriptase kit (Qiagen) y la qRT-PCR se realizó con QuantiTect SYBR Green PCR Master Mix (Qiagen) siguiendo las instrucciones del fabricante. Los niveles de expresión génica fueron determinados en un termociclador StepOne (Applied Biosystems, Grand Island NY, USA). Se diseñaron cebadores específicos para los genes blanco seleccionados y para genes constitutivos usando el programa Primerblast software. Para estimar la reproducibilidad de los datos, cada muestra fue analizada en duplicado en la reacción de PCR.
Análisis estadístico
Para evaluar la reproducibilidad, todos los experimentos se realizaron en réplicas, y además también se realizaron experimentos independientes. Los cálculos de la expresión génica se efectuaron con el programa Sequence Detection System 2.1 (Applied Biosystems) usando el método comparativo CT (2-ΔΔCT). β-actin e Hypoxanthine-guanine phosphoribosyl transferase (HPRT) se utilizaron como genes constitutivos de referencia. Los datos fueron analizados usando el programa SPSS 19.0 (SPSS Inc, Chicago, IL, USA). La significancia estadística de los cambios se determinó mediante la prueba t de Student.
Resultados
La infección de PBMCs humanas induce la formación de Granulomas
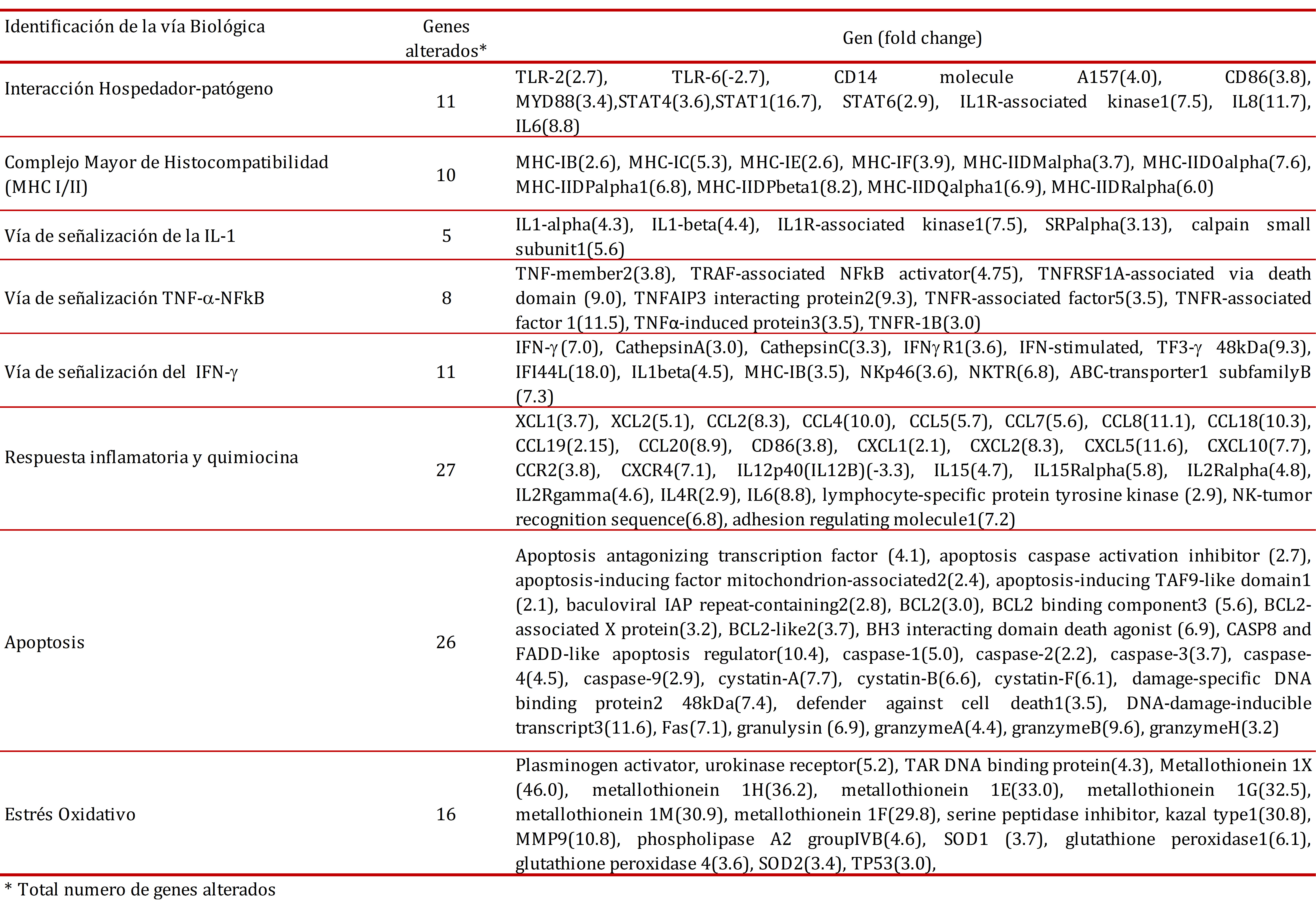
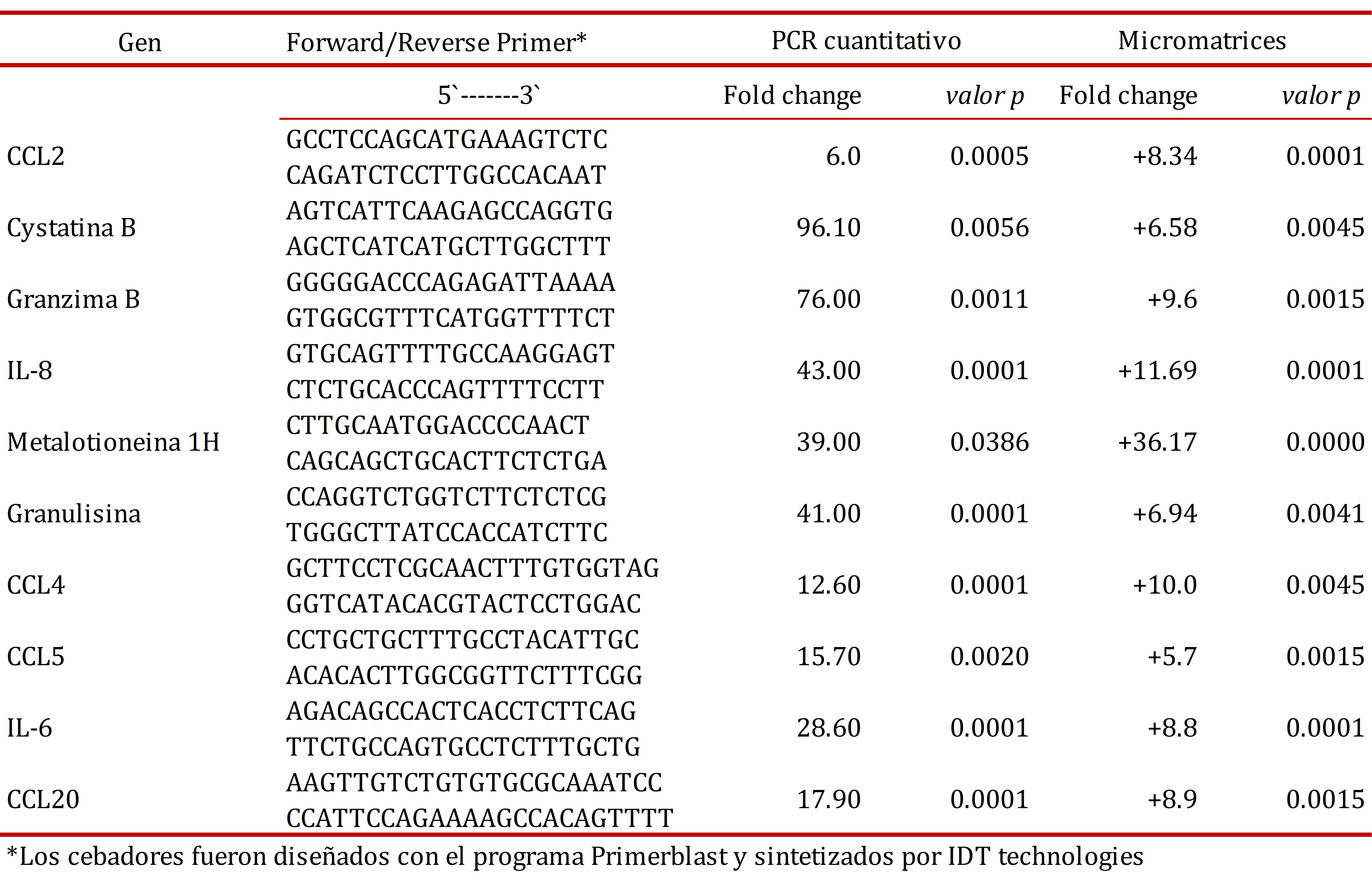
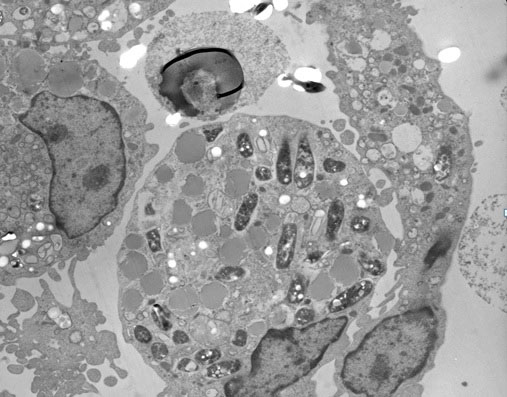
Para replicar la formación de los granulomas en un modelo in vitro, se infectaron PBMCs humanas con M. tuberculosis H37Ra o BCG, y seguidamente se incubaron por 5 días. A las 24 h de incubación, las PBMCs tendieron a formar agregaciones celulares de linfocitos en presencia de H37Ra (Fig. 1A) o BCG (Fig. 1B). Las muestras controles correspondientes de los mismos donadores cultivadas en presencia de Escherichia coli ATCC 25922 o Staphylococcus aureus ATCC 25923, o cultivadas en ausencia de bacterias no formaron estos agregados (Figs. 1C, 1D, 1E) indicando que los agregados celulares se forman específicamente en respuesta a la infección con micobacterias. Estas acumulaciones celulares con forma similar a los granulomas, fueron confirmadas mediante tinción Wright-Giemsa a las 24 h siguientes a la infección con M. tuberculosis H37Ra (Fig. 1F). La microscopía de transmisión electrónica de estos agregados evidenció el atrapamiento de las micobacterias por los fagocitos presentes en las agregaciones celulares a las 48 h post-infección (Fig. 2). Las estructuras granulomatosas formadas in vitro persistieron por 96 h, y luego comenzaron a desvanecerse.
Figura 1.
Infección de PBMC humanas con Mycobacterium tuberculosis resultó en la formación de granulomas microscópicos. PBMCs infectadas con: (A) H37Ra (x100), (B) BCG (x100), (C) Escherichia coli ATCC 25922 (x200), (D) Staphylococcus aureus ATCC 25923 (x200), o (E) PBMCs no infectadas (x100). (F) Tinción Wright-Giemsa en la que se muestran los microgranulomas formados a las 24 h siguientes a la infección con H37Ra (x400).
Figura 2.
Microscopía de Transmisión electrónica de un granuloma inducido por H37Ra. Después de 48 h siguientes a la infección, las agregaciones celulares fueron recolectadas, fijadas y embebidas en una resina de Epon-araldite. Secciones de 0.5 µm fueron obtenidas, teñidas y observadas bajo microscopio de transmisión electrónica (x4,000). Se pueden observar múltiples vesículas fagosomales conteniendo la bacteria H37Ra.
Perfiles de expresión con micromatrices de granulomas in vitro inducidos por H37Ra
Del total de 25,690 genes analizados con los microarreglos, 2,195 se encontraron sobreexpresados ("fold change" ≥2, p ≤0.05) y 106 subexpresados ("fold change" ≤-2, p ≤0.05) en los granulomas in vitro comparados con las PBMCs no infectadas. Se encontró que el 60% de los genes alterados estuvieron relacionados con la respuesta inmune, tales como el procesamiento antigénico, vías de señalización (TLR2, TNF-, IL6-, IL-8, quimiocinas), 25% de los genes estuvieron relacionadas con procesos metabólicos y 15% estuvieron relacionados con estrés oxidativo y apoptosis (Tabla 1). Se encontró sobreexpresión de TLR2, CD14, CD86 y MyD88, los cuales corresponden a componentes principales de la vía de señalización de TLR2 de la respuesta inmune innata. También encontramos expresión aumentada de moléculas MHC-I y MHC-II involucradas en la presentación antigénica por células presentadoras de antígenos (APC), un proceso esencial para la contención de la infección por M. tuberculosis. En nuestro modelo del granuloma in vitro, a las 24 h post-infección con M. tuberculosis H37Ra, observamos una inducción significativa de un número de transcritos implicados en las vías de señalización de la respuesta inmune proinflamatoria dependientes de quimiocinas, incluyendo XCL1(3.7), XCL2(5.1), CCL2(8.3), CCL4(10.0), CCL5(5.7), CCL7(5.6), CCL8(11.1), CCL18(10.3), CCL19(2.15), CCL20(8.9), CXCL1(2.1), CXCL2(8.3), CXCL5(11.6), CXCL10(7.7), y receptores de quimiocinas CCR2(3.8) y CXCR4(7.1). Se encontró además expresión aumentada de genes relacionados con apoptosis tales como caspasa-1 (5.0), caspasa-2 (2.2), caspasa-3 (3.7), caspasa-4 (4.5) y caspasa-9 (2.9). También se encontró expresión aumentada de granulisina y granzimas A, B y H, las cuales son componentes mayores de los gránulos citoplasmáticos de los linfocitos T citotóxicos y células NK, los cuales están involucrados en la apoptosis mediada por células. Adicionalmente observamos expresión aumentada de genes codificantes de las catepsinas A, C, D, y W, las cuales son un tipo de peptidasas implicadas en la activación de los linfocitos T CD8+. También se identificó la expresión alterada de un número de quimiocinas no previamente implicadas en la respuesta inmune a M. tuberculosis, tales como CCL8 (MCP-2), CCL7 (MCP-3), XCL1 (linfotactina) y XCL2.
Validación por qRT-PCR de la expresión de genes seleccionados
Para validar los datos obtenidos con los microarreglos, se realizó qRT-PCR para un grupo de 10 genes, incluyendo las quimiocinas proinflamatorias (CCL2, IL8, CCL5, CCL18), moléculas efectoras involucradas en los mecanismos de muerte celular dependiente de células T citotóxicas (cistatina B, granzima B, granulisina), y metalotioneínas (1H, 1M, 1G). Los resultados se muestran en la Tabla 2. Los valores positivos indican un aumento en la expresión génica en los granulomas in vitro a las 24 h posteriores a la infección con H37Ra comparado con PBMCs cultivadas por 24 h en ausencia de bacterias. Los niveles de expresión génica obtenidos por qRT-PCR fueron concordantes con los niveles correspondientes observados con los experimentos con micromatrices.
Discusión
En este estudio se utilizó un modelo previamente descrito en la literatura para el desarrollo del granuloma tuberculoso in vitro, con el objetivo de determinar los perfiles de expresión génica asociados con este proceso. Usando este modelo, observamos que los linfocitos presentes en PBMCs humanas se agruparon alrededor de los bacilos infectantes semejando microagregados tipo granuloma (Fig. 1). Los microgranulomas se formaron específicamente en respuesta a la infección con M. tuberculosis, ya que no hubo formación de estas estructuras cuando las PBMCs se cultivaron en presencia de células vivas de E. coli o S. aureus ni cuando las PBMCs se cultivaron en ausencia de bacterias. El desarrollo y mantenimiento de los granulomas en el pulmón es la principal defensa del hospedador contra la infección por M. tuberculosis 17,18. Los análisis con micromatrices de estos granulomas formados in vitro nos permitió un mejor entendimiento de las interacciones tempranas que tienen lugar entre el hospedador y el patógeno durante la formación del granuloma en respuesta a la infección por M. tuberculosis H37Ra (ATCC 25177). El reconocimiento inicial del M. tuberculosis por la respuesta inmune innata involucra la señalización a través de los TLR2, el cual está influenciado por varios receptores accesorios, principalmente CD14 17,18. Los lipomananos de las especies de micobacterias son agonistas de TLR2, los que luego de la unión del ligando inducen la activación de macrófagos, que se caracteriza por la expresión en la superficie celular de CD40 y CD86, producción de citoquinas y quimiocinas, presentación antigénica, entre otras características de la respuesta inmunes innata 19. La activación de macrófagos está mediada a través de la proteína adaptadora MyD88 (factor de diferenciación mieloide 88), pero de forma independiente del reconocimiento por TLR4 o TLR6 20,21. De manera consistente con esta información, en el presente estudio encontramos la sobreexpresión de TLR2, CD14, CD86 y MyD88, lo cual apoya la importancia de la vía de señalización TLR2 en la respuesta inmune innata a M. tuberculosis H37Ra. Las interacciones entre M. tuberculosis y las células de la respuesta inmune innata lleva a la secreción de quimiocinas y citoquinas, de las cuales el IFNγ y el factor de necrosis tumoral (TNF) son particularmente importantes en la TB. Un efecto importante del IFNγ es el de activar macrófagos y aumentar en los mismos la expresión de moléculas MHC clase II, conducentes a un aumento en la presentación de antígenos a células T, lo que constituye un evento crucial para la contención de la infección por la micobacteria 22. En este trabajo encontramos que la infección por H37Ra resultó en un aumento en la expresión de moléculas MHC-I y MHC-II involucradas en la presentación antigénica de células presentadoras de antígenos (APC), un proceso esencial para contener la infección por M. tuberculosis.
El efecto más prominente observado en este estudio fue la inducción de muchos genes codificantes de quimiocinas y citoquinas. Se conoce que varias citoquinas juegan un papel importante en la inmunidad contra el bacilo de la tuberculosis. Se ha descrito previamente la expresión aumentada de transcritos para IFNγ TNFα, IL-6, IL-8 e IL-12 en el granuloma tuberculoso 23 y la secreción de citoquinas IL-1β, TNFα e IL-6 en el lavado bronco-alveolar en la tuberculosis pulmonar 24. El análisis transcriptómico de las lesiones granulomatosas tempranas en los pulmones de primates no-humanos con tuberculosis activa, reveló la presencia de un microambiente altamente inflamatorio, con niveles de expresión elevados de componentes de las vías de señalización inmunes, tales como IFNγ, TNFα, JAK, STAT y quimiocinas CC/CXC 25. En nuestro estudio en el que se utilizó un modelo in vitro del granuloma, a las 24 h posteriores a la infección con M. tuberculosis H37Ra, observamos una inducción significativa de un número de vías de señalización proinflamatorias dependientes de quimiocinas, IFNγ y TNF.
Ha sido ampliamente demostrado que las quimiocinas participan activamente en la respuesta inmune protectora contra la infección por M. tuberculosis 26, siendo muchas de ellas quimioatrayentes para leucocitos hacia los sitos de infección. Nuestro análisis de expresión global con microarreglos reveló diferencias significativas en la expresión de quimiocinas CXCL- y CCL- tales como CXCL1 (Gro-α), CXCL2 (Gro-β), CXCL5 (ENA-78), CXCL8 (IL-8) y CXCL10 (IP-10). Entre ellas, los transcritos para CXCL5 fueron los más altamente sobreexpresados. Esta quimiocina, junto con IL-8, es inducida en respuesta a citoquinas proinflamatorias tales como IL-1 o TNFα, las cuales son potentes activadores de neutrófilos 27. Estudios previos han mostrado que CXCL5 conlleva a un aumento en el número de neutrófilos infiltrantes en carcinoma broncoalveolar y en la infección por Rhinovirus 28; sin embargo, su función en la tuberculosis no está esclarecida 29.
Este estudio nos permitió identificar niveles aumentados de transcritos para CCL19 y CCL20. Estas dos quimiocinas participan en el reclutamiento y activación de linfocitos a los sitios de inflamación. La inducción de numerosas quimiocinas en el granuloma in vitro temprano es un hallazgo esperado, ya que se conoce que los gradientes de quimiocinas guían diferentes células inmunes efectoras a los sitios de infección. Se ha demostrado que las quimiocinas están asociadas estrechamente con las infecciones por micobacterias, requiriéndose niveles apropiados de ellas para prevenir la migración celular fuera del granuloma, contribuyendo así al mantenimiento de la estructura del granuloma 30.
La función ejercida por las vías de señalización inmunes proinflamatorias que implican al IFNγ y al TNFα en la protección contra la infección por M. tuberculosis está bien comprendida 31. Entre los genes sobreexpresados encontrados en este trabajo están la IL15 e IL15R. Varios estudios han suministrado evidencia de que la vía activada por esta citoquina puede aumentar la respuesta inmune protectora contra la infección por M. tuberculosis 32. Otra quimiocina altamente sobreexpresada encontradas en los granulomas in vitro de este estudio fue CXCL8 (IL8). Esta quimiocina ha sido implicada previamente en la formación del granuloma tuberculoso y en la inmunidad a M. tuberculosis 33.
El presente trabajo permitió identificar la expresión alterada de varios genes relacionados con apoptosis, incluyendo caspasas, granulisina, granzimas y catepsinas. Se ha reportado que la infección por M. tuberculosis causa apoptosis de neutrófilos 34 y monocitos/macrófagos 34,35. Los macrófagos son las células hospedadoras primarias para M. tuberculosis y como consecuencia hay extensa muerte celular en esta población celular. Específicamente se ha demostrado que cepas atenuadas o avirulentas de micobacterias, tales como BCG y H37Ra, principalmente inducen apoptosis de macrófagos, mientras que las cepas virulentas principalmente inducen necrosis. Estas observaciones han generado interés en el campo del desarrollo de vacunas contra la TB ya que cepas de micobacteria con actividad pro-apoptotica capaces de inducir una mayor apoptosis de los macrófagos estimularían una mejor respuesta cuantitativa de células T 36. La catepsina C, la cual se encontró sobreexpresada en este estudio, participa en la activación de granzimas y en el proceso de muerte celular mediado por células T citolíticas 37,38, mientras que la catepsina W se asocia con células NK. Por lo tanto estas moléculas juegan un papel esencial en la citotoxicidad 39. La expresión aumentada de todos estos genes pro-apoptóticos puede reflejar el intento del sistema inmune innato de limitar la infección al restringir el crecimiento del M. tuberculosis, y revela el rol que cumplen las diferentes caspasas, granzimas, y catepsinas en este proceso.
Además se encontró la inducción de metalotioneínas y metaloproteasas en los granulomas tempranos analizados en este estudio. Las metalotioneínas son proteínas ricas en cisteína, de unión a metales, de bajo peso molecular, (6 a 8 KDa), las cuales son inducidas por diferentes estímulos, incluyendo el estrés oxidativo generado durante el estallido respiratorio de los fagocitos 40. La metalotioneína 1H ha sido implicada en la inducción de quimiocinas in vitro 41. En cuanto a las metaloproteasas, detectamos un aumento significativo en los niveles de transcritos de MMP9 y de varias cistatinas. MMP9 es estabilizada y protegida por miembros de la superfamilia de las cistatinas sin que se afecte su actividad 42. Estudios recientes han mostrado la importancia de MMP9 en la interacción con proteínas secretadas por M. tuberculosis y en la inducción de la formación de las lesiones granulomatosas 43. Se ha reportado que el lipomanano de las micobacterias induce la expresión de MMP9 en macrófagos humanos a través de un mecanismo dependiente de TLR2 y CD14 44. La importancia de las células Th1 en el control de la tuberculosis está ampliamente aceptado 45 y nuestro estudio claramente muestra que M. tuberculosis H37Ra induce una fuerte respuesta Th1, reflejada en el aumento en la expresión de citoquinas Th1 tales como IFNg, TNFα, IL-6 e IL-1, las cuales median la exitosa resistencia contra la infección por M. tuberculosis 45,46. Nuestros resultados soportan esta información, ya que observamos que muchos genes inducibles y regulados por IFNg, tales como IFI-16, IFI-30, IFI-44, IRF-3, IRF-7 y IRF-1 estuvieron aumentados en los granulomas.
Finalmente, en este estudio identificamos la expresión alterada de un número de quimiocinas que no habían sido previamente implicadas en la respuesta inmune a M. tuberculosis, tales como CCL8 (MCP-2), CCL7 (MCP-3), XCL1 (linfotactina) y XCL2. La función potencial ejercida por estas quimiocinas en el establecimiento del granuloma tuberculoso requiere de investigación adicional. Todos los cambios descritos aquí tuvieron lugar a las 24 h posteriores a la infección de PBMCs por la cepa de M. tuberculosis H37Ra, lo que condujo a la formación temprana del granuloma. Por lo tanto, este modelo in vitro del granuloma en el que participan PBMCs humanas es adecuado para el estudio de los cambios muy tempranos que ocurren en la expresión génica durante la inducción de la formación del granuloma en respuesta a la infección por M. tuberculosis. El modelo puede ser usado para determinar cambios asociados a diferentes tipos de cepas de M. tuberculosis, incluyendo aislamientos clínicos. Este modelo pudiera ser de utilidad en el diseño de vacunas, para decidir cuáles cepas serían mejores candidatos, tomando como base los perfiles específicos de expresión génica que ellas sean capaces de inducir.