Introducción
La secuencia del genoma humano y el entendimiento del potencial que tiene el estudio de polimorfismos de un solo nucleótido (SNP, del inglés: Single NucleotidePolymorphisms) han generado una cantidad considerable de datos que revelan el fundamento genético de la asociación genética de cientos de enfermedades así como la toxicidad o la eficacia de diferentes medicamentos. La segunda área de estudio es conocida como "farmacogenética". La tecnología aplicada para revelar estas asociaciones se encuentra disponible y sus costos vienen reduciéndose progresivamente frente al beneficio de la optimización y aplicación clínica de sus hallazgos.
La respuesta de cada individuo frente a un mismo tratamiento puede ser en parte heredada, generando diferencias en su eficacia en cada sujeto debido al polimorfismo de genes que codifican enzimas implicadas en el metabolismo de algunos fármacos, en sus transportadores y/o en los blancos específicos del tratamiento 1.
Un gen esta descrito como "polimórfico" cuando presenta variantes alélicas que pueden alterar la actividad de la proteína comparada con el alelo original. La farmacogenética puede adicionalmente explicar las diferencias individuales frente al tratamiento alopático y podría tener un valor predictivo de la respuesta del paciente a diferentes medicamentos 2,3.
Un ejemplo clásico de la asociación farmacogenética está demostrado en la artritis reumatoide (AR) enfermedad inflamatoria que afecta entre el 0.5% y el 1% de la población. Una de las terapias más ampliamente utilizadas en esta enfermedad y con mayor efectividad desde el punto de vista clínico, es el metotrexato (MTX). Varios reportes describen su uso desde 1951, y los ensayos clínicos demuestran su eficacia pero también demuestran su toxicidad, incluyendo el incremento de nódulos, neumonitis, compromiso neurológico, complicaciones gastrointestinales como náuseas, vómito y diarrea, elevación de las transaminasas, anormalidades hematológicas, erupción cutánea, estomatitis y alopecia 4-6. Se han estudiado asociaciones de variantes genéticas y MTX relacionando la eficacia del tratamiento con los alelos del gen MTHFR. La actividad enzimática se reduce en un 35% en los portadores del polimorfismo C677T y este polimorfismo tiene una prevalencia de 40% en la población. La actividad del MTX se encuentra reducida entre un 50-70% en de los individuos homocigotos TT en la posición 677, con una prevalencia del 8-10% en la población 7.
Adicionalmente, el MTX inhibe la dihidrofolato-reductasa (DHFR) y las enzimas dependientes de folatos como son la timidilatosintasa (TS) y la metilen-tetrahidrofolato reductasa (MTHFR). Se ha demostrado que sus polimorfismos afectan la actividad de la enzima, causando niveles elevados de homocisteína y toxicidad 8.
Además el estudio de la enzima MTHFR ha adquirido mucho interés después el descubrimiento fundamental de Kang et al. 7, quienes informaron que una variante de la enzima termolábil se asoció con un mayor riesgo cardiovascular y una mayor concentración de homocisteína plasmática total. Hoy en día la concentración de la homocisteína en plasma se considera como un factor de riesgo para enfermedad coronaria, enfermedad cerebrovascular, y arterial periférica oclusiva 9. También se ha relacionado con la aparición de defectos en el tubo neural y otros defectos congénitos, complicaciones asociadas al embarazo 10,11 y cáncer 12
El análisis genético puede solicitarse de manera independiente sobre el gen MTHFR, o bien en el contexto de perfiles genéticos moleculares en el marco de la medicina preventiva. Estos perfiles evalúan asociaciones farmacogenéticas con medicamentos que incluyen al MTX. El análisis de los polimorfismos se puede realizar así por secuenciación directa del gen completo o de un fragmento de éste, por análisis de polimorfismos con enzimas de restricción (RFLP) o bien mediante la técnica de microarreglos. Con base en el espectro de la utilidad del análisis de este gen se determinó la frecuencia del polimorfismo C677T del gen MTHFR en un grupo de individuos sanos colombianos, con el fin de evaluar el fondo genético de nuestra población en relación a la susceptibilidad con las enfermedades y particularidades farmacogenéticas descritas.
Materiales y Métodos
Se realizó un estudio descriptivo retrospectivo de corte transversal en el cual se recolectaron resultados de 152 individuos sanos colombianos mayores de 18 años, incluyéndose la totalidad de solicitudes del análisis del perfil genético molecular a partir de muestra de saliva en el área de la medicina preventiva en el Instituto de Referencia Andino, incluyendo todas las solicitudes a partir de órdenes médicas y/o directas de los individuos recibidas entre los años 2012-2014. Todos los individuos firmaron previamente la autorización por consentimiento informado de utilización de los resultados respetándose la confidencialidad de los datos extraídos. Para el estudio se excluyeron los voluntarios cuyos resultados no presentaron los datos demográficos completos.
El panel de polimorfismos de los genes relacionados con farmacogenética evaluados por PathwayGenomics® en el Medication DNA Insight TM genetic test incluyeron 15 asociaciones de metabolismo para medicamentos entre estos el MTX, además de: hipersensibilidad al Abacavir®, ototoxicidad inducida por aminoglicósidos, respuesta a beta bloqueadores, hipersensibilidad a carbamazepina, metabolismo del clopidogrel, suplementación de estrógenos, interferón alfa, metabolismo al metoprolol, hipersensibilidad y metabolismo a la fenitoína, inhibidores de la bomba de protones, miopatía inducida por simvastatina, metabolismo de voriconazol y warfarina.
Se utilizaron microarreglos de ADN para medir los niveles de expresión de sondas con cada una de las mutaciones correspondientes a los alelos "C" y "T" en el gen MTHFR. Cada posición del microarreglo contiene picomoles (10-12 moles) de una secuencia específica de ADN en condiciones de alta astringencia. La hibridación sonda-diana se detectó y se cuantificó a través de fluoróforos unidos a la sonda.
Se analizó la frecuencia del polimorfismo C677T, consistente en una sustitución puntual C>T en el marcador rs1801133 del gen MTHFR, cuyo genotipo normal es C/C.
Cada participante fue identificado por un código para ser ingresado dentro de una base de datos, en donde el análisis descriptivo para las variables continuas como edad se realizó con la determinación de medidas de tendencia central y prueba de normalidad de Shapiro Wilkerson; la descripción de las variables categóricas (origen, sexo, genotipo y alelo) se realizó por análisis de frecuencias. Dada la naturaleza de la variable de estudio se evaluaron los niveles de asociación mediante la prueba estadística Chi² con un nivel de confianza y significancia del 95%. Además, de la evaluación del equilibrio de Hardy Weinberg. Los resultados obtenidos fueron transferidos al programa estadístico SPSS® V20 para Windows. No se estratificaron por grupo étnicos o niveles socioeconómicos.
Resultados
Se analizaron 152 individuos, incluyendo 68 hombres (44.7%) y 84 mujeres (55.3%), con edades de 40 ±13 años y 41 ±13 años, respectivamente. Los orígenes de las muestras fueron los siguientes: Medellín (15 individuos: 9.9 %), Cali (10 individuos: 6.6 %), Bogotá (119 individuos: 78.3%), Barranquilla y Cartagena (6 individuos: 3.9%), Pasto (2 individuos: 1.3 %).
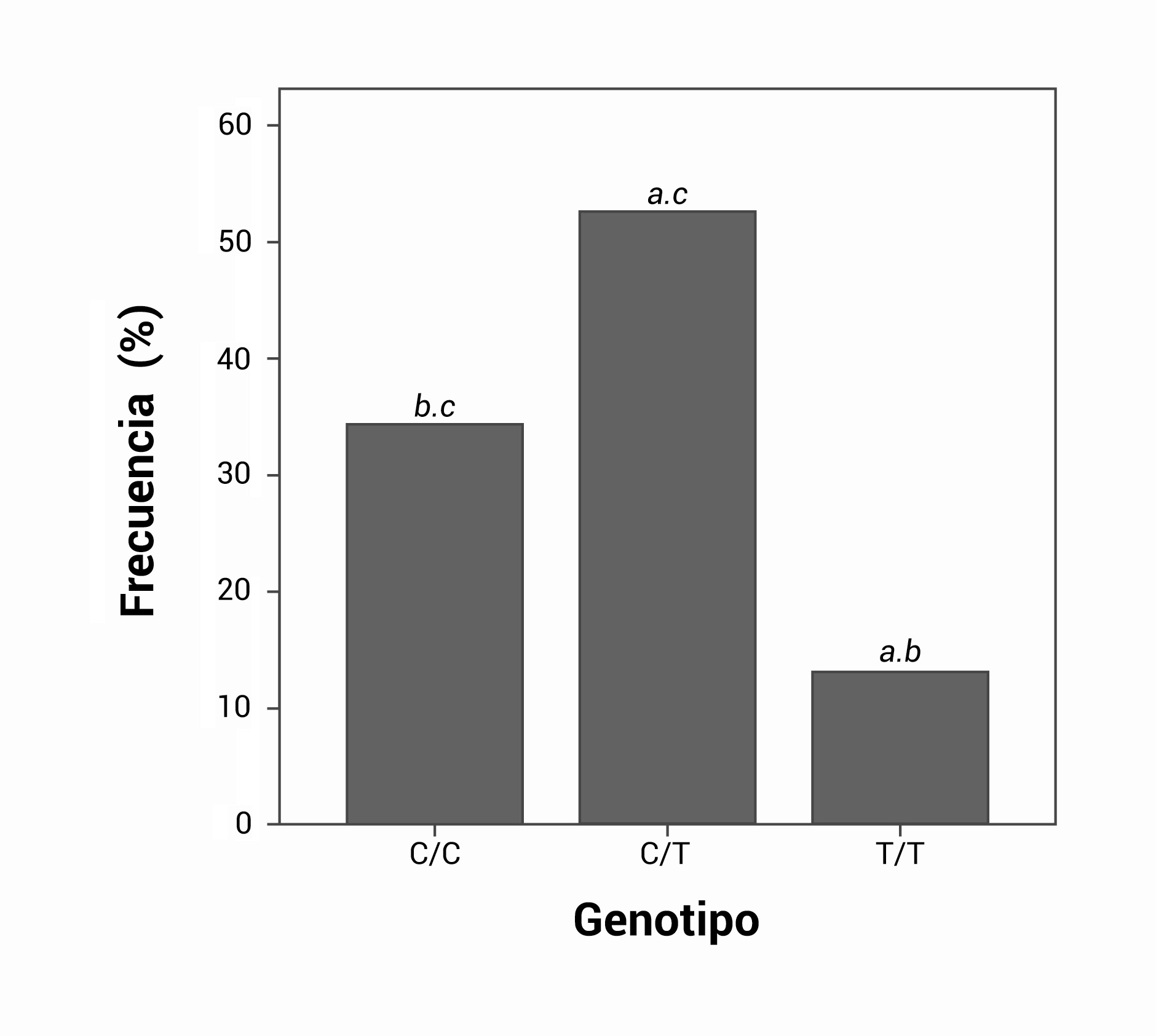
La mayor frecuencia genotípica observada correspondió a los heterocigotos C/T (80 individuos, 52.6%), seguido de los homocigotos C/C con 52 individuos (34.2%). El genotipo homocigoto T/T presentó la menor frecuencia en la población estudiada con 20 individuos que correspondieron al 13.2%. Las comparaciones del genotipo C/C frente a C/T y a T/T fueron estadísticamente significativas (p= 0.001 y p= 0.026 respectivamente) y de igual manera para la comparación entre C/T y T/T p= 0.0001 (Fig. 1).
Figura 1.
Comparación de frecuencias de los tres genotipos en el grupo general: a. Diferencias estadísticamente significativas frente a C/C, b. Diferencias estadísticamente significativas frente a C/T, c. Diferencias estadísticamente significativas frente a T/T. Todos los análisis fueron obtenidos por prueba Chi cuadrado (p <0.05).
No se observaron asociaciones estadísticamente significativas entre el genotipo y los alelos con sexo, p= 0.799 y p= 0.615 respectivamente, por la prueba estadística Chi ² (Tabla 1). La población está en equilibrio de Hardy-Weinberg (p= 0.211).
Al evaluar la frecuencia alélica en la población, se encontró el alelo C en el 86.3% (n= 306) de los individuos y el alelo T en el 13.7% (n= 42).
Discusión
Existen polimorfismos funcionales en los genes que codifican para las enzimas involucradas en el metabolismo que pueden llegar a influir en la susceptibilidad frente a patologías; por tal razón, los polimorfismos del gen MTHFR se cuentan entre los más estudiados 13-15.
En el actual estudio se encontró que en el grupo de individuos Colombianos se presentó un equilibrio de Hardy-Weinberg entre los alelos del gen MTHFR y por consiguiente no hay evidencia de selección a favor de ninguno de ellos. Considerando que se ha observado que este polimorfismo afecta la actividad enzimática de la MTHFR, es importante evaluar su frecuencia y su efecto en la población.
La enzima MTHFR es una proteína crítica en el metabolismo de la 5-metil tetrahidrofolato reductasa, la cual es el donador en varias reacciones bioquímicas que intervienen en la metilación de la homocisteína. Se han descrito más de una docena de polimorfismos del gen MTHFR, pero dos variantes principales desde el punto de vista funcional son las más estudiadas A1298C y C677T. Se ha determinado el efecto orgánico de estos polimorfismos generando resultados predictivos de la respuesta de los pacientes al MTX 7. Los resultados de los meta-análisis que evalúan el polimorfismo C677T, su estado homocigoto o heterocigoto, muestran gran variabilidad entre poblaciones 16-19.
La mayor frecuencia genotípica observada en la población estudiada correspondió a los heterocigotos C/T, seguida de C/C y del genotipo T/T con la menor frecuencia. El polimorfismo C677T origina a nivel fenotípico un cambio de una alanina por una valina en el codón 222, lo cual corresponde a una variante termolábil de la enzima MTHFR generando una disminución de su actividad incrementando los niveles plasmáticos de homocisteína 20. El genotipo homocigoto T/T mantiene el 30% de la actividad original con una prevalencia del 8 al 10% en la población general, y los heterocigotos presentan cerca del 60% de actividad con una prevalencia del 40% en la población 20.
En un estudio en México, en el que se evaluó la frecuencia de los polimorfismos del gen MTHFR en mujeres con y sin cáncer uterino, los resultados mostraron un genotipo C/C en un 22.4% de las 89 mujeres control con promedio de edad de 44 años 21, menor al revelado en el presente estudio de un 32.1%. Por otra parte, en este mismo estudio se reportó un genotipo C/T en el 55.1% de la población estudiada, porcentaje similar al encontrado en el grupo de mujeres colombianas analizado (53.6%). Finalmente, se halló un genotipo T/T en el 22.5% de la población, dato significativamente superior al obtenido en el presente estudio considerando que esta variante homocigota es la que está asociada a un mayor riesgo de neoplasia. Las frecuencias alélicas tanto de C como de T fueron de 0.5 en el estudio mexicano 21, lo cual contrasta con la población analizada en el presente estudio en donde predominó el alelo C.
En Colombia se han realizado algunos estudios previos 22-25 en los que se analizaron las frecuencias alélicas y genotípicas de este polimorfismo mediante la comparación de casos y controles, siempre con el objetivo de determinar su asociación con diferentes patologías.
Bermúdez et al., tomaron 102 voluntarios, de ambos sexos, provenientes de varios lugares de Colombia con residencia en Bogotá, con edades entre 18 y 50 años, 53 mujeres y 49 hombres 22. No se estratificó esta población por procedencia, grupo étnico o nivel socioeconómico. Este estudio arrojó resultados diferentes al nuestro puesto que el genotipo T/T mostró una frecuencia del 27.4%, superior al valor encontrado en el grupo evaluado en el presente trabajo de 13.2% siendo mayor en mujeres con un 14.3%. En otra evaluación de individuos colombianos se incluyeron igualmente sujetos sanos y se encontraron frecuencias genotípicas diferentes a las del presente reporte: para C/C en un 22.5% y T/T 27.4%, con frecuencias alélicas para C menores del 47.5% y para T del 52.4%, predominando el alelo de riesgo para toxicidad al MTX 23. Estos reportes en individuos sanos colombianos incluyen números menores de individuos, y estos fueron analizados con la metodología de RFLP a diferencia de este estudio donde se utilizaron microarreglos.
En un estudio de una muestra poblacional de 206 estudiantes en Bogotá, se calcularon las frecuencias globales de Colombia utilizando los datos de controles sanos reportados en otros estudios, encontrando frecuencias de genotipos y alelos similares a los detectados en el grupo de sujetos analizados en nuestro estudio 26. En tal muestra no hubo equilibrio de Hardy-Weinberg, mientras que en los datos globales colombianos del presente estudio se encontró que la población está en equilibrio.
Al comparar la frecuencia de homocigocidad TT en otras poblaciones a nivel mundial, esta varía desde 0% hasta más del 30% 26. Sin embargo, los resultados encontrados en nuestro estudio son similares a lo reportado por González et al., en un mayor número de individuos sanos colombianos 19. Estas diferencias también se encontraron en individuos en China 27,28 y Estados Unidos 29, donde se reportaron análisis en sujetos de la misma población geográfica, en los cuales se obtuvieron resultados muy diferentes. En Estados Unidos, en un estudio que incluyó diferentes grupos étnicos se reportó una menor frecuencia del alelo T en la población afroamericana y la mayor frecuencia en la población hispana 29, lo cual contrasta con nuestros resultados con el alelo T en el 13.7% de la población analizada. Las frecuencias a nivel mundial varían entre el 1% en la población del sur oriente de la India 30 y el 43% en la población China 27,31.
En síntesis, se observó una gran variabilidad en las frecuencias de los alelos C y T a nivel mundial. En Colombia, algunos estudios muestran predominio del alelo C y otros del alelo T. La diferencia en las frecuencias poblacionales sugiere que ambos alelos en determinadas circunstancias pueden otorgar ventajas y desventajas selectivas. Algunos reportes sugieren que el alelo T puede producir resistencia a infecciones como malaria y citomegalovirus, y también puede proteger contra la hipertensión 32,33. De la misma manera, el alelo C protege contra los defectos congénitos y el cáncer, y se asocia a una mayor fertilidad e instauración más tardía de enfermedades neurodegenerativas 34. Estos hallazgos permiten postular que las frecuencias de los alelos C y T pueden estar condicionadas a nivel local en diferentes poblaciones por presiones selectivas ambientales en las diferentes regiones de Colombia y el mundo.
Los resultados del presente trabajo se limitan a una población de individuos colombianos que solicitaron el estudio del perfil genético en las ciudades de Bogotá, Medellín, Barranquilla y Cali, lo cual no permite dar una interpretación global en población colombiana. Los hallazgos en los diferentes estudios han mostrado un comportamiento variable, incluso cuando se han analizado personas de la misma zona geográfica. Posiblemente las diferencias encontradas en los diferentes estudios pueden resultar de las diferentes aproximaciones metodológicas utilizadas y la heterogeneidad étnica de los grupos evaluados 24, 25.
Algunos sujetos de nuestra población podrían tener un alto riesgo para el desarrollo de enfermedades asociadas al polimorfismo del gen MTHFR y con genotipos de riesgo de presentar toxicidad y efectos adversos generados por el MTX lo cual sugiere la necesidad de evaluar alternativas terapéuticas con estudios farmacogenéticos de los pacientes que presenten el genotipo T/T. Desde la perspectiva clínica, la tipificación de los pacientes para polimorfismos del gen MTHFR antes de la administración de medicamentos permitiría elegir tratamientos alternativos sin someter a los pacientes a efectos deletéreos, optimizando la terapia y reduciendo los costos para los sistemas de salud.
