Introducción
La corteza prefrontal (CPF) representa el 30% de toda la superficie cortical del cerebro humano. De acuerdo con la teoría del origen dual de la corteza cerebral, en los mamíferos, las áreas corticales evolucionarían a partir de dos trenes, uno en sentido medio-ventro-lateral a partir de la corteza olfatoria (paleocorteza) y el otro en sentido medio-dorso-lateral a partir del hipocampo (arquicorteza). Estos dos trenes convergen en la superficie lateral del la corteza prefrontal (CPDL) a nivel de las áreas 8 y 46 de Brodman 1 .
Las alteraciones especificas en la CPF ocasionan alteraciones en el comportamiento y en la esfera cognitiva tales como el autismo 2,3, el trastorno afectivo bipolar 4 y el déficit de atención e hiperactividad (ADHA) 5. Adicionalmente algunos autores han descrito alteraciones a nivel celular y sináptico específicamente en las capas supragranulares en esquizofrenia 6,7.
La caracterización de la CPF se ha hecho con base en la manera cómo se organizan sus dos principales tipos neuronales (células piramidales y no piramidales) y en cómo se distribuyen en las diferentes láminas corticales desde la superficie pial hasta la sustancia blanca. De esta manera se han determinado tres subdivisiones principales, una dorsolateral (CPFDL), una orbitofrontal (CPFOF) y otra ventromedial (CPFVM). En la CPFDL de los primates, la mayoría de las interneuronas (65%) se localizan en la capa II y en la porción superficial de la III. Las interneuronas clásicamente se han estudiado con base en su expresión de las proteínas atrapadoras de calcio (PAC). De acuerdo con estos marcadores específicos, las interneuronas positivas para calretinina (CR-IR), son neuronas pequeñas localizadas por debajo de la lámina I. Las neuronas positivas para calbindina (CB-IR) se sitúan en las porciones más profundas de estas láminas. Adicionalmente, una población más grande y más densa conformada por neuronas parvalbúmina positivas (PV-IR) se identifican en la región superficial de la lámina III. Dado que el conocimiento de la localización especifica de estas interneuronas y de como ellas interactúan con las neuronas piramidales es fundamental para entender como es la regulación funcional de la CPF. Se han hecho múltiples intentos por aproximarse a este hecho, sin embargo, el conocimiento hasta el momento es insuficiente 8,9 .
Adicionalmente, varias áreas corticales del mamífero, incluyendo a las de la CPF, exhiben una organización modular-columnar en las capas I y II. Se ha descrito que estos pequeños modulos iterativos, están interconectados por proyecciones recurrentes con actividad excitatoria intermodular (reverberante), los cuales a su vez son regulados de manera precisa por una amplia cohorte de interneuronas gabaérgicas. Este patrón es diferenciable del sistema columnar descrito en otras láminas corticales 10-13.
Como un punto de interés para el presente trabajo, la organización vertical modular puede constituir la base estructural del fenómeno conocido como disparo sostenido (DS), el cual se sabe ocurre en la CPFDL. El DS se piensa que aparece en las redes neuronales después de que se "apaga" el disparo eléctrico inicial. Se ha propuesto que esta actividad presente en la CPFDL del humano y de los primates superiores representa el sustrato para las funciones cognitivas complejas, tales como la memoria operativa, la atención sostenida, la toma de decisiones y en general, el "control cognitivo". Todas estas funciones tienen en común que mantienen una representación activa de la realidad (en linea) mientras que se alcanzan las metas a nivel comportamental y cognitivo 14-16.
Por otra parte, las características morfológicas de las neuronas de las lámina II de la CPFDL se consideran especialmente interesantes al compararlas con las presentes en las otras divisiones de la CPF. Por ejemplo, estudios previos morfométricos realizados en la lámina II de la CPFDL han demostrado la presencia de una gran cantidad de neuronas las cuales están densamente empacadas en un pequeño espesor. Adicionalmente, puesto que el tamaño de las neuronas está correlacionado con la longitud y la geometría de las dendritas y de los axones, tamaños entre 80-100 μm2 como los encontrados en las células de la capa II de la CPFDL, permite predecir procesos suficientemente largos que alcanzan a impactar sobre dos módulos contiguos 17. En general, estas características son funcionalmente consistentes con una masiva pero delicada integración de una gran cantidad de aferentes procedentes de otras áreas corticales y de estructuras subcorticales 18.
En el presente trabajo se caracterizó la organización celular de la lámina II de las áreas de Brodman 10, 24 y 46 del sistema nervioso central de humano; las cuales son áreas representativas de las regiones CPFOF, CPFVM y CPFDL, respectivamente. Específicamente analizamos la amplitud laminar, el tamaño celular y la densidad neuronal con el propósito de determinar las diferencias tanto en el número total de neuronas como de las poblaciones de interneuronas entre las áreas señaladas. Adicionalmente quisimos conocer si existían o no diferencias interhemisféricas. Finalmente, basados en la premisa de que el procesamiento cognitivo complejo atribuido a la CPFDL recae sobre las características funcionales y estructurales de la lámina II de esta región, la discusión de nuestros hallazgos se centran fundamentalmente en el entendimiento de las características del área 46.
Materiales y métodos
En el presente estudio utilizamos tejido humano postmorten obtenido de 5 sujetos, todos hombres con edades comprendidas entre 26 y 53 años. Los sujetos no presentaron evidencia de lesión del sistema nervioso central (SNC), de acuerdo con la evaluación del forense. El material fue obtenido del Instituto de Medicina Legal y Ciencias Forenses (Cali, Colombia). Todos los procedimientos fueron aprobados por los Comités de Ética de la Facultad de Salud de la Universidad del Valle y del Instituto de Medicina Legal y Ciencias Forenses de Cali, de acuerdo con el protocolo de Helsinki.
Con un vibratomo, se hicieron cortes coronales de 50 µm de cada área cortical (BA 46, 10, 24). Las secciones se colocaron en suero normal de caballo al 1.5% (Vectastain Elite ABC, Vector Laboratories(r)) en PBS durante 40 min. Seguidamente, las secciones se incubaron por 18 h con los anticuerpos primarios contra las PAC: PV (1:500), CB (1:5,000) y CR (1:2,500) para identificar las poblaciones de interneuronas. Utilizamos adicionalmente un anticuerpo contra NeuN (1:2,500) para determinar la población neuronal total. Después de la incubación, se lavaron las secciones en PBS por tres veces durante 5 min cada una. Posteriormente se incubaron las secciones en el complejo avidina-biotina-HRP (Vectastain Elite ABC(r)) con el respectivo anticuerpo secundario diluido 1:200 durante 40 min. La inmunomarcación se reveló en una solución que contenía 4% de diaminobencidina, 2% de peróxido de hidrógeno y 2% de níquel diluido en PBS durante 10 min. Finalmente, las secciones se lavaron en PBS y se montaron en placas con cromo-aluminio para su observación al microscopio.
Registro fotográfico
Las microfotografías se tomaron a 10x con una cámara Cannon Power Shot A-430 (4.0 mega pixeles), adaptada a un microscopio de luz Olympus CH-2 Optic. Se tomaron tres fotografías coronales consecutivas (570x430) de cada sujeto, desde la capa molecular hasta la sustancia blanca. Las imágenes obtenidas se fusionaron usando el programa Cannon Photo Stich versión 3.1 2000(r) para reconstruir toda la columna cortical. Las medidas y los conteos celulares se hicieron usando el programa Sigma ScanPro 5.0(r). Las diferencias significativas entre las tres áreas analizadas para cada hemisferio se determinaron aplicando una ANOVA para medidas repetitivas. Posteriormente, las diferencias fueron confirmadas usando la prueba t-student. Las diferencias interhemisféricas entre áreas homologas se determinaron usando la prueba t-student. Se consideraron diferencias estadísticamente significativas a p <0.05.
Resultados
Amplitud de la lámina II
Las áreas 10, 24 y 46 mostraron diferencias con respecto al grosor de la lámina II al observarlas en cada hemisferio. Estas diferencias fueron significativas tanto al utilizar la prueba de ANOVA como al hacer pruebas pareadas usando la prueba t-student. A nivel estadístico, estas diferencias dan cuenta del 50% del total de la varianza (p< 0.001). No se encontraron diferencias interhemisféricas (p >0.05).
Densidad Neuronal
Las tres áreas analizadas mostraron diferencias en la densidad neuronal total al marcarse con NeuN. Estas diferencias fueron significativas después de analizarlas con ANOVA (p <0.001). Estas diferencias pueden explicar el 35% de la varianza total encontrada. Sin embargo las comparaciones pareadas demostraron que solamente fueron significativas las diferencias entre las áreas 24 y las otras dos áreas. No se encontraron diferencias interhemisféricas (Fig. 1).
Figura 1.
Densidad de subpoblaciones neuronales de la lámina II en áreas prefrontales humanas 24, 10 y 46 corresponden a las áreas corticales analizadas. Izquierdo: Hemisferio Izquierdo. Derecho: Hemisferio Derecho. NeuN+/mm2: densidad de neuronas en la lámina II. PV+/mm2: densidad de neuronas positivas para PV en la lámina II. CB+/mm2: densidad de neuronas positivas para CB en la lámina II. CR+/mm2: densidad de neuronas positivas para CR en la lámina II. En el gráfico de barras se muestran los valores promedio y las desviaciones estandar respectivas. *Diferencias significativas p <0.05; **diferencias significativas p <0.01.
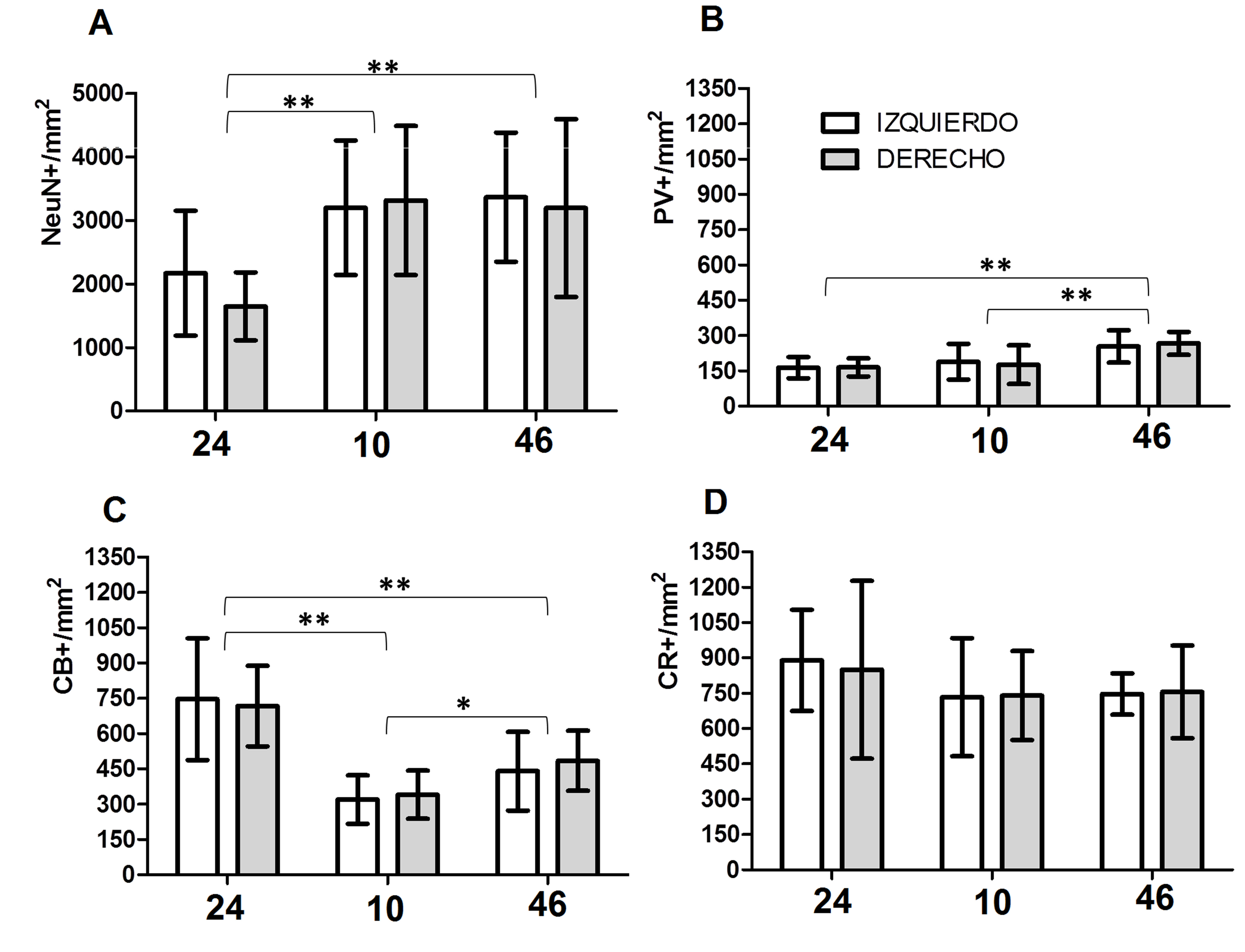
Las tres poblaciones de interneuronas (PV, CB y CR) muestran diferencias significativas de la siguiente manera: los valores para la población de neuronas PV-IR (p <0.001) indican que las diferencias entre las áreas representa el 50% de la varianza total. La comparación pareada indica que el origen de la variación corresponde a las diferencias en el área 46 versus las otras dos áreas (Fig. 1).
Los valores para Calbindina (p <0.001) mostraron que las diferencias entre áreas explican casi el 64% de la varianza total. La comparación pareada mostró que todas las diferencias entre áreas eran estadísticamente significativas (Fig. 1).
Los valores para CR (p >0.05) no permitieron identificar diferencias significativas entre áreas, lo cual podría explicar el 8% de la varianza total (Fig. 1).
Área del soma celular
Las tres áreas analizadas mostraron diferencias significativas con respecto al área del soma al evaluarse con NeuN y por ANOVA (p <0.001). Estas diferencias pueden explicar el 35 % de la varianza total encontrada. Sin embargo las comparaciones pareadas demostraron que solamente las diferencias entre el área 24 y las otras dos áreas eran significativas. No se determinaron diferencias interhemisféricas. Este parámetro analizado de acuerdo con la NeuN-IR no mostró diferencias significativas entre hemisferios en las áreas 24 y 46, mientras que los somas del área 10 mostraron un tamaño significativamente mayor en el hemisferio izquierdo. La prueba t-student no permitió identificar diferencias significativas entre hemisferios. Sin embargo, el valor del área para toda la población celular (NeuN) mostró diferencias significativas en las tres áreas (p <0.001); lo cual puede explicar casi el 41% de la varianza total encontrada. Las comparaciones pareadas mostraron que el origen de la varianza era debida a los pequeños cuerpos celulares encontrados en el área 10 al compararlos con las otras áreas (Fig. 2).
Figura 2.
Tamaño del soma de subpoblaciones neuronales de la lámina II en áreas prefrontales humanas 24, 10 y 46 corresponden a las áreas corticales analizadas. Izquierdo: Hemisferio Izquierdo. Derecho: Hemisferio Derecho. NeuN+: µm2: tamaño del soma de neuronas en µm2. PV: µm2: tamaño del soma de neuronas positivas para PV en µm2. CB+: µm2: tamaño del soma de neuronas positivas para CB en µm2. CR+: µm2: tamaño del soma de neuronas positivas para CR en µm2. En el gráfico de barras se muestran los valores promedio y las desviaciones estándar respectivas. *Diferencias significativas p <0.05; ** diferencias significativas p <0.01.
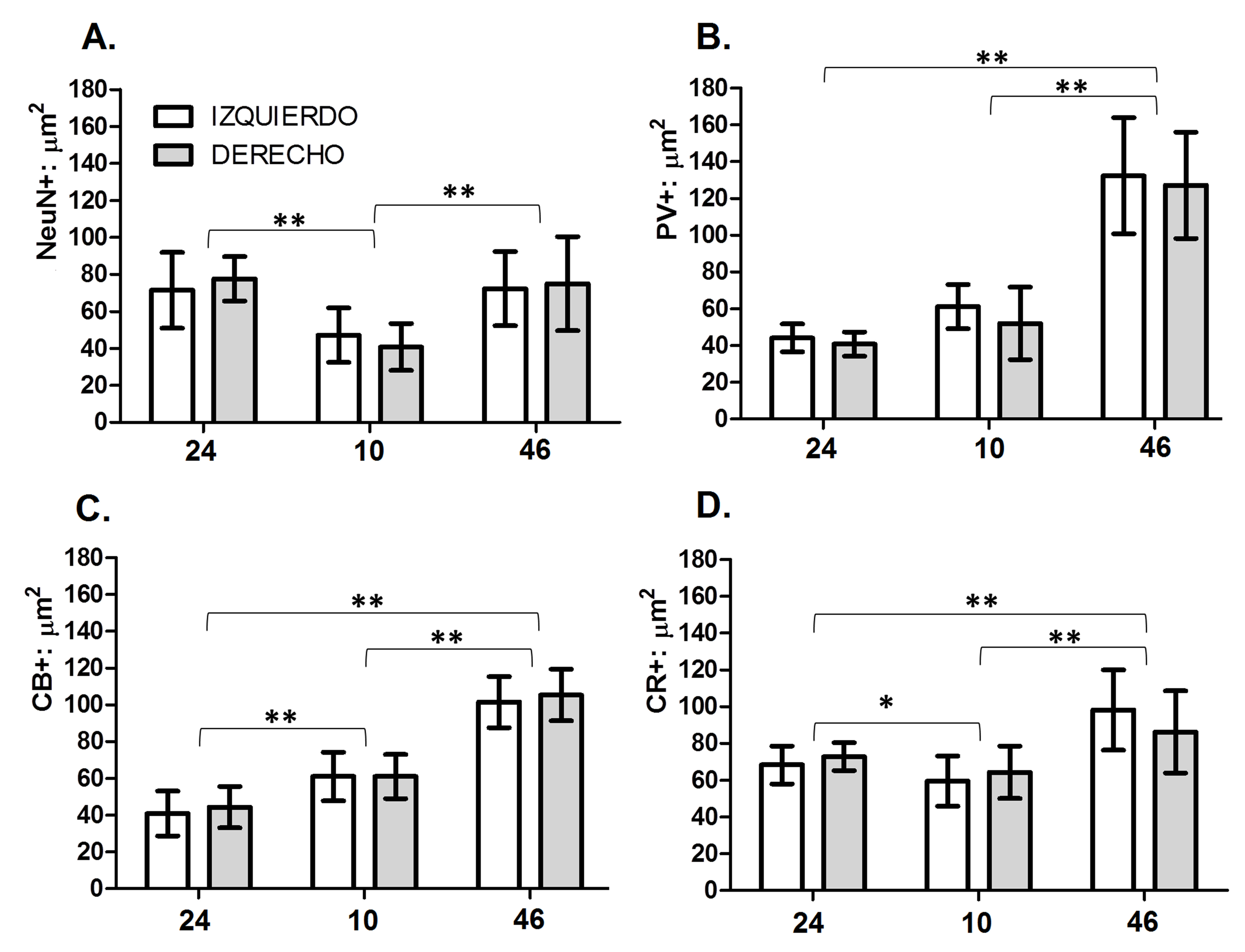
Adicionalmente, el test de ANOVA mostró diferencias significativas entre áreas para cada población celular analizada de la siguiente manera: los valores de la población PV-IR (p <0.001) fueron significativos, aunque estos solo dan cuenta del 22% del total de la varianza. Sin embargo la comparación pareada permitió identificar que el origen de la variación se debe a las diferencias entre el área 46 y las otras dos áreas (Fig. 3).
Figura 3.
Comparación de la densidad neuronal, proporción y tamaño del soma en las subpoblaciones de interneuronas de la lámina II de tres áreas prefrontales humanas 24, 10 y 46 corresponden a las áreas corticales analizadas. PV: Neuronas positivas para PV. CB: Neuronas positivas para CB. CR: Neuronas positivas para CR. Neuronas/mm2: densidad neuronal. % neuronas: porcentaje de neuronas de una subpoblación respecto del total de interneuronas. Soma área: µm2: tamaño del soma en µm2. En el gráfico de barras se muestran los valores promedio y las desviaciones estándar respectivas. Los círculos rellenos, los cuadrados y los triángulos representan valores discretos, y las líneas punteadas y las continuas muestran las tendencias entre las áreas corticales analizadas.
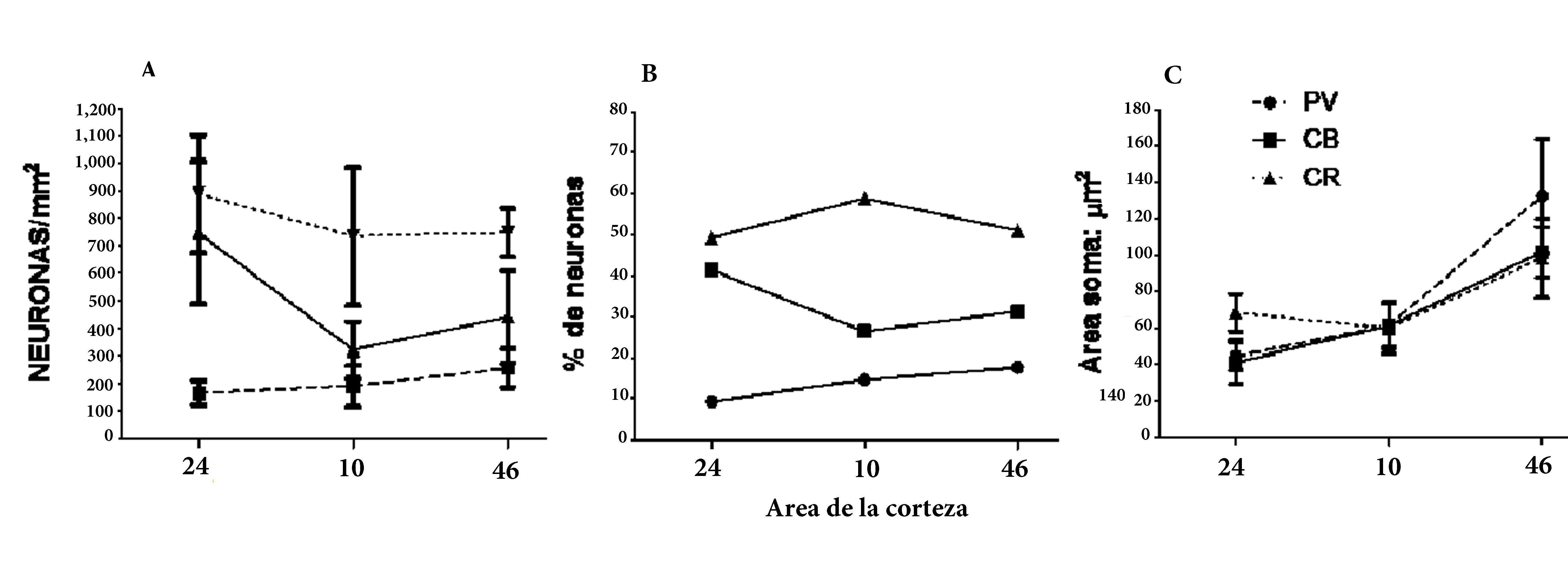
Los valores para la población CB-IR (p <0.001) mostraron que las diferencias entre áreas dan cuenta del 81% del total de la varianza. Las comparaciones pareadas muestran que todas las áreas fueron estadísticamente diferentes entre ellas (Fig. 3).
Los valores para la población CR-IR (p <0.001) mostraron que las diferencias entre áreas pueden explicar casi el 40% del total de la varianza. Las comparaciones pareadas muestran diferencias significativas entre las tres áreas (Fig. 2).
Discusión
Los resultados muestran un incremento progresivo en la densidad celular y en el fortalecimiento de la población de interneuronas (particularmente la subpoblación PV-IR) con una tendencia que parte del área 24, seguida por el área 10 y terminando en el área 46, representando este hecho el principal resultado del presente trabajo.
Por otro lado, nuestros resultados también encajan en los modelos previos de evolución de la corteza cerebral derivada del Macaco y propuesta por Dombroski et al 19. Estos autores propusieron que las áreas corticales más nuevas tienden a mostrar un aumento en la amplitud de las láminas y en la densidad neuronal total. Además, hablando específicamente de las interneuronas, las áreas corticales más nuevas presentan un incremento tanto en el número de neuronas PV-IR como en el tamaño del soma y una disminución en el número de neuronas CB-IR. Subsecuentemente Dombroski et al 19, categorizaron al área 24, la cual esta localizada en la superficie medial de los hemisferios, como un tipo intermedio de corteza entre "agranular" y "disgranular". El área 24 entonces representa el nivel más bajo en la escala filogenética de la CPF de los primates, y por esto esta área está relacionada principalmente con el procesamiento límbico de la información.
Adicionalmente, el área 10, localizada en los polos de los lóbulos frontales, fue clasificada como un tipo de corteza intermedia entre "disgranular" y "eulaminada tipo I". Así entonces el área 10 representa un nivel intermedio en la escala filogenética de la CPF, manejando tanto información límbica como cognitiva y participando en el procesamiento intrafrontal. Finalmente, el área 46, localizada en la superficie lateral de los hemisferios, (porción rostral del giro frontal medio) fue caracterizada por estos autores como una corteza "eulaminada tipo II", representando el nivel filogenético más alto, En realidad, el área 46 es bien conocida por estar asociada con el procesamiento de la información de alta complejidad en la cognición como representaciones abstractas, planeación y organización espacio/temporal del comportamiento 19,20.
En los presentes resultados, la capa II del área 24 muestra la menor amplitud cuando se la comparó con las otras áreas analizadas. Esta amplitud representa cerca del 7% del total del grosor cortical. La lámina II de esta área también muestra la más baja densidad celular, cerca de 40% menos, al compararla con las áreas 10 y 46. Más aún, con respecto a la subpoblación de interneuronas, nosotros observamos que la más alta densidad de éstas corresponde a las interneruronas CB-IR (Fig. 3). No obstante, el área celular de éstas interneuronas fue significativamente más pequeño que el de las neuronas CB-IR encontradas en la lámina II de las áreas 10 y 46. Esta baja densidad y tamaño celular de las interneuronas CB-IR pueden correlacionar con la pequeña amplitud encontrada en la lámina II del área 24.
Las neuronas CB-IR, encontradas principalmente en las capas supragranulares, constituyen el 25% del total de la población de interneuronas en la CPF de los primates 21. Las neuronas CB-IR son de orientación vertical en la corteza, se conocen como células de "double bouquet" (DB), se cree que son el fenotipo de interneurona más abundante en la corteza de los primates 22. Este tipo de neuronas se encuentra distribuida periódicamente en la corteza y despliega un característico axón descendente con densas ramificaciones. Este particular sistema de ramificación axónica, también llamado en "cola de caballo", cruza la corteza desde la capa II hasta la VI generando inhibición vertical de las neuronas piramidales localizadas en la misma columna cortical. Por lo tanto, las células de DB no son solo propias de la corteza cerebral de los primates sino que parecen estar involucradas en el mantenimiento de la integridad de las columnas corticales 23,24. Por otro lado, la alta densidad y pequeños somas de las células CB-IR que encontramos en la lámina II del área 24 es consistente con la regulación translaminar y modular a lo largo de toda la amplitud de la corteza. En contraposición se han descrito módulos restringidos a las láminas II/III en la CPFDL.
Por otra parte, la lámina II del área 10 presenta la más alta amplitud, cerca del 9,2%. Este resultado es consistente con la bien conocida amplitud de la corteza cerebral del área 10 comparada con otras áreas de la CPF. Más aún, las interneuronas CR-IR de la lámina II del área 10 muestran la más baja densidad y área del soma entre las subpoblaciones celulares marcadas con las PAC en cada hemisferio. Sin embargo, estas diferencias no fueron significativas. Las células CR-IR representan aproximadamente el 50% de todas las interneuronas en la CPF de los primates. Estas células con somas pequeños aparecen localizados principalmente en las capas supragranulares en relación cercana con la superficie pial 21.
Morfologicamente se pueden distinguir dos tipos de interneuronas CB-IR, células "bipolares" y células "multipolares". Funcionalmente, estas interneuronas se encuentran formando sinapsis simétricas (inhibitorias) en el 93% de los casos en la CPF de los primates. Dado que los axones de estas células se ubican sobre el árbol dendrítico de otras interneuronas, se cree que las neuronas CR-IR son en últimas, las responsables de la desinhibición de las células piramidales localizadas en las capas supragranulares. En contraste, las sinapsis mediadas por neuronas CR-IR en las láminas infragranulares generan tanto efectos inhibitorios como excitatorios 23,26.
La lámina II del área 46 mostró la más alta densidad celular, 42% más que el área 24 y 1% más que el área 10, aunque estas diferencias no fueron significativas. Con respecto a las interneuronas definidas por la presencia de su PAC presente, la lámina II del área 46 mostró la más alta densidad de células PV-IR y el tamaño celular más grande. También observamos que el tamaño de las subpoblaciones de interneuronas, particularmente las PV-IR, aumentan progresivamente en cuanto más rostral y lateral está localizada el área que se examina. Este patrón es consistente con los trenes evolutivos propuestos por Dombroski et al. 19, como se discutió previamente. En consecuencia, la lámina II del área 46 se puede caracterizar por la presencia de un fuerte sistema de interneuronas al compararlo con las otras áreas, las cuales a su vez están constituidas por células PV-IR. Adicionalmente, teniendo en cuenta que es conocida la amplia y difusa distribución de procesos de estas interneuronas, la actividad inhibitoria de la lámina II del área 46, mediada por células PV-IR, debe esperarse que sea igualmente amplia y difusa.
Las neuronas PV-IR de la corteza de los primates constituyen el 25% de toda la población de interneuronas. Las células en "cesta" y en "candelabro" son los tipos morfológicos reconocidos, los cuales contactan y afectan el disparo de las neuronas piramidales. Las células en cesta se han clasificado adicionalmente en tres subgrupos dependiendo del tamaño y de la extensión de sus procesos. Las células en cesta pequeñas (CCP), representan al menos la mitad de las neuronas de las láminas supragranulares y generan un alto número de sinapsis sobre los somas y las dendritas proximales. Se ha descrito también la presencia de sinapsis de tipo eléctrico en esta población celular. La inhibición asociada a las CCP ejerce un efecto importante sobre la sincronía y el ritmo en el disparo de las neuronas piramidales, el cual en la CPFDL puede dar como resultado el DS 23,27.
Las células en candelabro (CC) están localizadas principalmente en las láminas II/III. Estas interneuronas se orientan verticalmente y exhiben múltiples contactos sinápticos especialmente sobre el segmento inicial del axón de las neuronas piramidales. Se estima que entre el 35-50% de la población piramidal es contactada por ellas en el rango de distribución del axón de las CC. De igual manera se ha propuesto que una célula piramidal contacta a 4 CC. Estas características han permitido postular que las sinapsis de las CC puede ser el sistema inhibitorio más poderoso de la corteza cerebral 23,28. Más aún, además del efecto inhibitorio, las CC se han descrito induciendo despolarización sobre las neuronas piramidales y de esa manera generando una respuesta excitatoria. Las respuestas excitatorias o inhibitorias de las CC pueden depender de en que estado funcional se encuentre la red neuronal específicamente influenciada 29.
En el presente trabajo no determinamos diferencias entre los hemisferios cuando se compararon áreas homólogas. Sin embargo se han descrito ampliamente diferencias interhemisféricas (DIH) funcionales. Esto se podría explicar, primero porque es posible que los diferentes tipos de información sea segregada y procesada de una manera hemisférico-específica sin recaer en diferencias estructurales. Es más, DIF pueden tener lugar a nivel de redes y circuitos, los cuales se pueden reclutar a conveniencia de la tarea a realizar; por tanto no se necesitaría de diferencias estructurales. Finalmente, DIH pueden recaer sobre cambios moleculares que no están bajo el análisis del presente trabajo.
La diversidad del patrón de interneuronas tanto como la organización modular de las láminas supragranulares (especialmente las láminas I, II y IIIa) en la lámina II del área 46 puede constituir la base del DS.
En resumen, la lámina II del área 46 al compararla con otras áreas prefrontales se caracteriza por poseer un poderoso sistema de interneuronas inhibitorias sobre las cuales se postula que funcionan a través de una actividad autoregulada. Este sistema aparece organizado con una arquitectura modular en las capas supragranulares. Desde un punto de vista fisiológico el DS como resultado de la actividad de estos modulos, se considera el mecanismo básico del fenómeno de resistencia a la interferencia, el cual es característico de la CPFDL 30,31.
En este contexto, es de esperarse que los módulos corticales específicos de la lámina II del área 46 den lugar y sostengan la representación "online" de información de alta complejidad. Esta función debe ser la consecuencia de la interacción de pequeñas neuronas piramidales y de las interneuronas (particularmente de las células en candelabro). Las células aferentes excitatorias a estos módulos se espera que provengan principalmente de otras áreas prefrontales (áreas 9, 9/46, 45 y 8), las cuales a su vez han recibido información de cortezas asociativas sensoriales localizadas en el cortex post-rolándico 32-34. Este fenómeno puede ser el mecanismo básico del procesamiento cognitivo complejo tal como ocurre en la memoria operativa, el control cognitivo, la atención selectiva y la toma de decisiones 14,35-38.
Conclusiones
La lámina II del área 46 posee un poderoso sistema inhibitorio comparado con otras áreas de la corteza prefrontal. Este sistema inhibitorio regula la actividad sostenida de la corteza prefrontal durante la memoria operativa. La actividad de la subpoblación de interneuronas define la arquitectura modular de las láminas supragranulares.