RESUMEN
Una importante característica de los citocromos, como el P450, es que son inducibles. Se sabe que la inducción selectiva de isoenzimas de P450 por diversos factores juegan un papel importante en la determinación de efectos biológicos de varios compuestos químicos. El citocromo P450 2E1, miembro de la familia del citocromo P450, está comprometido en el metabolismo oxidativo de medicamentos, procarcinógenos, protoxinas y muestra una correlación positiva en pacientes diabéticos tipo I con pobre control metabólico, como se demuestra por medio de la hemoglobina glicosilada. Estos hallazgos suministran un nuevo argumento para tener un buen control metabólico en personas con diabetes mellitus.
Aunque la existencia de las enzimas en los citocromos (CYP) P450 se conoce desde años atrás, los esfuerzos para purificar y caracterizar las proteínas han sido más notorios con el advenimiento de la farmacogenética, que emerge como una subespecialidad de la farmacología clínica en respuesta a numerosos ejemplos y diferencias en la farmacocinética y farmacodinamia entre grupos étnicos genéticamente distintos1.
Además de lo anterior en enfermedades como la diabetes se han encontrado alteraciones en el metabolismo de medicamentos2, al parecer por disfunción en el sistema del citocromo P450. En este artículo se hace una revisión de las relaciones entre el CYP-2E1 y la diabetes.
NOMENCLATURA
Los estudios en animales de laboratorio y en seres humanos han caracterizado 221 genes para la expresión del sistema citocromo P450, que se clasifican según las estructuras en 36 familias; 12 de estas familias de genes existen en todos los mamíferos y se han subdividido en 22 subfamilias3. Las familias y subfamilias de enzimas se definen con base en la similaridad en la secuencia de aminoácidos. Por ejemplo, la ausencia de proteínas P450 de una familia, exhibe hasta 40% de similaridad con otra familia de P450; la subfamilia siempre comparte más de 55% de similaridad en la secuencia.
Los citocromos P450 se denominan con la raíz CYP (Cytocromo P450) seguida de un número arábigo, una letra y otro número arábigo, según el gen de la familia, subfamilia y forma de P450, respectivamente. Por ejemplo, CYP-2E1 (Cuadro 1).
IMPORTANCIA DE LOS CYPs
El CYP450 es un grupo diverso de proteínas, localizadas en casi todo los tejidos, y en muchas fracciones de membranas subcelulares de los mamíferos, que incluyen el retículo endoplásmico, la membrana interna mitocondrial y posiblemente la membrana citoplasmática. Hasta ahora la más grande diversidad se ha encontrado en el parénquima de las células hépaticas. Algunas de las enzimas responden a condiciones distintas según el control homeostático.
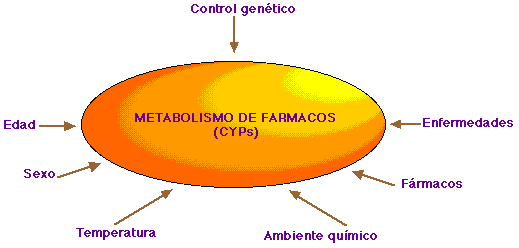
Se piensa que 3 de las familias de genes (CPY1, CPY2 y CPY3) son responsables por la mayoría del metabolismo xenobiótico4. A pesar del hecho que muchas de estas enzimas comparten substratos especifícos, en ciertas condiciones una única enzima del P450 interviene en la detoxificaión o biotransformación de un compuesto en particular. El metabolismo de los medicamentos está sujeto a control genético y depende de las cantidades de diversas clases del P450 expresadas en un órgano determinado. Así es posible determinar el metabolismo, la actividad farmacológica y la toxicidad de un compuesto. Los CYPs están bajo la influencia de varios factores como edad, sexo, temperatura, ambiente químico, medicamentos y enfermedades (Figura 1).
El sistema P450 puede tener repetidos ciclos de oxidación/reducción durante el metabolismo de endobiótico y xenobióticos, sin apreciable daño estructural. Sin embargo, la participación del P450 la termina un proceso que se clasifica inactivación "suicida"5. Hasta ahora, se han caracterizado 3 mecanismos distintos de inactivación: a) destrucción del heme prostético vía N-aquil/arilación; b) al-quilación del apocitocromo, por un reactivo intermedio6,7; c) destrucción del heme prostético para productos que irreversiblemente se unen con el apocitocromo6.
CYP-2E1
En comparación con las otras formas de P450, el CYP-2E1 presenta una tasa mayor de actividad de oxidasa cuando es purificada8 y en los microsomas de animales pretratados con inductores de CYP-2E1 también hay una tasa mayor de oxidación de NADPH que en los microsomas de animales no tratados9. El alza en la actividad de la oxidasa resulta en un aumento en la producción de superóxido de peróxido de hidrógeno los que en presencia de hierro quelado producen radicales hidroxilos reactivos9. El CYP-2E1 eleva la tasa del metabolismo mediado por radicales hidroxilos en sustancias como el etanol, que se manifiesta por un aumento en la tasa de peroxidación microsomal lipídica10,11.
Se han identificado varios compuestos como substratos para el CYP-2E1 (Cuadro 2), que por lo general son moléculas pequeñas y relativamente polares. La lista incluye muchos solventes usados en la industria como el benzeno, cloroformo y tricloroetileno. La bioactivación de estos tipos de protoxinas por el CYP-2E1 juega un papel importante, pues esta enzima es inducible por ellos12. Los mejores marcadores metabólicos para la presencia de esta enzima es la dimetilación de N,N-dimetil-nitrosamina en una concentración menor de 1 mM y la hidroxilación del p-nitrofenol y del clorzoxazón (éste es un relajante muscular central). De tales marcadores metabólicos el mejor es la 6-hidroxilación del clorzoxazón, que es 10 veces más sensible que los otros compuestos. Una de las ventajas adicionales en el metabolismo del clorzoxazón consiste en que la prueba no invasiva para demostrar la presencia del P450-2E1 en modelos animales y humanos, porque la tasa del metabolismo in vivo es dependiente de la concentración enzimática. El medicamento tiene una depuración intrínseca baja, en todas las condiciones13.
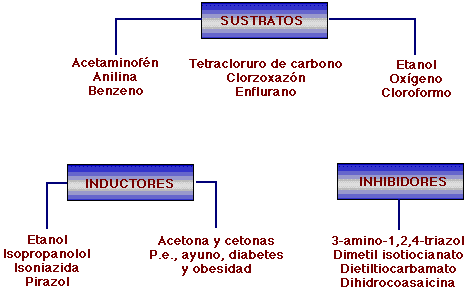
Se sabe de inhibidores específicos para la enzima14 como el 3-amino-1,2,4-triazol el dimetilisotiocianato, el dietiltiocarbamato y la dihidrocaosaicina, lo que ha ayudado a dilucidar el papel del CYP-2E1.
Durante el metabolismo hepático de fármacos en seres humanos y en animales de laboratorio, se han informado alteraciones que se asociaban con hiperglicemia y anormalidades en la liberación de insulina como la diabetes mellitus15. Casi todos los datos16 se han encontrado más para la diabetes mellitus tipo I que para el tipo II.
Kodell et al.17, postularon que la hiperglicemia es un estímulo específico para aumentar la producción hepática del citocromo P450 y varias otras sustancias oxidadas de función mixta.
Una importante característica de los CPYs consiste en que son inducibles; el CYP-2E1 se induce en ratas con diabetes, ratas que están en ayuno18 y ratas que tienen dieta alta en grasas19. En animales de laboratorio, Shimojo et al.20 demostraron que las ratas diabéticas presentaban un aumento de la actividad del CYP-P450 a nivel hepático, sobre todo 2A1, 2C6, 2C7, 3A2 y 4A3 y disminución en la actividad del 2C11.
Estos cambios se invirtieron mediante tratamiento con insulina. Además, encontraron inducción en microsomas renales de ratas diabéticas de CYP-2E1, 4A2 y K4. También estas modificaiones se alteraron por el tratamiento con insulina. Favreau & Schenkam15 observaron la inducción de CYP-2C7 y de CYP-2E1 con la supresión de CYP-2C11 y 2C11 y 2C13 en hígados de ratas diabéticas.
En pacientes con diabetes el metabolismo de compuestos como hexobarbital y codeína, hormona del crecimiento y carcinógenos, se encuentra alterado al parecer por presentar inducción enzimática a nivel hepático en los CPYs29,30. Goldstein et al.16 demostraron que pacientes con pobre control de la diabetes tipo I (hemoglobina glicosilada >13) tienen un incremento de la media vida, depuración y volumen de distribución de la antipirina (la antipirina es un medicamento que se utiliza en farmacología clínica como marcador para los medicamentos que tienen el metabolismo hepático) y cuando esos mismos pacientes tenían un buen control metabólico (hemoglobina glicosilada < 8) la vida media, depuración y volumen de distribución disminuían significativamente, lo que hace suponer que el pobre control metabólico en los pacientes tipo I induce enzimas del CYP-P450.
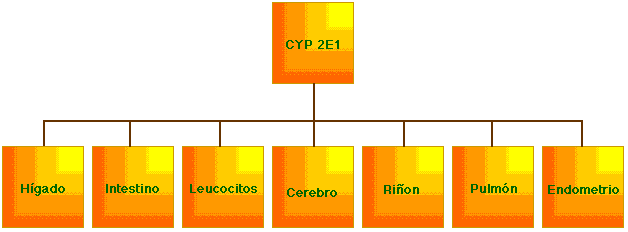
Dentro de la familia del CPY2, el CPY-2E1 se ha aislado en seres humanos, ratas, ratones y conejos con actividades catalíticas muy similares; se puede encontrar en diferentes tejidos (Figura 2). La fuente principal es el hígado (no existe una distribución homogénea del CPY2E1 en el acino hepático), también se puede obtener en el intestino, leucocitos, cerebro (las mayores cantidades se encuentran en el hipocampo, sustancia negra y cuerpo estriado), riñon, médula suprarrenal y endometrio21. Song et al.23 han demostrado que existe una correlación directa entre la elevación del CYP-2E1 en linfocitos de pacientes diabéticos tipo I con pobre control metabólico.
REGULACION DEL CYP-2E1
El CYP-2E1 está comprometido en el metabolismo de más de 70 diferentes sustancias; entre ellas están los cuerpos cetónicos, toxinas de bajo peso molecular y precarcinógenos de regulación CYP-2E1 el que se han demostrado experimentalmente no se restringen al tejido hepático, pues se encuentran también en otros tejidos como el pulmón y el riñon22.
Los tipos de regulación son:
En estados catogénicos como en la diabetes tipo I no controlada adecuadamente se puede presentar inducción del complejo P450 en especial el CYP-2E1. Los medicamentos como el acetaminofén, salicilatos, isoniazida y alcohol, también son inductores de la misma enzima. Se ha visto que los aumentos en el CYP-2E1 se asocian con la oxidación de precarcinógenos como N-nitrosodio etilamina, benzenos, tetracloruro de carbono y triocloroetileno26-29. Los individuos con altos niveles de CYP-2E1 tienen un riesgo de mayor toxicidad para estos agentes. Todo lo anterior es un motivo más para tener a los pacientes diabéticos con un buen control metabólico; una recomendación adicional cosiste en observar ciertas precauciones al administrar medicamentos hepatotóxicos en ellos.
AGRADECIMIENTOS
El autor reconoce a COLCIENCIAS Bogotá, Colombia, y los doctores Steve Hall y Craig Brater; Indiana University School of Medicine, la ayuda en la realización de este manuscrito.
SUMMARY
An important characteristic of cytochrome P450 is that it is inducible. The selective induction of P450 isozymes by different inducing factors is known to play an important role in determining the biological effects of various chemicals. Cytochrome P450 supergene family, is involved with drugs oxidative metabolism, procarcigenes, protoxins, and shows a positive correlation in IDDM patients with poor metabolic control through glicosilate hemoglobin. These findings provide a new argument for a better metabolic control in patients with diabetes mellitus.
REFERENCIAS
1. Reidenberg MM. Clinical pharmacology. JAMA 1993; 270: 192-94.
2. Schenkman JB. Induction of diabetes and evaluation of diabectic state on P450 expression. Methods Enzymol 1991; 206: 325-31.
3. Nelson DR, Kamataki T, Waxma DJ, et al. The P450 superfamily: up-date on new sequences, gene mapping, accession numbers, early trivial names of enzimes, and nomenclature. DNA Cell Biol 1993; 121-51.
4. Wrigton SA, Stevens JC. The human hepatic cytochromes P450 involved in drug metabolism. Crit Rev Toxicol 1992; 221-21.
5. Ortiz de Montellano PR, Reich NO. Inhibition of cytochrome P450 enzymes. In Cytochrome P450, structure, mechanism and biochemistry. Ortiz de Montellano PR (ed.). New York: Plenum Press, 1986. Pp. 273-314.
6. Correia MA. Drug-mediated hememodification of cytochrome P450 apopreteins: structural characterization and physiological implications. Toxicologist 1993; 13: 15.
7. Roberts ES, Hopkins NE, Alworth WL, Hellenberg PF. Mechanismo-based inactivation of an active site peptide. Chem Res Toxicol 1993; 6: 470-79.
8. Gorky LD, Koop D, Coon MJ. On the stoichiometry of the oxidase and monoxygenase reactions catalyzed by liver microsomal cytochrome P-450. J Biol Chem 1984; 259: 6812-17.
9. Dicker E, Cerebaum AI. Hydrocyl radical generation by microsomes after chronic ethanol consumption. Alcoholism Clin Exp Res 1986; 11:309-14.
10. Feireman DE, Winsthon & Ancederbaum GWAI. Ethanol oxidation by hydroxylradicals; role of iron chelates, superoxide and hydrogen peroxide. Alcholism Clin Exp Res 1985; 9: 95-102.
11. Ekstrom G, Ingelman-Sundberg M. Rat liver microsomal NAPDH-supported oxidase activity and lipid peroxidation depedent on ethanol-inducible cytochrome p450 (P-450 IIE1). Biochem Pharmacol 1989; 38: 1313-19.
12. Guergerich FP, Kim DH, Iwasaki M. Role of human cytochrome P450 IIE1 in the oxidation os many low molecular weight cancer suspects. Chem Res Toxicol 1991; 4: 168-79.
13. Backer RR, Beaune H, Iwasak M, Guengerich FP, Yong CS. Hydroxilation of chlorzoxazone as a specific probe for human liver cytochrome P450 IIE1. Chem Res Toxicol 1990; 3: 437-573.
14. Chang TKH, González FJ, Waxman DJ. Evaluation of triacetyloteandomycin, alfanapthoflavone and diethyldithiocarbamate as selective chemical P450. Arch Bioch Bioph 1994; 311: 437-42.
15. Favreau LV, Schenkman JB. Composition changes in hepatic microsomal cytochrome P-450 during onset of streptozicin-induced diabetes and during insulin treatment. Diabetes 1988; 37: 557-84.
16. Goldsteins S, Simpsom A, Saenger P. Hepatic drug metabolism is increased in poorly controlled insulin-dependent diabetes mellitus. Acta Endocrinol 1990; 125: 550-56.
17. Knodell RG, Handwerger BS, Marley JE, Levine AS, Brown DM. Separate influences of insulin and hyperglycemic on hepatic drug metabolism inmice with genetic and chemically induced diabtes mellitus. J Pharmacol Exp Ther 1984; 230: 256-62.
18. Hong J, Pan FJ, González J, Gelboin HV, Yang CS. The induction of specific form of cytochrome P450 (P-4 50j) by fasting. Biochem Biophys Res Commun 1987; 142: 1077-83.
19. Ravay JL, Lasker JM, Kraner JC, Salazar DE, Sand, S, Corcoran GB. Induction of cytochrome P450 Iie1 in the obese overfed rat. Mol Pharmocol 1990; 39: 275-80.
20. Shimojo N, Ishizaki T, Imaoka S, Funae Y, Fujii S, Okuda K. Changes in amounts of cytochrome P-450 isozymes and levels of catalytic activities in hepatic and renal renal microsomes of rates with streptozocin-induced diabetes. Biochem Pharmacol 1993; 46: 621-27.
21. Song BJ, Veech RL, Schetz P. Cytochrome P450-2E1 is elevated in lymphocytes from poorly controlled insulin-dependent diabetics. J Clin Endrocrinol Metabolism 1990; 71: 1036-40.
22. Kim SG, Williams DE, Schetz EG, Guzelian PS, Novak RF. Pyride induction of cytochrome P-450 in the rat role of P-450j (alcohol-inducible form) in pyridin N-oxidation. J Pharmacol Exp Ther 1988; 246: 1175-82.
23. Song BJ, Gelboin HV, Park SS, Yang CS, González FJ. Complimentary DNA and protein sequences of ethanol-inducible rat and humnan cytochrome P450 transcriptional and post-transcriptional regulation of the rat enzyme. J Biol Chem 1986; 261: 1689-97.
24. English JC, Anders MW. Evidence for the metabolism of N-nitrosadimethylamine and carbon tetracloride by a common isozyme of cytochrome P-450. Drug Metab Dispos 1985; 13: 449-52.
25. Morgan ET, Koop DR, Coon MJ. Comparison of six rabbits'liver cytochrome P-450 isoenzymes in formation of a reactive metabolite of acetaminophen. Biochem Biophysiol Res Commun 1983; 112: 8-13.
26. Koop DR, Crump BL, Nordblom Go, Coon MJ. Immuno-chemical evidence for induction the alcohol-oxidizing cytochrome P-450 of rat liver microsomes by diverse agents: ethanol, imidazole, trichloroethylene, acetone, pyrazole, and isoniazid. Proc Natl Acad USA 1985; 82: 4065-69.
27. Zand R, Nelson SD, Slattery JT, et al. Inhibition and induction of cytochrome P4502E1 catalyzed oxidation by isoniazid in humans. Clin Pharmacol Ther 1993; 54: 142-49.
28. Pankow D, Damme B, Schror K. Acetylsalicylic acid-inducer of cytochrome P4502E1? Arch Toxicol 1994; 68: 261-65.
29. Guengerich FP. Catalytic selectivity of human cytochrome P450 enzymes: relevance to drug metabolism and toxicity. Toxixol Lett 1994; 70: 133-38.
30. Guengerich FP. Characterizations of human microsomal cytochrome P450 Ann Rev Pharmacol Toxicol 1989; 29: 241-64.