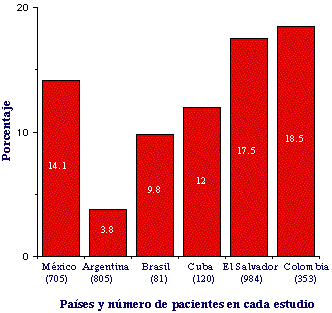
Figura 1. Leptospirosis en América Latina. Seropositividad en humanos
Helbert Acosta, M.D.1, Carlos Hugo Moreno. M.D.2, Daniel Viáfara B.3
1. Residente, Departamento de Medicina Interna, Hospital Universitario del Valle, Cali, Colombia.
2. Profesor Asistente, Departamento de Medicina Interna, Facultad de Salud, Universidad del Valle, Cali, Colombia.
3. Estudiante de Medicina, Universidad del Valle, Cali, Colombia.
La leptospirosis es una enfermedad aguda y febril causada por una bacteria del género Leptospira que comprende sobre todo a los animales salvajes y domésticos. El hombre se contamina en forma accidental por el contacto con orina o tejidos de animales infectados y presenta cuadros clínicos variables que van desde infecciones inaparentes, meningitis aséptica, hasta formas severas como el síndrome de Weil. La penicilina sigue siendo la droga de elección.
En 1886 Weil1 describió el cuadro clínico clásico que lleva su nombre. En 1905 Stimson identificó espiroquetas en los túbulos renales de un paciente al que se le diagnóstico fiebre amarilla. En 1915 Inada & Ido 2 cultivó por primera vez el organismo y se pudo determinar que la rata era un reservorio. Y en 1922 Eodsworth informó el primer caso en seres humanos adecuadamente documentado con aislamiento del agente. Desde entonces, con el correr de las investigaciones, se han venido identificando nuevos serotipos de leptospiras (actualmente alrededor de 180) patógenos para animales y el hombre, que comprometen no sólo la salud sino la economía de las regiones afectadas.
En la actualidad no se puede considerar una enfermedad exótica en ninguno de los países del continente americano. Los informes de casos en seres humanos en los diferentes países del hemisferio occidental son cada vez más numerosos. En la Figura 1 se puede observar el porcentaje de seropositividad de los estudios hechos en algunas naciones americanas 3-8. Se puede apreciar que la mayor proporción corresponde a Colombia.

Figura 1. Leptospirosis en América Latina. Seropositividad en humanos
En Colombia la enfermedad se conoce desde 1933, pero las investigaciones no se han hechos en forma sistemática sino más bien han sido el resultado de inquietudes de algunos autores que orientan sus trabajos fundamentalmente al estudio de los reservorios animales y en mucho menor grado a nivel humano. A continuación se resumen algunos de estos artículos.
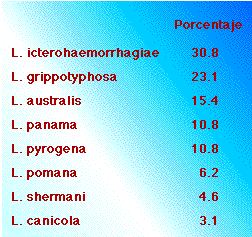
Como dato interesante se encontró que hay una seropositividad alta, 20.7%, para L. grippotyphosa, en Mocoa. Otro dato llamativo es la baja seropositividad para L. canicola que ha sido frecuente en estudios de animales en diversas partes de Colombia.
Como se puede observar casi todos los trabajos se refieren a la prevalencia de seropositividad a la infección y no tratan aspectos clínicos o patológicos y de manejo, que serían de mayor interés. La razón fundamental de este hecho es la carencia de elementos diagnósticos que permitan confirmar la enfermedad una vez que se sospecha.
La mayoría de los casos corresponde a adultos jóvenes entre 20-40 años, con más frecuencia en hombres que en mujeres. Es una zoonosis de distribución mundial, de mayor prevalencia en zonas tropicales que afecta muchos animales domésticos y salvajes. El hombre se infecta por el contacto directo o indirecto con ellos. Se puede presentar tanto en zonas rurales como urbanas; sin embargo, la exposición ocupacional (veterinarios, criadores de animales, agricultores, etc.) y la exposición recreacional (excursionistas, exploradores, etc.) hacen más probable la infección.
Animales. La leptospirosis afecta una gran variedad de animales tanto salvajes, como domésticos. En el Cuadro 1, hay una lista parcial de sus principales reservorios. Los más importantes son las ratas y las vacas. Este hecho se explica por que el pH alcalino de la orina de estos animales favorece la sobreviviencia de la letospira, de tal forma que se sabe p.e., que 1 ml de orina de vaca puede contener hasta 100 millones de microorganismos 12. Como el hombre tiene una orina relativamente ácida para la leptospira, se considera un mal reservorio. La excreción de la letospira en la orina de los reservorios puede ocurrir por períodos prolongados y contaminar el ambiente.

Agua dulce. Contaminada con orina de animales infectados, es el vehículo más común de transmisión de este organismo al ser humano, y es una fuente importante de epidemias en nadadores y campesinos13. Las aguas estancadas con contaminación alta son desfavorables para que sobreviva la leptospira14. Bajo condiciones favorables el microorganismo puede sobrevivir en el agua hasta 183 días15.
El suelo. Es también un vehículo importante de transmisión. Algunos trabajos han demostrado que el microorganismo sobrevive hasta 15 días en suelos con orina 14,15.
Piel y mucosas. La penetración por la piel intacta o erosionada y por las mucosas constituyen la forma más importante de adquirir la enfermedad.
Vía oral. Por ingestión de alimentos contaminados con orina de enfermos o de reservorios. Antes se consideraba una vía importante, pero hoy se le da poco valor como modo de transmisión.
Transplacentaria. Se demostró que en animales principalmente de criaderos (vacas, cerdos, etc.) produjo retardo del crecimiento o pérdida de los productos (abortos) con graves repercusiones económicas. En los seres humanos hay algunos datos recientes 16,17 sobre esta forma de transmisión.
Lactancia. Es otro modo de transmisión poco estudiado pero sí hay informes18 al respecto.
La enfermedad es producida por muchos serotipos de espiroquetas del género Leptospira. Este género contiene especies patógenas, para los seres humanos (p.e., L. interrogans) y no patógenos (L. biflexia). El complejo interrogans, con base en propiedades antigénicas, se subdivide a su vez en aproximadamente 180 serotipos. Estos 180 serotipos, por su comportamiento inmunológico, se han dividido en 18 subgrupos. Entre los más comunes se encuentran: L. icterohaemorrhagiae, L. autumnalis, L. canicola, L. pomona, L. australis, L. grippotyphosa 19. No hay especificidad de huésped ni de cuadro clínico como se creía antes.
Los organismos tienen forma de espiral muy finos de 5-18 µm de longitud y 0.1-0.2 µm de ancho. Tienden a formar un gancho aerobio que se ha diferenciado de otras espiroquetas patógenas y se puede cultivar en medios artificiales.
Después de penetrar la piel o las mucosas la leptospira hace una bacteriemia que inicialmente alcanza todas las partes del cuerpo, incluyendo el líquido cefalorraquídeo (LCR) y los ojos, y genera la producción de anticuerpos aglutinantes y el fenómeno de opsonización. Si esta respuesta no es suficiente para detener su progreso, la leptospira avanza en los tejidos. Allí se multiplica en forma acelerada 20. Los mecanismos por los que produce daño a los tejidos, aún no están bien entendidos (Figura 2).
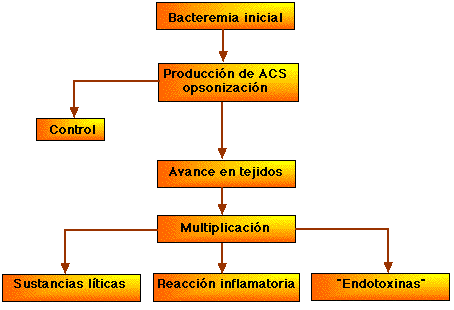
Figura 2. Leptospirosis.
Mecanismo de lesiones tisulares
Los hallazgos histopatológicos en los animales de laboratorio y en los seres humanos son lesiones muy similares a las del choque endotóxico 21-23. Sin embargo, en el hombre no se ha demostrado claramente la posible participación de endotoxinas en esta enfermedad. Arean et al.23 postularon como causas del cuadro el daño producido por la lisis del microorganismo más que su misma presencia, pero la naturaleza de estos agentes y sus efectos tóxicos todavía no se comprenden bien.
La lesión histopatológica básica en la leptospirosis es una vasculitis con compromiso multisistémico, donde el riñón y el hígado son los órganos que sufren con más frecuencia. En los casos severos (síndrome de Weil) se encuentra hemorragia generalizada que compromete principalmente músculos esqueléticos, riñón, glándulas suprarrenales, pulmones, piel, tubo digestivo y bazo 25-28. Entre los factores que explican la tendencia hemorrágica están la misma vasculitis, la trombocitopenia y la hipotrombinemia29 (Figura 3).
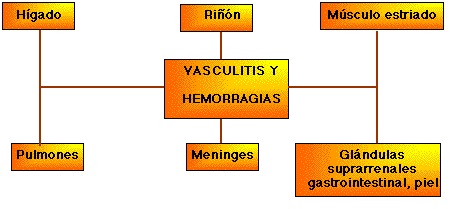
Figura 3. Patogenia. Factor en la
tendencia hemorrágica en la leptospirosis
Se debe sobre todo a una disfunción hepatocelular usualmente sin necrosis o con ataque estructural leve21,22,30,31 . Los cambios microscópicos no son diagnósticos y se correlacionan poco con el grado de compromiso funcional. Estos cambios incluyen: edema de hepatocitos, disrupción de cordones hepáticos, agrandamiento de las células de Kupffer y estasis biliar canalicular lo que explica en buena parte la ictericia en algunos pacientes. Las espiroquetas se pueden encontrar en el hígado en 25% a 30% de los casos30.
La falla renal es principalmente consecuencias de lesiones tubulares. Este daño parece que se origina en isquemia renal por hipovolemia e hipotensión por pérdida del volumen intravascular, debido a compromiso endotelial o por algún efecto tóxico directo de la leptospira 32-34. La leptospira se visualiza con frecuencia en el lumen de los túbulos24. En los casos graves hay edema intersticial e infiltrado celular de linfocitos, neutrófilos, histiocitos y células plasmáticas. Las lesiones glomerulares son raras o consisten en hiperplasia mesanglial que se asocia con complejos inmunes circulantes y depósitos de componentes del complemento en el glomérulo 34.
Los músculos voluntarios, y en especial los de los miembros inferiores, presentan lesiones características que consisten en necrosis de fibras, vacuolización, hialinización e infiltrado inflamatorio35 .
La infección por leptospira se ha culpado en la etiología de la meningitis aséptica. Durante los primeros días se puede encontrar la leptospira en el LCR pero los signos meníngeos están ausentes, y se presentan en la segunda fase de la enfermedad cuando se han producido anticuerpos lo que significa irritación meníngea inmunológica 21,22. El LCR muestra una pleocitosis moderada de 50-200 células/ml y por rareza cifras más altas. Al principio puede haber predominio de segmentados, pero rápidamente pasa a células mononucleares. Las proteínas por lo general son menores de 120 mg/dl. La glucosa es normal pero puede estar disminuida.
Después de un período de incubación de 7-12 días los síntomas aparecen bruscamente. Las manifestaciones van desde infección subclínica (común en veterinarios y cuidadores de animales), o un cuadro anictérico leve que ocurre en la mayoría (90% a 95%) hasta una forma ictérica severa llamada enfermedad de Weil, en 5% a 10% de los casos36-38 .
Constituye de 90% a 95% de los casos y clínicamente presenta 2 fases:
El síndrome clínico más importante es el compromiso meníngeo, con una meningitis aséptica de carácter inespecífico que dura unos pocos días y nunca es fatal. De tal forma que si hay cefalea intensa, aun sin síntomas neurológicos se aconseja la punción lumbar; 80% a 90% de los enfermos tendrán pleocitosis. También se observan iridociclitis, neuritis óptica, encefalitis, mielitis y en raras ocasiones cuadros de neuropatías periféricas similares al síndrome de Guillain-Barré.
Diagnóstico diferencial.A veces se hace muy difícil. En general se deben considerar los cuadros de hepatitis viral, meningitis aséptica, síndromes virales, fiebres de origen desconocido, malaria o dengue.
La presencia de mialgias en los gastronemios, la inyección conjuntival, el dolor ocular, la presencia de aumento en la CPK y el valor de enzimas hepáticas elevadas, en promedio 5 veces de lo normal (aunque puede ser más), son signos de tener en cuenta, así como la historia epidemiológica, p.e., el tipo de ocupación, la evolución del cuadro, el gran compromiso general, una ictericia y la sospecha clínica, hacen pensar en el diagnóstico, lógicamente descartando las otras entidades antes mencionadas.
Representa de 5% a 10% de los casos y es una forma más severa de la enfermedad. Por lo general su curso clínico es continuo y no bifásico como la forma anictérica 1,23-37. Los síntomas iniciales son similares a los de ésta, pero en los días tercero o sexto aparece ictericia progresiva con niveles de bilirrubinas no mayores de 20 mg/dl y fosfatasa alcalina moderadamente elevada. Hay dolor en el hipocondrio derecho, hepatomegalia leve o moderada, y alza de aminotransferasas que raramente excede 5 veces los valores normales.
Las hemorragias generalizadas constituyen una de las manifestaciones clínicas más notorias de esta forma de enfermedad, epistaxis, sangrado del tracto gastrointestinal, hemorragias pulmonares que dan infiltrados pulmonares hasta en 40% de los casos 28,29,40.
Además hay sangrado a nivel de las glándulas suprarrenales, el SNC, etc. Esta tendencia hemorrágica se puede explicar por la vasculitis generalizada, la trombocitopenia presente hasta en 50% de los casos21,23 y en menor grado por la hipotrombinemia29 .
El compromiso de la función renal debido principalmente a una necrosis tubular aguda y a otros mecanismos ya discutidos pueden llevar al paciente a azoemia severa, recurriéndose en la mayoría de estos casos a diálisis peritoneal o hemodiálisis 41,42.
El colapso cardiovascular por lo general es la causa de muerte en estos pacientes. En el desarrollo de esta complicación se han implicado factores tipo endotoxinas23 aún no estudiados.
El compromiso miocárdico es una complicación frecuente en la fase tardía del síndrome de Weil, pero con pocas repercusiones hemodinámicas. Watt et al. 43, estudiaron 38 pacientes con síndrome de Weil, y encontraron 39% de anormalidades electrocardiográficas, bloqueo AV de primer grado y cambios sugestivos de pericarditis aguda como lo más frecuente. También se han informado alteraciones más raras como fibrilación auricular con falla aguda del ventrículo izquierdo.
Se basa en el cultivo del organismo o en la demostración serológica. El cuadro clínico es similar al producido por otras entidades que se deben considerar en el diagnóstico diferencial, p.e., fiebres de origen desconocido, hepatitis agudas virales, colangitis, salmonelosis, sepsis por otras bacterias, meningitis, encefalitis, etc.
La herramientas diagnósticas más importantes son las siguientes:
Como las dos últimas han entrada en desuso por diferentes razones, sólo se revisarán brevemente las primeras.
Cultivo. Las muestras para cultivo deben ser múltiples y tomadas según el estadío de la enfermedad; en la primera semana, de sangre y de LCR, y de la segunda semana en adelante, de orina. La leptospira puede permanecer en la orina hasta 11 meses después de iniciada la enfermedad. Las muestras se deben inocular en medios de cultivo semisólidos como el medio de Fletcher 44 enriquecido con suero de conejo.
Existen otros medios recientemente desarrollados, útiles en el aislamiento de la leptospira: medio EMJH (Ellinghausen & Mecullough, modificado por Johnson & Harries) y el medio Tween 80-albúmina, este último considerado el mejor.
Como el cultivo tiene el inconveniente de ser muy moderado (5-6 semanas de incubación), no se debe considerar para definir una conducta terapéutica inicial.
Hace poco se describió un método radiométrico 45 rápido que utiliza el sistema BATEC-460; con este sistema la leptospirosis se puede demostrar en sangre a partir de los 2 a 5 días de enfermedad.
Pruebas serológicas. Las pruebas serológicas son aplicables en la segunda fase; los anticuerpos aparecen de los días 6 a 12 de la enfermedad. Se usan 2 sistemas tradicionales.
Y hay otros métodos aún no usados en forma amplia como análisis de ADN, clonados de serotipos específicos 52,53, anticuerpos monoclonados específicos 52, y métodos semicuantitativos de reacción de polimerasa en cadena.
Los elementos más importantes en el manejo son:
Antibióticos. Existe un grupo de antibióticos con grado variable de efectividad contra la leptospira. Los más importantes son 15: penicilina, doxiciclina, tetraciclinas, eritromicina, ampicilina, amoxacilina y estreptomicina. De estos, la penicilina y la doxiciclina son los más aceptados en la práctica clínica 55-58.
Penicilina. Se considera la droga de elección porque la leptospira es exquisitamente sensible. Se recomiendan dosis de 1.5 millones cada 6 horas por 7 días. Se ha demostrado que la penicilina acorta el período sintomático, disminuye el grado de compromiso renal y la leptospiruria, aun si se inicia en las fases tardías de la enfermedad 56. Hay que tener en cuenta la eventual presencia de la reacción de Jarisch-Herxheimer, que puede ocurrir en las primeras horas del tratamiento.
Doxiciclina. Se recomienda únicamente para casos leves o moderados y dentro de los primeros 5 días del comienzo de la enfermedad. No se ha demostrado beneficio si se inicia después de este período. Se usa además como profilaxis en personas con alto riesgo ocupacional a dosis de 100 mg 2 veces por semana.
Desde el punto de vista epidemiológico, la leptospirosis es una enfermedad difícil de controlar porque el microorganismo se puede albergar y expulsar en la orina de muchos animales, perpetuándose entre ellos el estado de portador. Sin embargo, se deben realizar esfuerzos para conocer la prevalencia de serotipos específicos en una determinada población y descubrir los focos de contagio a fin de evitar aparición de nuevos casos59.
La vacunación no se justifica en forma masiva en los seres humanos, sólo en personas expuestas como veterinarios y cuidadores de animales. La vacunación en animales tiene el inconveniente que previene la enfermedad, pero no el estado de portador en la orina.
1. Weil A. Uber eine Eigentumliche, mit Miltztumor, Ikterus und Nephritis emhergehende, akute, infektionskrankheit. Dtsch Arch Klin Med 1986; 39: 209-32.
2. Inada R, Ido Y. Etiology, mode of infection, and specific therapy of Weil's disease (spirochaetosis icterohaemorrhagica). Exp Med 1916; 23: 377-402.
3. Sebek Z, Sixl W, Valova M, et al. Serological investigations for leptospirosis in humans in Colombia. Geogr Med 1989; 3S: 51-60.
4. Sebek Z, Sixl W, Valova M, et al. Results of leptospirosis examinations of human sera from El Salvador. Geogr Med 1989; 3S: 61-72.
5. deSouza D. Leptospirose humana: infecção em habitantes do Vale do Rio Aricanduva, Municipio de São Paulo, 1985. Parte II. Aspectos serológicos. Rev Es Enfermagen USP 1988; 22: 159-68.
6. Suárez-Hernández M, Bustelo-Aguila J, Gorgoy-González V, et al. Estudio epidemiológico de un brote de leptospirosis en bañistas en el poblado de Jicotea de la provincia Ciego de Avila. Rev Cubana Hig Epidemiol 1989; 27: 272-84.
7. Suárez M, Bustelo J. Leptospirosis en humanos. Prevalencia serológica en 2 grupos diferentes en la provincia de Formosa, Argentina. Rev Argent Microbiol 1986; 18: 75-8.
8. Zavala J, Pinzón J, Flórez M, et al. La leptospirosis en Yucatán: estudio serológico en humanos y animales. Salud Pública Mex 1984; 26: 254-59.
9. Bauer J, Ken J. Leptospirosis. Bol Ofic San Panam 1933; 12: 696-98.
10. García-Carullo C. Leptospirosis. Vet Zoo 1966; 7: 45-8.
11. Bravo C, Restrepo M, Robledo C, et al. Leptospirosis. Antioquia Med 1968; 6: 475-79.
12. Gillespie RW, Ryno J. Epidemiology of leptospirosis. Am J Public Health 1963; 53: 950-55.
13. Kaufmann AF. Epidemiologic trends of leptospirosis in the United States, 1965-1974. In The biology of parasitic spirochetes. New York; Academic Press, 1976. Pp.177-89, 209-33.
14. Noguchi H. The survival of Leptospira (spirochaeta) icterohaemorrhagiae in nature: observations concerning microchemical reactions and intermediary hots. J Exp Med 1918; 37: 609-25.
15. Okazaki W, Ringen LM. Some effects of various environmental conditions on the survival of Leptospira pomona. Am J Vet Res 1975; 18: 219-33.
16. Coghlan JD, Bain AD. Leptospirosis in human pregnancy followed by death of the foetus. Br Med J 1969; 1: 228-30.
17. Faine S, Adler B, Christopher W, Vaklentine R. Fatal congenital human leptospirosis. Zentralbl Bakteriol Mikrobiol Hyg 1984; 2: 257-548.
18. Bolin CA. Human to human transmission of Leptospira interrogans by milk. J Infect Dis 1989; 158: 246-47.
19. Stallman ND. International Committee on Systematic Bacteriology. Subcommittee on the taxonomy of Leptospira. Minutes of the Meeting, 5 and 6 September 1986, Manchester. Int J Syst Bacteriol 1986; 37: 472-73.
20. Faine S. Reticuloendothelial phagocytosis of virulent leptospires. Am J Vet 1964; 25: 830-35.
21. Arean VM. The pathologic anatomy and pathogenesis of fatal human leptospirosis (Weil's disease). Am J Pathol 1962; 40: 393.
22. Edwards GA, Domm BM. Human leptospirosis. Medicine (Baltimore) 1960; 39: 117-20.
23. Arean VM, Sarasin G, Green JH. The pathogenesis of leptospirosis: toxin production by Leptospira icterohemorrhagiae. Am J Vet Res 1964; 25: 836-43.
24. Diesch SL, McCulloch WF, Braun JL, Ellinghause HC. Leptospires isolated from frog kidneys. Nature 1966; 209: 939-40.
25. Feigin RD, Lobes LA, Anderson D, et al. Human leptospirosis from immunized dogs. Ann Intern Med 1973; 79: 777-81.
26. Boeson PB, McDeermott W. Texbook of mediicna. 16th ed. Philadelphia; WB Saunders, 1987. Pp. 995-97.
27. Poh SC, Soh CS. Lung manifestations in leptospirosis. Thorax 1970; 25: 751-55.
28. O'Neil KM, Rickman LS, Lazarus AA. Pulmonary manifestations of leptospirosis. Rev Infect Dis 1991; 13: 705-09.
29. Edwards CN, Nicholson GD, Hassell T, et al. Thrombocitopenia in leptospirosis: the absence of evidence for disseminated intravascular coagulation. Am J Trop Med Hyg 1986; 35: 352-54.
30. Bhamarapravati N, Boonyapaknavig V, Viranuvatti V, et al. Liver changes in leptospirosis. A study of needle biopsies in twenty-two cases. Am J Protocol 1966; 17: 480-84.
31. Ramos-Morales F, Díaz-Rivera RS, Cintron-Rivera AA, et al. The patogenesis of leptospirosis jaundice. Ann Intern Med 1959; 51: 861-65.
32. Winearls CG. Acute renal failure due to leptospirosis: clinical feactures and outcome in six cases. Medicina 1984; 53: 487-90.
33. Sitprija V. Renal involvement in human leptospirosis. Br Med J 1968; 2: 656-59.
34. Lal KN, Aarons I, Woodroffe AJ, et al. Renal lesions in leptospirosis. Aust NZ J Med 1982; 12: 276-79.
35. Sheldon WH. Lesions of muscle in spirochetal jaundice (Weil's disease: spirochetosis icterohemorrhagica). Arch Inter Med 1945; 75: 119-24.
36. Lee JS. Clinical observation of leptospirosis. Korean J Int Med 1985; 37: 121-24.
37. Feigin RD, Anderson DC. Human leptospirosis. CRC Cri Rev Clin Lab Sci 1974; 5: 413-67.
38. Health CW, Alexander AD, Galton MM. Leptospirosis in the United States. Analysis of 483 cases in man, 1949-1961. N Engl J Med 1965; 273: 857-915.
39. Silverstein CM. Pulmonary manifestations of leptospirosis. Radiology 1953; 61: 327-34.
40. Chiu YC, Liu HH. Report on observation of roentgenologic pulmonary changes in 48 cases of leptospiroris. Chin J Radiol 1959; 7: 374-75.
41. Parsons M. Electrocardiographic changes in leptospirosis. Br Med J 1965; 4: 201-03.
42. Sodeman WA, Killough JH. The cardiac manifestations of Weil's disease. Am J Trop Med Hyg 1951; 31: 479-88.
43. Watt GP, Padre L, Tuazon M, Calubaquid C. Skeletal and cardiac muscle involvement in severe, late leptospirosis. J Infect Dis 1990; 162: 266-69.
44. Sulzer CR, Jones WL. Leptospirosis. Methods in laboratory diagnosis (revised edition). Departament of Health, Education and Welfare Publication (CDC), 1976, 76: 82.
45. Manca N, Verardi R, Colombrita D, et al. Radiometric method for the rapid detection of Leptospira organisms. J Clin Microbiol 1986; 23: 401-03.
46. Wolff JW, Bohlander HJ. Evaluation of Galton's macroscopic slide test for the serodiagnosis of leptospirosis in human serum samples. Ann Soc Belg Med Trop 1966; 46: 123-32.
47. Cole JR, Sulzer CR, Pursell AR. Improved microtechnique for the leptospiral microscopic agglutination test. Appl Microbiol 1973; 25: 976-80.
48. Baker LA, Cox CD. Cuantitative assay for genus-specific leptospiral antigens and antibody. Appl Microbiol 1973; 25: 697-98.
49. Watt G, Aguiza LM, Padre LP, et al. The rapid diagnosis of leptospirosis: a prospective comparison of the dot enzymelinked immunosorbent assay and the genus-specific microscopic aglutination test at different stages of illness. J Infectol Dis 1988; 157: 840-42.
50. Pappas MG, Hajkowski R, Hockmeyer WT. Dot enzyme-linked immunosorbent assay (DOT-ELISA), a microtechnique for the rapid diagnosis of leptospirosis. J Immunol Methods 1983; 64: 205-14.
51. Pappas MG, Ballou WR, Gray MR, et al. Rapid serodiagnosis of leptospirosis using the IgM-specific dot-ELISA: comparison with the microscopic aglutination test. Am J Trop Med Hyg 1985; 34: 346-54.
52. Adler B, Faine S. Species and genus-specific antigens in Leptospira, revealed by monoclonal antibodies and enzyme immunoassay. Zentralbl Bakteriol Mikrobiol Hyg Ser 1983; 255: 317-22.
53. Adler B, Murphy AM, Locarnini SA, Faine S. Detection of specific antileptospiral immunoglobulins M and G in human serum by solid-phase enzyme-linked immunosorbent assay. J Clin Microbiol 1980; 11: 452-57.
54. Kobayashi Y, Tamay T, Oyama H, et al. Characterization of monoclonal antibodies against etiological agent of Weil's disease. Microbiol Immunol 1984; 28: 359-70.
55. Alexander AD, Rule PL. Penicilins, cephalosporins, and tetracyclines, in treatment of hamsters with fatal leptospirosis. Antimicrob Agents Chemother 1986; 30: 835-39.
56. Watt G, Tuazon ML, Santiago E, et al. Placebo-controlled trial of intravenous penicilin for severe and late leptospirosis. Lancet 1988; 1: 433-35.
57. Takafuji ET, Kirkpatrick JW, Miller RN, et al. An efficacy trial of doxycycline chemoprophylaxis against leptospirosis. N Engl J Med 1984; 310: 497-501.
58. McClain JB, Ballou WR, Harrison SM, et al. Doxycycline theraphy for leptospirosis. Ann Intern Med 1984; 100: 696-98.
59. World Health Organization. Guidelines for the control of leptospirosis. Publication Nº 67. Geneva; World Health Organization, 1982.