Introducción
Una pequeña población de células B monoclonales (PCBM) ha sido estudiada ampliamente en sangre periférica. Estas células se han detectado con una frecuencia estimada entre el 3.5% y el 14.0% en sujetos sanos mayores de 40 años 1, también se han conocido como linfocitosis monoclonal de células B (LMCB) 2. Su hallazgo en sangre periférica es incidental, a veces su hallazgo está asociado a condiciones clínicas no específicas 3,4 y en una minoría de los casos está asociado a un aumento del riesgo de desarrollar neoplasmas de células B 5,6. Sin embargo, el significado clínico de detectar PCBM en médula ósea como hallazgo primario es desconocido en estos momentos. Su evaluación en medula ósea has sido usado principalmente para definir el estadio en casos de linfoma o para monitorizar la respuesta al tratamiento 7. No obstante, su papel como herramienta diagnostica útil en el manejo clínico de pacientes con sospecha de linfoma oculto no es conocido. Nosotros presentamos aquí un caso inusual de detección de PCBM del 1% en medula ósea usando citometría de flujo de alta sensibilidad durante la evaluación de una trombocitopenia idiopática que conllevó al diagnóstico de un linfoma folicular primario de parótida coexistiendo con un tumor de Warthin que no se pudiera haber encontrado de otra forma. El objetivo principal fue describir la posible asociación de PCBM con linfomas ocultos.
Descripción del caso
Mujer hispana de 82 años, con una historia médica de tromboembolismo pulmonar en anticoagulación oral, una artritis reumatoide en tratamiento con hidroxicloroquina e hipertensión, la cual desarrolló una trombocitopenia, de inicio reciente, con un conteo plaquetario de 52 x 109/L durante una evaluación de rutina. La paciente no presentó ningún síntoma y su examen físico fue normal. El conteo sanguíneo completo de células mostró una hemoglobina de 14.6 g/dL; y un conteo de glóbulos blancos de 5.9 x 109/L con 71% de neutrófilos segmentados, 17% linfocitos (conteo absoluto de linfocitos: 1.0 x 109/L), 11% monocitos, and 1% eosinofilos. Su INR (por sus siglas en inglés- international normalized ratio) se encontró en un rango terapéutico. La evaluación inicial de la trombocitopenia basada en las guías de manejo actuales 8 no reveló la presencia de un diagnóstico alternativo. La evaluación de enfermedades infecciosas incluyendo virus de la inmunodeficiencia humana (HIV) fue negativo. Por la edad de la paciente se realizó una biopsia de medula ósea.
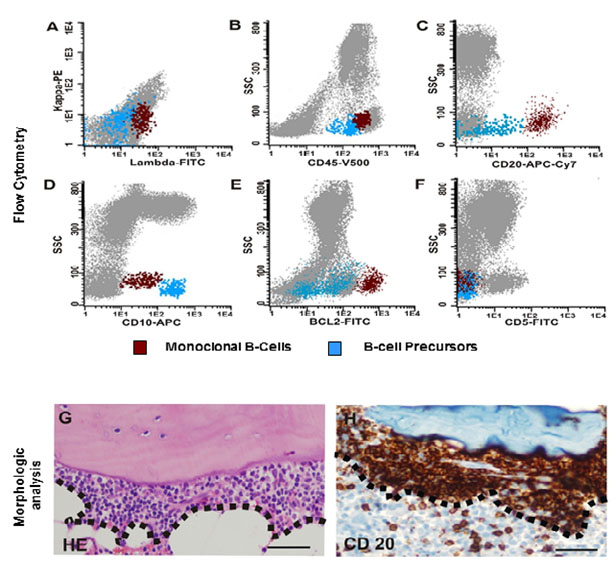
Estudios immunofenotípicos de células de medula osea usando una citometría de flujo de 8 colores (FACSCanto ll flow cytometer (BDB), y Infinicyt software program (Cytognos, V1.4)) detectó 1% de células B Lambda restringidas CD20+, CD10+, BCL2++ (Fig. 1A-F), FMC7+, CD38dim, CD200- y CD5- (Fig. 1F). La biopsia de medula osea reveló un infiltrado del 1% de pequeños linfocitos, hendidos para-trabeculares. La tinción immunohistoquímica demostró la expresión de CD20 (Fig. 1G-H), BCL2 y CD10 en células tumorales.
Figura 1.
Pequeñas clonas de células B en la médula ósea. La Citometría de Flujo de alta sensibilidad de 8 colores identifico 1% de céulas B de restricción labmda (A) CD45+, CD20`+, CD10+, BCL2++, CD5- (B-F) (SSC: side scattered light; población en rojo: células B monoclonales; población en azul: células B precursoras con expresión antigénica normal) El análisis de la morfología revelo un infiltrado paratrabecular de linfocitos pequeños hendidos del 1% (G) (El infiltrado se rodeó por líneas punteadas, HE: Tinción de hematoxilina y eosina). La inmunohistoquímica demostro expresión de CD20 en las células tumorales paratrabeculares (magnificación original para todas las fotos x400, Barra= 50 µm).
La evaluación, con una tomografía con emisión de positrones, reveló dos focos tumorales. Uno sobre la glándula parótida derecha (Fig. 2A-B) y otro en el seno maxilar izquierdo (Fig. 2C-D).
Figura 2.
Coexistencia de linfoma en la parótida con tumor de Warthin. El PET/CT mostro dos focos con apariencia de masas (cabezas de flecha en el CT y la imagen de fusión) en la parótida derecha (A-B) y en el maxilar izquierdo (C-D) ambos de captación similar. La citometría de flujo multiparámetro de la biopsia de parótida mostró células B de restricción lambda, CD20+, CD10+, BCL2+ (E). El análisis de la histología y la inmunohistoquímica confirmaron un linfoma folicular de bajo grado positive para CD20 (E, magnificación x200), CD10, BCL2, con baja tasa de proliferación (G-H; I: Ki-67 tinción, (magnificación original para todas las fotos x400, Barra= 50 µm). La translocación (14; 18) fue detectada en la biopsia de medula ósea y en el linfoma de parótida por FISH (J: Patrón de fusión dual balanceado t (14; 18)(q32;q21) en las células de linfoma en la parótida). El patrón de señal normal se muestra en las células epiteliales (K). El tumor de Warthin compuesto de espacios quísticos revestidos de epitelio oncocítico (L-M: linfoma folicular: rodeado por líneas blancas punteadas. CK: tinción de queratina) y papiloma oncocítico localizado en el maxilar izquierdo (N) también confirmado (magnificación original para todas las fotos x400, Barra= 50 µm).
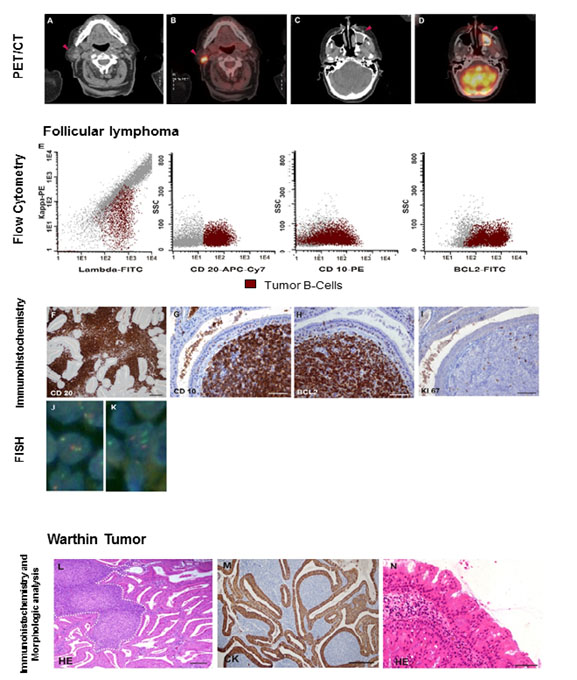
La citometría de flujo en la biopsia escisional de parótida reveló un 42% de células B Lambda restringidas con una dispersión avanzada baja y SSC, CD20+, CD10+, BCL2+ (Fig. 2E), CD38+, CD19+, y CD45+; consistente con un diagnóstico de linfoma folicular. El examen de las secciones histológicas confirmó un linfoma folicular de bajo grado, con una tasa de proliferación del 5%, medida con Ki-67 (Fig. 2F-I). Una translocación t (14; 18) (q32; q21) fue detectada en el linfoma de la parótida (Fig. 2J), así como también en la medula ósea, usando hibridación in situ fluorescente (IgH/ BCL2 sondas de color y translocación de fusión dual Vysis-Abbott).
También fue observado un tumor Warthin compuesto de espacios quísticos forrado por una bicapa de epitelio oncocítico papilar (Fig. 2L-M). El examen patológico de la biopsia maxilar mostró un papiloma oncocítico, constituido por un estroma fibrovascular forrado por múltiples capas de células columnares con características oncocíticas (Fig. 2N).
El diagnóstico final fue de un linfoma folicular primario de parótida coexistiendo con un tumor Warthin comprometiendo la medula osea en alguna extensión y un papiloma oncocítico localizado en el seno maxilar. Dada su edad, su escala Karnofsky y su riesgo intermedio FLIPI (2 puntos) fue tratada con monoterapia de Rituximab. Durante su última visita de seguimiento había recibido cuatro ciclos con una mejoría en el recuento de plaquetas (165 x 109 /L).
Discusión
La PCBM en sangre periférica se comporta como una población transitoria que podria estar asociada al proceso normal de inmunosenesencia de los adultos mayores. También ha sido propuesto que podría generarse por agentes infecciosos que causen estimulación antigénica persistente y crónica 9. La mayor parte de la LMCB (75%) muestra características fenotípicas similares a la leucemia linfocítica crónica y la restante se clasifica como leucemia linfocítica crónica atipica y LMCB CD5-negativa 10, y en menor frecuencia; clonas de células B CD10+ 1.
La PCBM ha sido detectada en él síndrome mielodisplásico, posterior a quimioterapia y trastornos benignos como trombocitopenia inmune o aislada, enfermedad pulmonar obstructiva crónica y enfermedad cardiovascular crónica 11 y en 1% de los causas sería la precursora de neoplasias de células B 5, 6. No es claro si en este caso la artritis reumatoidea haya sido precipitante de la aparición de las células clonales o del tumor.
En la única revisión de cohorte retrospectiva disponible de pacientes con la documentación incidental de PCBM en BM; 2.9% desarrollaron linfoma no Hodgkin 11 en cerca de 40 meses de seguimiento. Tres pacientes fueron clasificados bajo el inmunofenotipo CD5-/CD10+; de estos; uno desarrollo linfoma no Hodgkin. En el mismo estudio se encontraron algunas asociaciones limitadas con linfoma B difuso de células grandes; linfoma esplénico de células B de la zona marginal, leucemia de células peludas y macroglobulinemia de Waldenström. En nuestro caso, la PCBM llevo al diagnóstico de un linfoma folicular de rara presentación en la parótida asociado con tumor de Warthin, una coexistencia inusual, con 23 casos previos reportados.
Con este caso logramos establecer la asociación entre PCBM en la medula ósea y un linfoma de localización glandular. El hallazgo de este tipo de población de células promovió estudios adicionales que condujeron al diagnóstico final. No es claro el significado clínico de estas clonas y podría tratarse de una asociación al azar; sin embargo probaron ser útiles para la detección de diferentes formas de linfoma no Hodgkin, como se mostró en nuestro caso. Interesantemente, en él reporte previo de Chen et al., lo que llevo a estudios adicionales en la mayoría de los casos fueron las citopenias 11. De forma similar, la trombocitopenia fue la anormalidad hallada inicialmente en este caso. La evidencia para el uso de estas clonas en la medula ósea como herramienta de tamizaje de linfomas o para considerarlas como una condición premaligna real es insuficiente. Estudios prospectivos a futuro podrían ser útiles para confirmar la utilidad clínica de este hallazgo en particular.