Introduction
El dengue es una infección sistémica de etiología vírica, con gran impacto socioeconómico en diversos países tropicales y subtropicales del mundo. Estimaciones recientes proyectan 390 millones de infecciones por dengue por año (intervalo de credibilidad al 95% 284-528 millones), de los cuales 96 millones casos (intervalo de credibilidad al 95% 67-136 millones) cursan de manera sintomática con algún grado de severidad 1.
El virus del dengue (DENV) es el agente etilogico de esta enfermedad tropical, miembro de la familia Flaviviridae, del cual se reconocen cuatro serotipos (DENV-1 al -4). Su genoma corresponde a un ribovirus de cadena de polaridad positiva, el cual codifica tres proteínas estructurales (de cápside, prM y de envoltura) y siete proteínas no estructurales (NS1, NS2a, NS2b, NS3, NS4a, NS4b y NS5) 2,3
De acuerdo con los reportes de la Organización Panamericana de la Salud-OPS, en 2013, se reportaron 2,386,836 de casos de dengue en el continente americano, de los cuales 37,898 (1.6%) correspondieron a dengue grave, con una letalidad reportada de 0.06%. Para el caso de Colombia, se reportaron 127,219 casos de dengue (55% de los casos reportados para la subregión andina), de los cuales 3,377 (81.1% de los casos reportados en la subregión andina) correspondieron a dengue grave 4.
La severidad de esta enfermedad tropical puede variar de acuerdo con la edad, la etnia, factores genéticos, el estado inmune y comorbilidades presentes en el paciente. Igualmente, se reconoce la influencia de la co-circulación y de reinfecciones por diferentes serotipos DENV en la aparición de cuadros graves de dengue 5-9. Con respecto a esto, se ha propuesto la participación del estrés oxidativo inducido por la infección DENV en la patogenia del dengue grave, explicada desde su capacidad para promover la liberación de citoquinas pro-inflamatorias, y participando en conjunto en la inmunopatogénesis del dengue 10.
Por definición, el estrés oxidativo se considera un desbalance entre las sustancias pro-oxidantes y las antioxidantes, en favor de las primeras 11,12. Además, el estrés nitrosativo se define como una nitrosilación indiscriminada de biomoléculas 13. En ausencia de una respuesta compensatoria apropiada por parte del sistema de defensa antioxidante, se puede dar la activación de varias vías de señalización intracelular, que puede conllevar a la muerte celular o la aparición de condiciones patofisiológicas 13-16.
En coherencia con lo anterior, existen reportes relacionados con el incremento en: (i) las concentraciones plasmáticas de radical óxido nítrico-NO, de especies reactivas del oxígeno-ROS y del nitrógeno-RNS, (ii) en la relación GSSG/GSH, (iii) en la expresión génica de iNOS y en la fosforilación de STAT-1, durante la infección DENV in vitro 17-26.
En un estudio reciente, Olagnier et al. 27, reportaron que la infección de células dendríticas derivadas de monocitos/Mo-DC por DENV-2 tiene la capacidad de estimular la respuesta de estrés oxidativo mediado por el factor de transcripción Nrf-2, la cascada de señalización activando la óxido nítrico sintasa inducible-iNOS y la producción de ROS. Igualmente, reportaron un descenso significativo en los niveles de RNAm de la superóxido dismutasa mitocondrial/SOD-2, durante el tratamiento con un depurador de ROS. Además, establecieron la asociación entre la infección DENV-2 con la acumulación de ROS generados por NADPH oxidasas.
Estas líneas de evidencia sugieren que el estrés oxidativo-nitrosativo puede estar relacionado con la producción de proteínas asociadas con la patogénesis, con la susceptibilidad incrementada de infección DENV y con el desarrollo de hemorragias en el modelo raton, con la expresión de citoquinas pro-inflamatorias y con la replicación DENV, en varios cultivos celulares.
De acuerdo con el anterior escenario, se realizó la revisión sistemática de estudios observacionales cuyo objetivo estuviese relacionado con la evaluación del papel del estrés oxidativo-nitrosativo en la patogénesis del dengue. El entendimiento de la participación del estrés oxidativo-nitrosativo en el desenlace clínico de los pacientes con dengue podría tener potenciales implicaciones en el pronóstico y tratamiento de esta enfermedad.
Materiales y Métodos
Estrategia de búsqueda
El protocolo metodológico utilizado en este estudio, es coherente con los ítems propuestos en la declaración PRISMA 28, fue registrado en la base de datos internacional PROSPERO http://www.crd.york.ac.uk/PROSPERO (CRD42014014878). La búsqueda de los estudios observacionales se realizó en diversas base de datos electrónicas (PubMed, EMBASE, The COCHRANE library, ScienceDirect, Scopus, Scielo, LILACS via Virtual Health Library, Google Scholar), sin hacer restricción de idioma, período de publicación (hasta junio de 2014), edad del paciente (niños o adultos) o diseño de estudio.
Selección de estudios
Para la estrategia de búsqueda se utilizaron las siguientes palabras clave: dengue y dengue virus combinados con: oxidative stress, nitrosative stress, antioxidants, oxidants, free radicals, oxidized lipid products, lipid peroxides, superoxide dismutase, thioredoxin reductase, Oxido nitrico o Oxido nitrico synthase. También, se revisaron las listas de referencias en todos los artículos seleccionados.
La selección inicial fue realizada a partir del título y resumen excluyéndose: cartas para editor, revisiones, estudios in vivo/in vitro, en células de mosquito o de proteómica. En los casos de estudios duplicados, se incluyó la publicación más reciente.
Resultados
Identificación de estudios
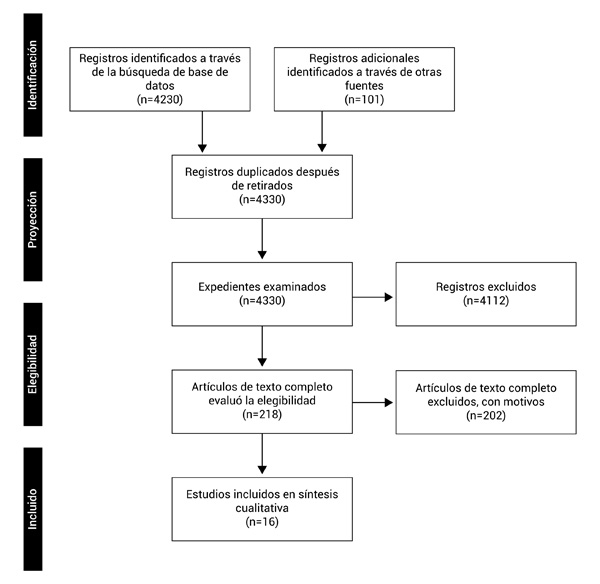
En total, se identificaron 4,331 artículos, de los cuales 16 fueron seleccionados para lectura a texto completo (Fig. 1). En la Tabla 1 se presenta la citación del estudio, las definiciones y características de cada uno de los estudios seleccionados.
| Estudio Primer autor, País, (Referencia) | Diseño del estudio | Objetivo | Tamaño de la muestra | Resultados |
|---|---|---|---|---|
| Ray, India, 50 | Caso-control | Evaluar el estado de enzimas antioxidantes, enzimas de origen hepático y muscular y otros indicadores bioquímicos en niños con dengue | 66 niños con dengue | SOD: ↑Pacientes vs. Controles ( |
| (45 dias a 12 años ) | ||||
| 25 ninños sanos | GPx: ↓ Pacientes vs. Controles ( |
|||
| period de seguimineto: ninguno | ||||
| Valero, Venezuela, 34 | Caso-control | Determinar las concentraciones séricas de NO en pacientes con FD y FHD | 105 pacientes con dengue | Oxido nitrico: |
| 53 individuos sanos | ↑ DF vs. DHF (p <0.01) | |||
| (controles pareados por edad) | ↑ DF vs. Controles (p <0.01) | |||
| period de seguimineto: ninguno | ||||
| Gil, Cuba, 39 | Caso-control | Estudiar el estado de algunos marcadores de estrés oxidativo en adultos con dengue | 22 adultos con dengue | TAS (dia 7): ↑ Pacientes vs. Controles ( |
| (21 a 58 años) | ||||
| 22 individuos sanos | PP - SOD - MDA/4-HAD (dias 3-5-7): ↑ Pacientes vs. Controles ( |
|||
| (Controlespareados por edad) | ||||
| period de seguimineto: 7 dias | THs - GPx (dias 3-5-7): ↓ Pacientes vs. Controles ( |
|||
| Klassen, Guatemala, 40 | Caso-control | Reportar datos de varios micronutrientes con antioxidantes en pacientes con dengue durante las tres fases clínicas | 9 adultos con dengue | Retinol: ↓ Pacientes (DI+DII) vs. Controles ( |
| (18 to 68 años) | Retinol (Pacientes): ↓ DI vs. DIII ( |
|||
| 12 individuos sanos | b-caroteno: ↓ DII vs. DIII (p= 0.03) | |||
| period de seguimineto: ninguno | GSH: ↓ DII vs. DI ( |
|||
| DI: admision en el hospital | GSH (at DIII): ↓ Pacientes vs. Controles ( |
|||
| DII: 5 dias despues de DI | TBARS (DI+DII): ↑ Pacientes vs. Controles ( |
|||
| DIII: 7 días después de DI | TBARS (at DIII): ↑ Pacientes vs. Controles ( |
|||
| TAS (DI vs. DII): ↓ Pacientes vs. Controles (p= 0.01) | ||||
| Trairatvorakul, Thailand, 35 | Caso-control | Establecer la correlación entre los niveles de NO en pacientes con FD, FHD y SCD | 110 niños con dengue | Oxido nitrico: |
| (<15 años) | ↓ Pacientes vs. Controles (p <0.05) | |||
| 38 niños sanos | ↑DF vs. DHF I/II (p <0.05) | |||
| (Controles pareados por edad) | ↓ DHF I/II vs. DSS (p <0.05) | |||
| Periodo de seguimiento: ninguno | ||||
| Rojas, Colombia, 51 | Estudio transversal | Evaluar la asociación entre los niveles de GPx y las manifestaciones y complicaciones del dengue | 161 pacientes con dengue | GPx: |
| (6 a 85 años) | ↑ Pacientes con hemorragias vs Pacientes sin hemorragia (p= 0.03) | |||
| Chareonsirisuthigul, Thailand, 25 | Estudio transversal | Investigar el efecto de ADA sobre la producción de citoquinas pro y anti-inflamatorias | 60 niños con dengue | Oxido nitrico (secondario DHF): |
| (5 a 10 años) | ↓ Fiebre dia vs. Convalescencia dia (p <0.05) | |||
| Soundravally, India, 48 | Caso-control | Evaluar si los cambios en las proteínas plasmáticas inducidos por estrés oxidativo pueden ser predictores tempranos de dengue grave | 80 pacientes con dengue (26-53 años) | PCO: |
| ↑ Pacientes vs. Controles (p <0.001) | ||||
| 63 individuos sanos | ↓ DF vs. DHF (p <0.05) | |||
| ↓ DF vs. DSS (p <0.05) | ||||
| ↓ DHF vs. DSS (p <0.05) | ||||
| (Controles pareados por edad y sexo) | PBSH: | |||
| ↓ Pacientes vs. Controles (p <0.001) | ||||
| Periodo de seguimiento: ninguno | ↑ DF vs. DHF (p <0.05) | |||
| ↑ DF vs. DSS (p <0.05) | ||||
| Soundravally, India, 41 | Caso-control | Investigar la asociación de la lipoperoxidación y la carbonilación de proteínas con la trombocitopenia en diferentes espectros clínicos del dengue | 80 pacientes con dengue (26-53 años) | MDA (3-5-7 dias): |
| ↑ Pacientes vs. Controles (p <0.05) | ||||
| 63 individuos sanos | ↓ DF vs. DSS (p <0.05) | |||
| MDA (5-7 dias): | ||||
| (Controles pareados por edad y sexo) | ↓ DF vs. DHF (p <0.05) | |||
| PCOs (7 dias): | ||||
| Periodo de seguimento: ninguno | ↑ Pacientes vs. Controles (p <0.001) | |||
| TAS (3-5-7 dias): | ||||
| 7 dias | ↓ DSS vs. Controles (p <0.05) | |||
| Mendes-Ribeiro, Brazil, 36 | Caso-control | Investigar los efectos de FD sobre vía L-Arg-NO en plaquetas | 16 pacientes con DF | Tasa total de trasnporte de L-arginina and transporte de L-arginina via sistema y+L: |
| (35 ± 4 años) | ↑ DF vs. Controles (p <0.05) | |||
| 18 controles sanos | Actividad total NOS: | |||
| (Controles pareadospor edad) | ↑ DF vs. Controles (p <0.05) | |||
| Periodo de seguimiento: ninguno | ||||
| Seet, Singapore, 45 | Caso-control | Investigar el estrés oxidativo durante la infección DENV | 28 pacientes con dengue | Plasma HETEs: |
| (23-68 años) | ↑ Estado febril vs. Controles (p <0.05) | |||
| ↑ Estado febril vs. Estado convalescente (p <0.05) | ||||
| 28 controles sanos | COPs: | |||
| ↓ Estado febril vs. Controles (p <0.05) | ||||
| (Controles pareados por edad) | F2-IsoPs urinario: | |||
| ↑ Estado febril vs. Controles (p <0.05) | ||||
| Periodo de seguimiento: 25 dias | ↑ Estado febril vs. Estado convalescente (p <0.05) | |||
| Lee, Singapore, 46 | Caso-control | Esclarecer la relación entre productos de oxidación de lípidos y enfermedades en humanos | 35 pacientes con dengue (25-86 años) | Plasma libre F2-IsoPs: |
| ↑ DF Comienzo vs. Controles (p <0.01) | ||||
| ↑ DF comienzo vs. DF recuperación (p <0.01) | ||||
| 47 controles sanos | F2-IsoPs urinario: | |||
| ↑ DF comienzo vs. Controles (p <0.01) | ||||
| ↑ DF comienzo vs. DF recovery (p <0.01) | ||||
| (Controles pareados por edad) | Plasma total HETEs: | |||
| ↑ DF comienzo vs. Controles (p <0.01) | ||||
| ↑ DF comienzo vs. DF recovery (p <0.01) | ||||
| Periodo de seguimiento: ninguno | COPs: | |||
| ↓ DF comienzo vs. Controles (p <0.05) | ||||
| ↓ DF comienzo vs. DF recovery (p <0.05) | ||||
| Levy, Venezuela, 28 | Estudio transversal | Comparar los niveles séricos de IL-6, TNF a, IL-1, NO, CRP, C3 y apoptosis en pacientes infectados con DENV y en cultivos de monocitos/macrófagos | 36 pacientes con DF | Oxido nitrico: |
| ↑ DF vs. Controles (p <0.001) | ||||
| (3-53 años) | ↑ DF vs. DHF (p <0.001) | |||
| ↑ Infeccion primaria vs. Controles (p <0.001) | ||||
| 34 pacientes con DHF | ↑ Infection secundaria vs. Controles (p <0.001) | |||
| (3-53 años) | ↓ Infection primaria vs. Infection secundaria (p <0.001) | |||
| Matsuura, Brazil, 37 | Caso-control | Investigar el transporte de L-Arg y la expresión de iNOS en plaquetas de pacientes con FHD | 23 pacientes con DHF (33±14 años) | transport de L-arginine via sistema y+L: |
| 25 individuos sanos | ↑ DHF vs. Controles (p <0.05) | |||
| (Controles pareadospor edad) | Actividad total NOS: | |||
| Periodo de seguimiento: ninguno | ↑ DHF vs. Controles (p <0.05) | |||
| Gil, Cuba, 44 | Caso-control | Estudiar el estado de índices redox | 22 pacientes con dengue | MDA - HPO - SOD - PP: ↑ Pacientes vs. Controles ( |
| (18-84 años) | ||||
| 194 individuos sanos | GSH: | |||
| (Controles pareados por edad) | ↓ Pacientes vs. Controles (p <0.05) | |||
| Periodo de seguimineto: 7 dias | ||||
| Soundravally, India, 13 | Caso-control | Evaluar los niveles plasmáticos de MDA, TNF α e IFN g durante la defervecencia del dengue | 81 pacientes con dengue | MDA: |
| (16-67 años) | ↓ DF vs. DHF (p <0.001) | |||
| 30 individuos sanos | ↓ DF vs. DSS (p <0.001) | |||
| (Controles parados pore dad y sexo) | ↓ DHF vs. DSS (p= 0.017) | |||
| Periodo de seguimiento: ninguno | ||||
| FD: fiebre dengue; FHD: fiebre hemorrágica del dengue; SOD: superóxido dismutasa; GSH: glutatión; GPX: glutatión peroxidasa; ALB: albumina; CAT: catalasa; MDA: malondialdehído; PCO: carbonilo proteico; HETEs: ácido hidroxieicosatetraenoico; COPs: productos oxidados del colesterol; F2-ISOPs: F2-isoprostanos; TAS: estado antioxidantes total; HPO: hidroperóxidos; PP: potencial de peroxidación; THs: hidroperóxidos totales. | ||||
Revisión de los estudios seleccionados
Delimitación espacial. En cuanto al país de origen, los estudios seleccionados se distribuyen de la siguiente forma: India (n= 4), Tailandia (n= 2), Singapur (n= 2), Cuba (n= 2), Guatemala (n= 1), Brasil (n= 2), Venezuela (n= 2) y Colombia(n= 1)
Diseño del estudio. El diseño de estudio más frecuente en los artículos revisados fue el de casos y controles (81.3%; 13/16).
Edad. Las poblaciones objeto de estudio de los artículos seleccionados pueden ser clasificadas en los siguientes grupos etarios: niños (menores de 10 años, n= 1), adolescentes (10-19 años, n= 1), niños y adolescentes (n= 1), adultos (mayores de 19 años, n= 7), adolescentes y adultos (n= 3), niños, adolescentes y adultos (n= 2) y grupo etario no reportado (n= 1).
Tiempo de seguimiento. Aproximadamente, el 63% de los estudios seleccionados se reportó un período de seguimiento de 7 días. No se reportó período de seguimiento en el 25% de los estudios revisados.
Sistema de clasificación de casos de dengue. En todos los estudios revisados se utilizó el sistema de clasificación de OMS-1997.
En la Tabla 2, se presentan los niveles plasmáticos de los diferentes biomarcadores de estrés oxidativo-nitrosativo identificados en los estudios seleccionados, tales como: productos de lipoperoxidación (malondialdehído-MDA e hidroperóxidos-THs), carbonilos proteicos (PCOs), enzimas antioxidantes (superóxido dismutasa-SOD, glutatión peroxidasa-GPx, paraoxonasa-PON), radical óxido nítrico y glutatión reducido (GSH).
| Marcadores | Metodos | Valores reportados | References |
|---|---|---|---|
| NO | Detección espectrofotométrica: | ||
| Absorbancia: 540 nm (reactivo de Griess) | DF casos (DENV-1): 57.4 ± 3.02 mM | 34 | |
| DF casos (DENV-4): 55.6 ± 2.25 mM | |||
| DHF casos (DENV-2): 13.87 ± 2.05 mM | |||
| DHF casos (DENV 4): 14.33 ± 1.25 mM | |||
| Controles: approx. 25 mM | |||
| Absorbancia: 540 nm (Kit comercial, método de Griess) | DF casos: approx. 40 mM | 28 | |
| DHF casos: approx. 22 mM | |||
| Controles: approx. <10 mM | |||
| DF casos: 124.94 ± 36.79 mM | 35 | ||
| DHF I/II casos: 99.69 ± 33.42 mM | |||
| DHF III/IV casos: 120.63 ± 46.26 mM | |||
| Controles: 168.18 ± 24.10 mM | |||
| MDA | Absorbancia: 532 nm (método de Satoh) | Casos de dengue: 4.9 ± 0.9 mM | 13 |
| Controles: 1.9 ± 0.4 mM | |||
| Absorbancia: 586 nm MDA + 4-HDA (Kit comercial | Casos de dengue: approx. 10-18 mM | 39 | |
| Controles: approx. <10 mM | |||
| Diferencia en absorbancias a 532 and 572 nm (método de Jentzsch) | Casos de dengue: 0.624 ± 0.144 mM | 40 | |
| Controles: 0.450 ± 0.116 mM | |||
| Absorbance: 532 nm (método de Satoh) | Casos de dengue: approx. 2-8 mM | 41 | |
| Controles: approx. 2 mM | |||
| THS | Absorbancia: 560 nm Oxidación de Fe(II) a Fe (III) por THs (Kit comercial) | Casos de dengue: approx. 50-150 mM | 39 |
| Controles: approx. 200-280 mM | |||
| Absorbancia: 560 nm Oxidación de Fe(II) a Fe (III) por THs | Casos de dengue: 119.6 ± 34.61 mM | 44 | |
| Controles: 70.3 ± 13.9 mM | |||
| PCOs | Absorbancia: 366 nm (método de Levine) | Casos de dengue: approx. 3.0-8.0 nmol/mg proteina | 41 |
| Controles: approx. 2.0-2.5 nmol/mg proteina | |||
| DF casos: 4.98 ± 0.47 nmol/mg proteina | 48 | ||
| DHF casos: 5.95 ± 0.61 nmol/mg proteina | |||
| DSS casos: 6.66 ± 0.70 nmol/mg proteina | |||
| Controles: 1.97 ± 0.56 nmol/mg proteina | |||
| SOD | Absorbancia: 505 nm (Kit comercial) | DENV casos: approx. 1.8-3.0 U/ml | 39 |
| Controles: approx. 1.2-1.7 U/ml | |||
| DENV casos: 2.26 ± 0.71 U/mg Hb | 44 | ||
| Controles: 1.41 ± 0.72 U/mg Hb | |||
| Absorbancia: 480 nm (método de epinefrina) | DF: 26.85 ± 8.13 U/ml | 50 | |
| DHF: 23.17 ± 9.98 U/ml | |||
| DSS: 24.86 ± 9.22 U/ml | |||
| Controles: 2.31 ± 0.97 U/ml | |||
| NO: radical óxido nítrico; MDA: Malondialdehído; 4-HAD: 4-hidroxialquenal; TBARS: sustancias reactivas al ácido tiobarbiturico THs: hidroperóxidos totales; PCOs: carbonilos proteicos; SOD: superóxido dismutasa; FD: fiebre dengue; FHD: fiebre hemorrágica del dengue SCD: síndrome de choque por dengue; UV: luz ultravioleta. | |||
Entre éstos, los biomarcadores más utilizados fueron los productos de lipoperoxidación (35.7%; 10/28), las enzimas antioxidantes (17.9%; 5/28) y el radical óxido nítrico 10.7%; 3/28).
Discusión
No se tiene conocimiento de revisiones previas que estudien la participación del estrés oxidativo-nitrosativo en la patogénesis del dengue. En la presente revisión sistemática se identificaron 16 artículos relacionados a esta participación.
Tanto in vivo como in vitro, se ha reportado la capacidad inmunomoduladora del radical óxido nítrico y su asociación con las infecciones víricas 29,30. Aun así, existen reportes de resultados incongruentes obtenidos en pacientes infectados con DENV. Por ejemplo, se han observado niveles séricos del radical óxido nítrico más elevados en pacientes con fiebre dengue (FD) que en controles sanos 25,31 o en pacientes con fiebre hemorrágica por dengue (FHD) 25. En contraste, Trairatvorakul et al. 32, reportaron que los niveles séricos del radical óxido nítrico fueron significativamente superiores en niños sanos que en pacientes con FD o con FHD. Es importante señalar que estos estudios presentan una baja relación caso/control (1:0.5).
Los resultados de los dos primeros estudios son coherentes con la alta actividad NOS total y el alto transporte de L-arginina vía sistema y+L encontrados en plaquetas obtenidas de pacientes con FD y FHD, en comparación con controles sanos 33,34.
En un estudio realizado por investigadores tailandeses se reportó que los niveles plasmáticos del radical óxido nítrico en 37 niños con FD primaria, FD secundaria o con FHD primaria, no fueron significativamente diferentes en ninguna de las tres fases clínicas del dengue- febril, de defervescencia o de convalecencia, mientras que estas concentraciones plasmáticas fueron significativamente más bajas en la fase febril en comparación con la fase de defervescencia en niños con FHD secundaria. Aunque pudieron establecer una correlación inversa entre los niveles séricos del radical óxido nítrico y la viremia DENV en pacientes con FHD secundaria 22, no encontraron ninguna asociación con el serotipo DENV 31.
Estas observaciones son consistentes con los hallazgos reportados por Yen et al. 17, en cuanto a la coincidencia temporal entre la activación de iNOS, la producción de radicales libres y el desarrollo de hemorragias en ratones infectados por DENV.
La producción sistémica del radical óxido nítrico es frecuentemente evaluada a partir de la cuantificación de los niveles sanguíneos de nitrito y nitrato, utilizando ensayos espectrofotométricos basados en el reactivo de Griess 35. Los resultados discrepantes presentados en la Tabla 2, podrían ser explicados por las diferencias en los métodos utilizados para la reducción de nitrato y para la desproteinización o por las diferencias en las características intrínsecas de las poblaciones estudiadas.
En cuanto a la utilización de los productos de lipoperoxidación como biomarcadores de estrés oxidativo, en varios estudios se han reportado altos niveles séricos de MDA y de 4-hidroxialquenos/4-HAE en pacientes con dengue en comparación con adultos sanos 10,36-38. Adicionalmente, existen reportes de mayores niveles séricos de MDA en pacientes con FHD y con síndrome de choque por dengue-SCD que en pacientes con FD. Estos mismos autores reportan una correlación positiva entre los niveles séricos de MDA y de TNF-α, en todos los pacientes infectados con DENV 10.
Lo anterior es coherente con los resultados reportados en un reciente estudio, en relación a que los ratones infectados por DENV-2 muestran alteraciones relacionadas con el estrés oxidativo, tales como un incremento en los niveles de MDA 18. En conjunto, estos resultados proveen evidencias directas del posible uso de los productos terminales de la lipoperoxidación como biomarcadores pronósticos en pacientes con dengue.
Con la utilización del método de Satoh, se han reportado concentraciones similares de MDA 10,38. Tanto en pacientes como en controles sanos, Klassen et al. 37, reportaron bajos niveles de MDA utilizando el método corregido de Jentzch. En cambio, Gil et al. 36, reportaron altos niveles séricos de MDA en pacientes con dengue. Esta diferencia puede ser explicada por la detección de MDA en combinación con 4-HAE o por la sensibilidad y reproducibilidad del método utilizado 39.
A pesar de que los niveles de THs pueden ser considerados como una medida del daño oxidativo total 40, no existe un patrón consistente de las concentraciones séricas de THs en los pacientes con dengue. Gil et al. 36, reportaron una disminución significativa de estas concentraciones al comparar pacientes con dengue con adultos sanos. Pero, este mismo grupo de investigadores recientemente han reportado niveles séricos de THs elevados en pacientes con dengue en comparación con controles adultos 41. En estos dos estudios se reportaron concentraciones similares de THs en los pacientes enfermos, más no en los controles sanos.
Los productos de oxidación del colesterol (COPs), isoprotanos (IsoPs) y productos del ácido hidroxieicosatetraenoico (HETEs), también han sido utilizados como biomarcadores de estrés oxidativo. Durante la fase febril del dengue, se han detectado altos niveles de F2-IsoP en orina y altos niveles plasmáticos de HETEs, en comparación con lo encontrado durante la convalecencia y en los adultos sanos 42. No se reportaron diferencias significativas en cuanto: (i) niveles totales de F2-IsoPs en todas las tres fases clínicas del dengue en comparación con los niveles encontrados en los controles sanos 42,43, (ii) concentraciones urinarias de F2-IsoPs y niveles plasmáticos de HETEs al comparar las fases de defervescencia y de convalecencia 42 y (iii) las concentraciones totales de F2-IsoPs entre el inicio de la FD y el estado de recuperación de la FD. Sin embargo, se detectaron elevados niveles plasmáticos totales de HETEs y bajos niveles de COPs al comparar el inicio de la FD con el estado de recuperación o con los controles sanos 43.
El contenido de carbonilos proteicos (PCOs) es utilizado como un importante biomarcador de daño oxidativo en proteínas en diversas enfermedades humanas relacionadas con el estrés oxidativo 44. Se han reportado altas concentraciones séricas de PCOs en pacientes con dengue en comparación con controles adultos. Es más, estos altos niveles séricos han sido asociados con la severidad del dengue 38,45. Interesantemente, en ambos estudios se reportaron concentraciones similares de PCOs, utilizando el método de Levine.
Por definición, el estrés oxidativo también involucra el sistema de defensa antioxidante, el cual incluye: enzimas antioxidantes (SOD, GPx, glutatión reductasa-GR, catalasa-CAT, el sistema de tioredoxina-TRX, etc.), depuradores de ROS (GSH, albumina, ácido ascórbico y ácido úrico) y quelantes de metales de transición (transferrina, ferritina, metalotioneina y ceruloplasmina) 46.
Para todos las edades estudiadas, se han reportado altos niveles séricos de SOD y bajos niveles de GPx en pacientes con dengue, a diferencia de los controles 36,41,47. Aunque al comparar estos dos grupos de individuos, no se encontraron diferencias significativas en cuanto a las concentraciones plasmáticas de los nutrientes antioxidantes, es importante señalar que solo se analizaron 9 pacientes con dengue y 12 controles sanos 37.
Existe un reporte de asociación entre los niveles séricos de GPx con la aparición de eventos hemorrágicos espontáneos y con los niveles de triglicéridos en pacientes con dengue. Esto permite pensar que la intensidad del estrés oxidativo puede influir en la presentación clínica del dengue 48. Adicional y coherente con esto, se ha reportado un incremento en los niveles de triglicéridos principalmente en pacientes con dengue grave 49. En consecuencia, es posible que el perfil de lípidos séricos en pacientes infectados pueda jugar un papel importante en la severidad del dengue.
Durante el curso clínico del dengue se producen radicales libres y se presentan alteraciones en los niveles de antioxidantes 37. GSH es uno de los principales protectores celulares contra el daño oxidativo 46. Existen diferencias entre los reportes que comparan las concentraciones de GSH entre pacientes con dengue y controles sanos. Gil et al. 36, y Klassen et al. 37, reportaron que los niveles séricos de este depurador no enzimático no fueron significativamente diferentes entre los dos grupos, mientras que Gil et al. 41, reportaron que las concentraciones séricas de GSH fueron significativamente inferiores en los pacientes con dengue que en los controles. Es importante señalar que: (i) estos tres estudios fueron realizados en poblaciones de América central y del Caribe y (ii) el número de pacientes estudiados fue pequeño (n 22).
Más allá de las limitaciones propias de las revisiones sistemáticas, las evidencias presentadas en este estudio muestran que la presencia de estrés oxidativo-nitrosativo en pacientes con dengue puede ser demostrada por cambios en los niveles séricos o plasmáticos del radical óxido nítrico, de antioxidantes y de marcadores de oxidación proteica y de lipoperoxidación.
Adicionalmente, el aumento en los niveles séricos de PCOs y MDA parece estar asociado con la severidad del dengue, expresada en términos del anterior sistema de clasificación de casos de dengue (OMS-1997). De acuerdo con esto, se hace necesario evaluar la posible asociación entre el estrés oxidativo-nitrosativo y la severidad del dengue en el contexto del nuevo esquema de clasificación (OMS-2009).
Conclusiones
En relación con la información encontrada en los 16 artículos revisados, tanto el estrés oxidativo como el nitrosativo pueden ser demostrados en pacientes que cursan el dengue, basándose en los cambios de los niveles plasmáticos o séricos de diversos biomarcadores, tales como el radical óxido nítrico, enzimas y depuradores no enzimáticos antioxidantes, productos finales de lipoperoxidación y de la oxidación de proteínas. Es más, parece que altos niveles séricos de PCOs y MDA pudieran ser utilizados como marcadores pronósticos de severidad del dengue.
Aunque son muchos los estudios relacionados con la patogenia y la severidad del dengue, el entendimiento de estos dos procesos es incompleto. Si se puede profundizar en la comprensión de la relación entre el estrés oxidativo-nitrosativo y la patogénesis del dengue se podrían desarrollar estrategias pronosticas válidas para esta enfermedad tropical.