Introducción
La nefropatía inducida por medio de contraste (NIC) es una forma de lesión renal aguda (LRA) usualmente reversible que se presenta después de la administración intra-arterial o intravenosa del medio de contraste; esta complicación representa la tercera causa más común de LRA de novo en pacientes hospitalizados y se asocia a un aumento del riesgo de complicaciones como: infarto agudo de miocardio, mayor estancia hospitalaria y mayores costos, especialmente cuando el manejo requiere la utilización de terapia de reemplazo renal 1,2.
La NIC se define por algunos de los siguientes criterios: a) incremento absoluto de la creatinina sérica >0.5 mg/dL, b) incremento relativo >25% de la creatinina sérica con respecto a la basal, ó c) disminución en 30-60 mL/min/1.73 en la tasa de filtración glomerular estimada (TFG) calculada con cualquiera de las fórmulas autorizadas, en ausencia de otra causa que la explique, durante las primeras 24-72 h post-exposición al medio de contraste 3,4. Otras definiciones publicadas en la literatura, incluyen un incremento de la creatinina sérica ≥0.3 mg/dL ó 1.5 veces la creatinina basal hasta 7 días después, ó disminución del volumen urinario <0.5 mL/kg/h por 6 h luego de la exposición 5; sin embargo las primeras dos definiciones son en la actualidad las que mayor consenso presentan.
La patogénesis exacta de la NIC es incierta; se ha propuesto que juega un papel importante la injuria hipóxica y la generación de radicales libres inducidos por la exposición al contraste 6. En la actualidad las medidas de prevención son la mejor opción para los pacientes con factores de riesgo de desarrollar NIC y para ello se han propuesto diferentes estrategias; entre ellas la hidratación con solución salina (SSN) 0.9% peri-procedimiento 7,8 y la administración de bicarbonato de sodio (BS) 9,10; terapias que al parecer tienen un efecto protector en la prevención de NIC; sin embargo los resultados de múltiples ensayos que han utilizado estas medidas han sido controversiales, y no es claro cuál es la mejor estrategia de manejo 11; varias revisiones sistemáticas y meta-análisis realizados al respecto, han mostrado que el BS fue beneficioso para evitar la NIC pero no mejoró otros resultados clínicos como muerte, falla cardíaca y necesidad de terapia de reemplazo renal (TRR); además estos meta-análisis presentaron sesgos de publicación y una heterogeneidad significativa 11,12. El objetivo del presente estudio fue determinar la efectividad del BS comparado con la SSN 0.9% en la prevención de NIC en pacientes mayores de 18 años expuestos a medio de contraste.
Materiales y Métodos
Protocolo
La realización de esta revisión y meta-análisis se realizó de acuerdo a los criterios para la elaboración de protocolos en revisiones sistemáticas de la Colaboración Cochrane 13 y Prisma 14.
Criterios de elegibilidad
Se incluyeron ensayos clínicos controlados en donde se comparó la infusión de BS vs SSN 0.9% como estrategias de prevención de NIC en población adulta mayor de 18 años con factores de riesgo para enfermedad renal o enfermedad renal crónica diagnosticada, que fueron llevados a procedimientos de coronariografía, radiología intervencionista o pruebas diagnósticas que requirieron medio de contraste. Se incluyeron estudios publicados en el idioma inglés o español y en bases de datos bibliográficas; no se hizo restricción en el tiempo de publicación.
Se definió NIC como una disminución mayor al 25% en la tasa de filtración glomerular calculada mediante la fórmula CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) o como un incremento de la creatinina sérica con relación a su basal, mayor a 0.5 mg/dL a las 48 h del procedimiento o un incremento absoluto del 25% con respecto a la basal 4,15. Adicionalmente se evaluaron algunos desenlaces secundarios como la necesidad de terapia de reemplazo renal (TRR), diferencia de cambio de creatinina sérica basal y mortalidad.
Fuentes de información y estrategias de búsqueda
Se realizó una búsqueda de los estudios registrados en el Grupo Renal de la Colaboración Cochrane usando los términos de nefropatía inducida por medio de contraste. Adicionalmente, se realizó una búsqueda en el registro de la colaboración Cochrane (CENTRAL) de todos los ensayos clínicos registrados usando los términos: nefropatía, bicarbonato, solución salina y medio de contraste. También se consultó en varias bases de datos electrónicas usando términos con estrategias altamente sensibles para la identificación de ensayos clínicos controlados. Para PUBMED se emplearon: "contrast nephropathy", "sodium bicarbonate", "sodium chloride" y "renal failure"; para EMBASE: "sodium chloride", "acute renal failure", "contrast nephropathy","sodium bicarbonate". Adicionalmente se realizó búsqueda en la bases de datos latinoamericana LILACS y SCIELO usando los términos "nefropatía inducida por medio de contraste", "bicarbonato de sodio", "solución salina".
Selección de artículos
Dos autores de manera independiente (CAZ y DB) evaluaron los títulos y resúmenes de los estudios identificados por las estrategias de búsqueda y examinaron los estudios completos de cualquiera que potencialmente cumpliera con los criterios de elegibilidad. Cualquier desacuerdo entre ellos se resolvió por un tercer autor (LMS). Después del análisis se decidió qué estudio cumplió con los criterios de inclusión. El acuerdo entre los evaluadores se evaluó por medio de Kappa.
Extracción de los datos
Un autor (LMS) se designó para la elaboración de un formato estándar electrónico de recolección de datos. Los otros autores (CAZ y DB) evaluaron y aprobaron el formato, previo a la extracción de los datos. Sin embargo la autora (LMS) realizó una doble entrada de los datos con el objetivo de corregir errores y datos faltantes.
La información extraída de cada estudio incluido fueron: edad, motivo de la exposición al medio de contraste, diagnóstico, antecedentes de enfermedad renal y/o diabetes, dosis y tipo de medio de contraste utilizado, tipo de intervención realizada (dosis de BS, tiempos antes de la exposición); del control (dosis, y duración de la infusión); y tipos de desenlaces medidos (NIC, necesidad de TRR y muerte).
Analisis
Riesgo de sesgos. Se empleó el formato propuesto por la colaboración Cochrane para la valoración del riesgo de sesgos de los estudios primarios 13. Se determinó en cada estudio la forma de aleatorización, el ocultamiento de la secuencia aleatoria, cómo y quiénes en el estudio fueron cegados a la intervención, recolección de los datos, proporción de datos perdidos y como se manejaron, el tipo de análisis realizado, y si se generó sesgo de notificación. Este análisis se realizó en forma separada por dos de los evaluadores (LMS y DB), cualquier desacuerdo entre los autores que evaluaron los estudios fue resuelto por consenso con un tercer evaluador (CAZ). Para determinar el consenso se utilizó Kappa.
Medidas de resumen y plan de análisis. Para cada desenlace y cada estudio se generó una tabla de 2x2 en la cual se resumió el número de pacientes que presentaron el evento o desenlace en cada grupo de comparación y el total de pacientes en cada grupo. Para todos los cálculos estadísticos se empleó el programa Review Manager(r) versión 5.3, excepto para los análisis de metarregresión en los cuales se usó el programa Comprehensive Meta-Analisis(r) 2.0. Se calculó el peso del tratamiento a través de los estudios. Los resultados se presentan en forma de diferencia de riesgo (DR) con su intervalo de confianza (IC) del 95% para variables dicotómicas y diferencia de medias con su intervalo de confianza del 95% para las variables continuas. Se usó el método Dersimonian y Laird de efectos aleatorios para todos los desenlaces. Se escogió este método por generar estimadores e IC conservadores porque incluye la varianza intra y entre estudios. Para todos los resultados se muestran los valores de pde 2 colas, considerándose valores de p <0.05 como estadísticamente significativas.
Para identificar el riesgo potencial de heterogeneidad se empleó el test estadístico Tau2 considerándose un valor de p <0.1 estadísticamente significativa, y el test de I2 en la cual un valor mayor de 50% indica heterogeneidad.
Se realizó un análisis por subgrupos de acuerdo a la calidad metodológica de los estudios, también para el uso de N-Acetilcisteina (NAC) y el tipo de medio de contraste empleado (iso-osmolar o hipo-osmolar), dado que cada vez se argumenta que el riesgo de lesión renal es mayor cuando se emplea un medio de contraste hipo-osmolar en comparación con los iso-osmolares. Adicionalmente se realizó una meta regresión evaluando si la presencia de diabetes o la cantidad del medio de contraste empleado podría tener alguna relación con el desarrollo de NIC. Para estos análisis se reportan los valores de p de 2 colas, considerándose valores menores de 0.05 para la interacción o el coeficiente de regresión, respectivamente como estadísticamente significativo.
Sesgos de publicación a través de los estudios
Se generó una figura de embudo para evaluar la presencia, entre otros, del sesgo de publicación. Para este cometido se graficó el inverso de la varianza contra el logaritmo del RR. Se evalúo la presencia de asimetría, sin embargo la evaluación puede ser subjetiva por lo que se realizó el test de Egger de regresión lineal ponderada evaluando la asociación entre el tamaño del estudio y efecto estimado del tratamiento. Se considera una p <0.05 como estadísticamente significativa para sesgo de publicación.
Resultados
Selección de estudios
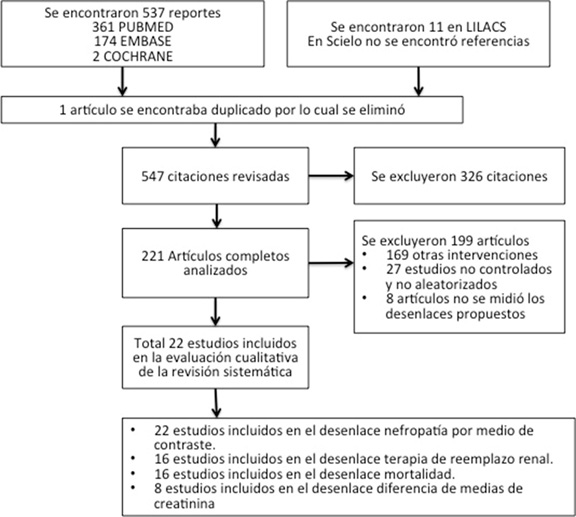
Se encontraron 548 reportes durante la búsqueda inicial en las bases de datos bibliográficas EMBASE, PUBMED, COCHRANE, SCIELO y LILACS. Después de la valoración inicial se excluyeron 327 publicaciones y quedaron 221 reportes, los cuales fueron analizados a través del texto completo. De ellos, 199 estudios fueron excluidos debido a que tenían otro tipo de intervenciones, eran no aleatorizados y/o controlados o no medían los desenlaces propuestos. Finalmente entraron para la revisión 22 estudios clínicos aleatorizados, controlados en los cuales se pudo evaluar el desenlace principal de NIC, con un total de 5,686 pacientes (Fig. 1).
Metodología
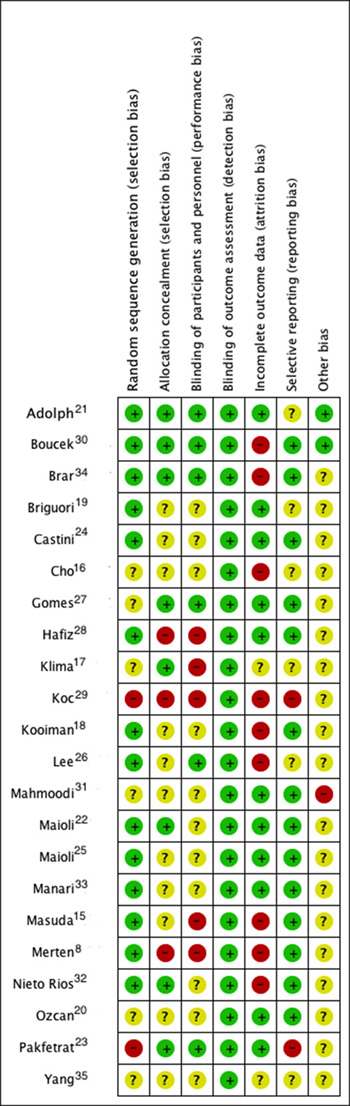
Los 22 estudios seleccionados para la revisión fueron estudios clínicos controlados aleatorizados publicados en inglés. Sin embargo en sólo ocho de los estudios (36%) se realizó ocultamiento de la secuencia aleatoria (Fig. 2).
Figure 2.
Risk of bias in the individual studies. Summary of risk of bias in the individual studies, which were grouped into seven domains that assessed the different potential sources of bias. The rating was performed by color: green indicates a low risk of bias, yellow indicates an unknown risk, and red indicates a high risk of bias.
Participantes
Los estudios incluidos aportaron en total 5,686 pacientes para el desenlace principal. En todos los estudios los pacientes tuvieron antecedentes de enfermedad renal o alto riesgo de desarrollarla. En muchas ocasiones este riesgo fue determinado por la medición de creatinina basal o por la tasa de filtración glomerular; en 12 estudios se definió como una creatinina mayor de 1.1 mg/dL a 1.5 mg/dL y en dos estudios con una TFG menor de 60 mL/min/1.73. En 13 estudios se utilizó medio de contraste de baja osmolaridad, ocho fueron iso-osmolar y en un estudio se utilizaron ambos medio de contraste.
Intervención
En todos los estudios se describió como fue la administración del BS; en 18 de ellos se diluyó con dextrosa en agua destilada al 5% (DAD 5%), y en 4 no es claro cuál fue el diluyente del bicarbonato 16-19, sin embargo la forma estable del bicarbonato sólo se logra con dextrosa por lo que se puede asumir que así se realizó. La cantidad de DAD 5% para diluir fue diferente; en 16 estudios se diluyeron 154 mL de bicarbonato (1,000 mEq/L) en 846 mL de DAD 5% 8,15,20-32,33; en los restantes se utilizaron diferentes mezclas entre bicarbonato y DAD 5%; la velocidad de infusión utilizada fue de 1 a 3 mL/k/h entre 1 a 12 h antes de la realización del procedimiento radiológico y luego entre 6 a 12 h post procedimiento (Tabla 1). En seis estudios 20,21,23,27,29,32 adicionalmente se utilizó NAC en conjunto con Bicarbonato de Sodio. La NAC siempre se administró entre 6 y 12 h antes de la intervención. En todos los ensayos se incluyeron pacientes llevados a procedimientos coronarios, tipo angiografía coronaria o intervención coronaria percutánea, y cuatro estudios incluyeron adicionalmente pacientes en quienes se realizó tomografía axial computarizada.
| Study (reference) | Age (years) | Serum creatinine or GFR | Diabetes N (%) | Procedure | Trial design | Dose of contrast media (DS) |
|---|---|---|---|---|---|---|
| Merten8 | >18 NaCl 69.2 (32-87) NaHCO3 66.7 (37-88) | Cr >1.1 mg/dL | NaCl: 27 (46%); NaHCO3 30 (50%) | CA. CAT | NaHCO3 1,000 mEq/L, 154 mL en 846 mL de DAD 5%, infusión de 3 mL/kg una hora antes del MC, seguido por una infusión de 1 mL/kg/h 6 h después vs. NaCl 154 mEq/L DAD 5% 1 mL/kg 6 h antes MC, seguido de una infusión de 1 mL/kg/h por 12 h | |
| Masuda36 | >20 NaCl 76 (11) NaHCO3 75 (8) | Cr >1.1mg/dL; GFR <60 mL/min/1.73 | NaCl: 10 (35%); NaHCO3: 8 (27%) | CA. PCI | 154 mL NaHCO3 1,000 mEq/L, en 846 mL de DAD 5% vs. NaCl 0.9%, 3 mL/kg una h antes del MC, seguido por 1 mL/kg/h durante 6 h mas | NaCl 120 mL (61) NaHCO3 112 mL (89) |
| Briguori37 | >18 NaCl 71 (9) NaHCO3 70 (9) | Cr >2 mg/dL GFR <40 mL/min/1.73 | NaCl: 61 (55%); NaHCO3: 53 (49%) | CA. PA. PCI | 154 mL NaHCO3 1,000 mEq/L, en 846 mL of DAD 5% + NAC, infusión de 3 mL/kg una hora antes del MC, seguido por una infusión de 1 mL/kg/h por 6 h vs. NaCl 0.9% + NAC. 1 mL/kg/h por 12 h mas después del MC | NaCl 179 mL (102) NaHCO3 169 mL (92) |
| Ozcan38 | >18 NaCl 70 (40-84) NaHCO3 68 (46-86) | Cr >1.2 mg/dL | NaCl: 47.7%; NaHCO3: 42% | CA. PCI | 154 mL NaHCO3 1,000 mEq/L, en 846 mL of DAD 5% + NAC, en infusión de 1 mL/kg por 6 horas antes y después del MC vs. NaCl 0,9% + NAC, 1mL/kg 6 h antes y después del MC | NaCl 110 mL (30-270) NaHCO3 100 mL (50-300) |
| Adolph39 | >18 NaCl 72.7 (6.5) NaHCO3 70.1 (8.4) | Cr >1.2 mg/dL GFR <63 mL/min/1.73 | NaCl: 23 (28.3%); NaHCO3: 26 (36.6%) | CA | 154 mL NaHCO3 1,000 mEq/L, en 846 mL de DAD 5% vs 154 mEq/L NaCl en DAD 5%, 2 mL/kg/h 2 h antes del MC y 1 mL/kg/h 6 h después | NaCl 138 mL (52) NaHCO3 141 mL (50) |
| Maioli40 | >18 NaCl 74 (70-79) NaHCO3 74 (67-79) | Cr >1.5 mg/dL GFR <60 mL/min/1.73 | NaCl: 59 (23%); NaHCO3: 62 (25%) | CA. PCI | 154 mL NaHCO3 1,000 mEq/L, en 846 mL of DAD 5%, 3 mL/kg una hora antes del MC, seguido de una infusión de 1 mL/kg/h por 6 h vs. NaCl 0.9% + NAC 1 mL/kg por 12 h antes y después del MC | NaCl 167 mL (66) NaHCO3 171 mL (69) |
| Brar41 | >18 NaCl 71 65-76) NaHCO3 71(65-75) | GFR <60 mL/min/1.73 | NaCl: 81 (45.5%); NaHCO3: 76 43.4%) | CA | 150 mL NaHCO3 1,000 mEq/L vs NaCl 0.9%, 3 mL/kg por 1 h antes del MC, seguido de una infusión de 1 mL/kg/h por 4 h mas | NaCl 137 mL (89-247) NaHCO3 126 mL (80-214) |
| Pakfetrat42 | >18 NaCl 58.4 (11.5) NaHCO3 57.8 (11.2) | NaCl: 31 (32.3%); NaHCO3: 26 (27%) | CA | 154 mL NaHCO3 1,000 mEq/L, en 846 mL de DAD 5%, 3 mL/kg por 1 h antes del MC, seguido por una infusión de 1 mL/kg/h por 6 h vs. NaCl 0.9% 1 mL/kg por 6 h antes y después del MC | NaCl 67 mL (41.1) NaHCO3 58 mL (32.7) |
|
| Cho22 | >18 NaCl 77.33 (9.39) NaHCO3 78.47(8.72) | Cr >1.1 mg/dL GFR <60mL/min/1.73 | NaCl: 8 (29.6%); NaHCO3: 9 (42.8%) | CA | 154 mL NaHCO3 1,000 mEq/L, en 846 mL of DAD 5%, infusión de 3 mL/kg por 1 h antes del MC, seguido por una infusión de 1 mL/kg/h por 6 h vs. NaCl 154 mEq/L. 3 mL/kg por 1 h antes del MC seguido de una infusión de 1 mL/kg/h por 6 h mas | NaCl 122.59 mL NaHCO3 136.31 mL |
| Castini43 | >18 NaCl 72.7 (8.2) NaHCO3 70 (8.3) | Cr >1.2 mg/dL | NaCl: 10 (20%); NaHCO3: 18 (35%) | CA. PCI | 154 mL NaHCO3 1,000 mEq/L, mas 846 mL de DAD 5%, 3 mL/kg por 1 h antes del MC, seguido por una infusión de 1 mL/kg/h 6 h mas vs. NaCl 0,9% 1 mL/kg por 12 h antes y después del MC | NaCl 196.4 mL (127.7) NaHCO3 179.2 mL (125.1) |
| Lee23 | >18 NaCl 67.5 (62-72) NaHCO3 68.5 (63-73) | Cr >1.1 mg/dL GFR <60 mL/min/1.73 | NaCl: 189 (100%); NaHCO3: 193 (100%) | 154 mL NaHCO3 1,000 mEq/L, en 846 mL of DAD 5%, infusión de 3 mL/kg por 1 h antes del MC, seguido por una infusión de 1 mL/kg/h por 6 h vs. NaCl 0.9% 1 mL/kg12 h antes y después del MC | NaCl 120 mL (79-223) NaHCO3 113 mL (80-220) |
|
| Maioli34 | 18 NaCl 66 (12) NaHCO3 (13) | NaCl:11 (20.7%); NaHCO3: 31(20.7%) | CA | 154 mL NaHCO3 1,000 mEq/L, en 846 mL of DAD 5%, infusión de 3 mL/kg por 1 h antes del MC, seguido por una infusión de 1 mL/kg/h 6 h mas, vs. NaCl 0.9%, 1 mL/kg 6 h antes del MC, seguido de una infusión de 1 mL/kg/h por 12 h antes y después | NaCl 216 mL (101) NaHCO3 208 mL (92) |
|
| Gomes44 | >18 NaCl 64.5 (12) NaHCO3 64.1 (12) | Cr >1.2 mg/dL GFR <50 mL/min/1.73 | NaCl: 45 (29.8%); NaHCO3: 43 (8.7%) | CA. PCI | 154 mL NaHCO3 1,000 mEq/L, en 846 mL de DAD 5%, infusión de 3 mL/kg por 1 h antes del MC, seguido por una infusión de 1 mL/kg/h 6 h mas vs. NaCl 0.9% 3 mL/kg 1 h antes del MC, seguido de una infusión de 1 mL/kg/h por 6 h mas | NaCl 125 mL (87) NaHCO3 124 mL (65) |
| Klima25 | >18 NaCl 75 (70-82) NaHCO3 78 (70-82) | Cr >1 mg/dL GFR <60 mL/min/1.73 | NaCl: 30 (34%); NaHCO3: 34 (39%) | CAT. CA. PA. PCI | NaHCO3 166 mEq/L, 3 mL/kg por 1 h antes del MC, seguido por una infusión de 1mL/kg/h por 6 h vs. NaCl 10.9% 1 mL/kg 8 h antes MC, seguido de una infusión de 1 mL/kg/h por 12 h mas | NaCl 100 mL (80-163) NaHCO3 100 mL (80-143) |
| Hafiz45 | >18 NaCl 73 (63-80) NaHCO3 74 (65-80) | Cr >1.4 mg/dL GFR <60 mL/min/1.73 | NaCl: 73 (45.3%); NaHCO3: 78 (49.1%) | CA | 154 mL NaHCO3 1,000 mEq/L, en 846 mL de DAD 5%, infusión de 3 mL/kg por 1 h antes del MC, seguido por una infusión of 1 mL/kg/h por 6 h +NAC vs. NaCl 0.9% + NAC 1 mL/kg por 12 h antes y después del MC | NaCl 100 mL (80-140); NaHCO3 110 mL (75-155) |
| Koc46 | >18 NaCl 62 (9) NaHCO3 62 (9) | NaCl: 100% NaHCO3: 100% | CA | 154 mL NaHCO3 1,000 mEq/L, en 846 mL of DAD 5%+NAC 3 mL/kg una hora antes del MC, seguido por una infusión de 1 mL/kg/h por 6 h más vs. NaCl 0.9%+ NAC 1 mL/kg 12 h antes y después del MC. | NaCl 90 mL (85-100) NaHCO3 90 mL (90-100) |
|
| Boucek47 | >18 NaCl 67 (10) NaHCO3 63 (11) | Cr >1.1 mg/dL | NaCl: 59 (100 %) NaHCO3: 61 (100%) | CA | 154 mL NaHCO3 of 1,000 mEq/L en 846 mL of DAD 5% vs. NaCl 5.85% 154 mL + 846 mL en DAD 5%, 3 mL/kg una hora antes del MC, seguido por 1 mL/k/h por 6 h mas. | NaCl 104 mL (32) NaHCO3 115 mL (47) |
| Kooiamn48 | >18 NaCl 72.5 (9.5) NaHCO371.6 (9.8) | GFR <60 mL/min/1.73 | NaCl: 76 (27%); NaHCO3: 71 (26.6%) | CAT. CA | 250 mL NaHCO3 1.4% IV vs. NaCl 1,000 mL antes y después del MC | NaCl 104.7 mL (21.6) NaHCO3 105.7 mL (21) |
| Mahmoodi49 | >18 NaCl 64.4 (11.07) NaHCO3 64.96 (10.29) | sin dato | CA | 154 mL NaHCO3 1,000 mEq/L, en 846 mL de DAD 5% + NAC vs. NaCl 0.9%+NAC, 3 mL/kg/h 6 h antes y después del MC | sin dato | |
| Nieto-Rios50 | >18 ; NaCl 59.8 (17.2) NaHCO3 60.7 (17.1) | Cr >1.2 mg/dL | NaCl: 39 (34.5%) NaHCO3: 43 (40.2%) | CAT. CA. PCI | 75 mL NaHCO3 1,000 mEq/L, en 425 mL de DAD 5%, 3 mL/kg una hora antes del MC, seguido por una infusión de 1 mL/kg/h por 6 h mas vs. NaCl 0.9% 1 mL/kg 6 h antes y después del MC | NaCl 100.6 mL (38.2) NaHCO3 99.3 mL (43.9) |
| Manari51 | >18 NaCl 65 (12.4) NaHCO3 63.9 (12.9) | sin dato | NaCl: 49 (16.7%); NaHCO3: 49 (16.4%) | CA. PCI | 77 mL NaHCO3 en 433 mL de DAD 5%, 1 mL/kg 12 h antes MC, seguido por una infusión of 1 mL/kg/h por 12 h mas vs NaCl 0.9% 1 mL/kg 12 h antes y después del MC | NaCl 199 mL (77) NaHCO3 194 mL (83) |
| Yang52 | >18 NaCl 59.6 (11.08) NaHCO3 58.71 (10.9) | sin dato | NaCl: 37 (22.9%) NaHCO3: 27 (16.9%) | CA. PCI | 450 mL NaHCO3, 433 mL en 1,050 mL de DAD 5%, 1.5 mL/kg 6 h antes y después del MC vs NaCl 0.9% 1.5 mL/kg 6 h antes y después | NaCl 124 mL (63.8) NaHCO3 127 mL (48.09) |
| Cr: serum creatinine; NaCl: sodium cloruro; NaHCO3: sodium bicarbonate; NAC: N-Acetilcisteíne; CA: coronary angiography,; PCI: percutaneous coronary intervention, PA: peripheral angiography, GFR: glomerular filtration rate; CAT: computerized axial tomography; CM: contrast media. | ||||||
Control
En todos los estudios el control se realizó con SSN 0.9%, que se administró en su mayoría entre 6 y 12 h antes y después del procedimiento. En seis ocasiones se adicionó NAC 20,23,27,29,32, la cual se administró entre 6 y 12 h antes de la intervención.
Desenlaces primarios
El desenlace principal evaluado en 13 estudios fue la presencia de NIC, definida como una elevación de la creatinina sérica en un 25% por encima de su estado basal o un aumento de 0.5 mg/dL durante las primeras 48 h luego de la aplicación del medio de contraste 8,15-17,19-22,27,29-32,; en siete estudios se utilizó la misma definición, pero hasta el día 5 post aplicación 23,25,26,28,33-35; los otros dos estudios utilizaron como desenlace el aumento máximo de la creatinina sérica 18,24.
Efectos secundarios
La necesidad de TRR fue evaluada en 15 estudios y fue definida en todos ellos como la necesidad de hemodiálisis 48 a 72 h posterior a la exposición del medio de contraste secundario a insuficiencia renal aguda 18-23,28,30-34; en un estudio se incluyó hasta el día 30 27.La mortalidad se definió como muerte por cualquier causa en los 28 días posterior al procedimiento en 15 estudios 15,16-19,21-23,26-29,31,32,34. La diferencia de creatinina fue evaluada en 8 estudios, los cuales reportaron la diferencia entre medias de creatinina antes y después de la exposición del medio de contraste en ambos grupos. En la (Tabla 1) se presentan las características de cada estudio individual incluidos en la revisión sistemática.
Riesgos de sesgos de los estudios incluidos
Los detalles de la calidad metodológica de los estudios individuales se presentan en la (Fig. 2) Para la evaluación de los riesgos de sesgos los autores tuvieron un acuerdo evaluado por Kappa de 0.67.
Aleatorización y ocultamiento.
La secuencia de asignación aleatoria se juzgó como inapropiada en dos estudios(9.1%) 24,30 dado que no se especificó y por la lectura del mismo se puede inferir que no se realizó ningún sistema de aleatorización. En 6 estudios (27.3%), aunque se reportó que efectivamente se hizo aleatorización, no se logró especificar de qué manera fue hecha 17,18,21,28,32,35; en los otros estudios se juzgó como adecuada la aleatorización. En cuanto al ocultamiento de la secuencia aleatoria, esta se juzgó como adecuada en 8 estudios(36.0%) 15,18,22-24,28,31,34; en 11(50.0%)se calificó como incierto dado que no se definióel tipo de ocultamiento y en tres (13.7%)no se realizó ocultamiento de la misma 8,29,30.
Cegamiento
En 5 estudios (9.1%) el cegamiento de los pacientes y de los médicos que realizaron la intervención se calificó como adecuada 22,24,28,31,34; en 12 (54.5%) no es claro cómo se realizó; y en 5 (22.7%) los participantes y los médicos conocían la asignación de la intervención 8,16,18,29,30; el cegamiento de quienes realizaron el análisis del estudio no fue especificado en todos los estudios, sin embargo el desenlace evaluado se calificó como objetivo, por lo cual se consideró que no aumentó de manera importante el riesgo de sesgos.
Retiros y manejo de datos perdidos
En 13 estudios(59.1%) se realizó el análisis de los datos con la totalidad de los pacientes aleatorizados, éstos no hacen referencia a la manera en que se manejaron los datos perdidos; en 9 (40.9%)estudios el análisis de los datos se realizó excluyendo los datos perdidos 8,15,19,23,26,27,30,31,34 y en 3 (13.6%)se hizo análisis interino 8,16,17.
Efectos de la intervención
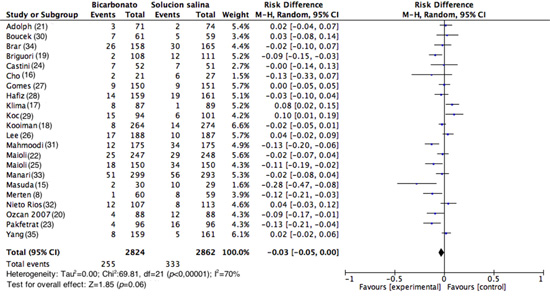
Desenlace primario (NIC). La incidencia de NIC osciló entre el 1.67% y el 17.06% en el brazo de BS y entre 1.12% y el 34.48% en el brazo de SSN 0.9%; al evaluar el porcentaje de pacientes con NIC de todos los estudios, esto ocurrió en 589 de los 5,686 pacientes evaluados (10.36%); en los pacientes que utilizaron BS fue de 9.03% (255/2,824) y en el grupo SSN 0.9% fue 11.67% (334/2,862).
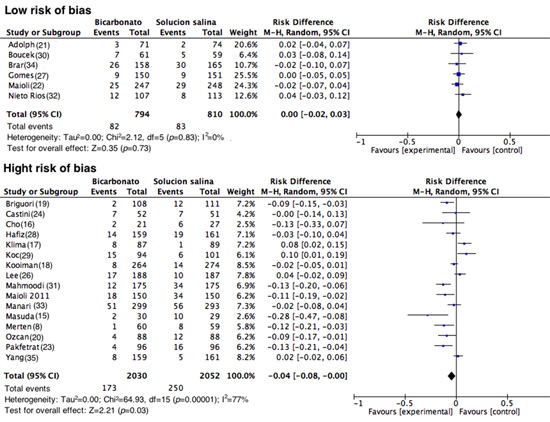
En total se analizaron 22 estudios (n= 5,686). Al evaluar el desenlace primario, el riesgo de presentar NIC fue menor en el grupo similar que recibió BS, sin embargo se observó una alta heterogeneidad para todos los estudios (DR= -0.03 IC 95%= -0.05-0.00, I2= 70%, p <0.001) (Fig. 3). No obstante en el análisis de subgrupo se encontró que en los estudios de buena calidad metodológica (generación aleatoria de la secuencia, ocultamiento de la asignación y cegamiento de los participantes y del personal), 82 de 794 pacientes presentaron NIC en el grupo de BS vs 83 de 810 pacientes en el grupo control (DR= 0.00 IC 95%= -0.02-0.03; p= 0.83 I2= 0%) (Fig. 4). Al evaluar los estudios con alto riesgo de sesgos, los resultados favorecen el uso de BS, sin embargo la heterogeneidad es alta (DR= -0.04, IC 95%= -0.08-0.00, I2= 77% p <0.001) (Fig. 4).
Figura 3.
Analisis de los estudios que presentaron Nefropatia por medio de contraste. Diagrama de bosque donde se observa el número de participantes y el número total de eventos (nefropatia por medio de contraste) tanto en el grupo intervencion como en el grupo control, los estimadores puntuales evaluados por diferencia de riesgos, sus intervalos de confianza y el meta-analisis realizado.
Figura 4.
Nefropatia por medio de contraste agrupado segun el riesgo de sesgos. Diagrama de bosque de los estudios agrupados segun el riesgo de sesgos de los estudios, se consideraron estudios con bajo riesgo de sesgos aquellos estudios en donde los dominios: generacion de la secuencia aleatorizada, ocultacion de la asignacion y cegamiento de los participantes y del personal fue calificada como bajo riesgo o riesgo desconocido.
Análisis por subgrupo
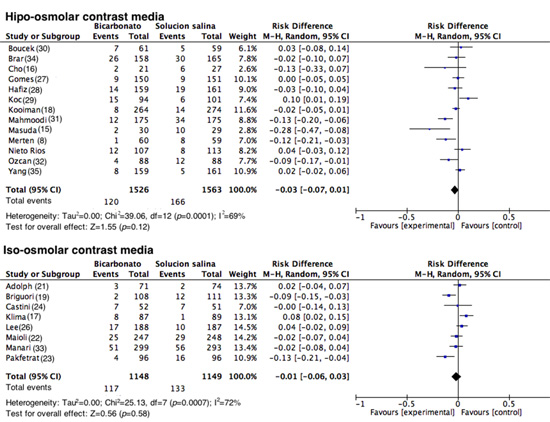
Medio de contraste utilizado. Para el análisis de subgrupos según el medio de contraste utilizado, en los estudios donde se utilizó medio de contraste hipo-osmolar, el grupo que recibió BS presentó 120 eventos de 1,526 (7.86%) vs 166 eventos de 1,563 (10.62%) en el grupo de SSN 0.9% (DR= -0.03 IC 95%= -0.07-0.01, I2= 69% p <0.001) (Fig. 5); en los estudios donde se utilizó medio de contraste iso-osmolar se encontraron 117 eventos de 1,148 (10.2%) en el grupo BS vs 133 eventos de 1,149 (11.50%) en el grupo de SSN 0.9 % (DR= -0.01, IC 95%= -0.06 a 0.03; I2= 72%, p <0.001) (Fig. 5). Se excluye del análisis un estudio 26 debido a que no se especifica el tipo de medio de contraste utilizado.
Figura 5.
Nefropatia por medio de contraste de acuerdo al medio de contraste utilizado. Diagrama de bosque agrupando los estudios segun el medio de contraste utilizado (iso-osmolar, hipo-osmolar), los resultados se expresan como diferencias de riesgos con sus respectivos intervalos de confianza.
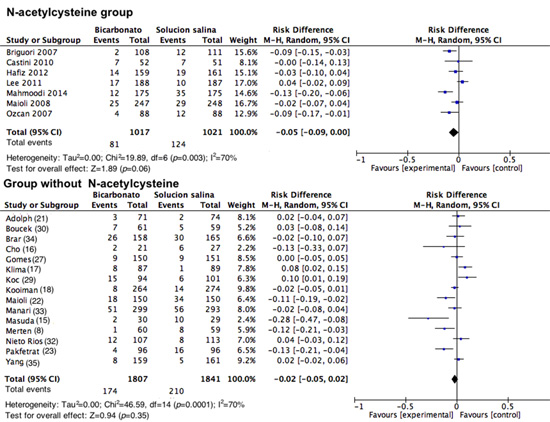
Nefropatia indicuida por el contraste en pacientes en quienes se utilizó NAC. Al analizar cómo se comportaron los estudios que incluyeron intervención con NAC, se encontró una DR para NIC de -0.05 con un IC 95%= -0.09-0.00, I2: 70%; p <0.001 (Fig. 6); en los estudios donde no se utilizó la NAC tampoco se encontró ninguna diferencia (DR= -0.02, IC 95%= -0.05-0.02 I2= 70% p <0.001) (Fig. 6). No se realizó el análisis en los estudios con bajo riesgo de sesgos ya que sólo un estudio se podría incluir en el grupo de NAC.
Figura 6.
Nefropatia inducida por medio de contraste en pacientes agrupado por el uso o no de N acetil cisteina. Diagrama de bosque agrupando los estudios segun el uso o no de N acetil-cisteina como conintervencion adicional a la solucion salina o bicarbonato, los resultados se expresan como diferencias de riesgos con sus respectivos intervalos de confianza.
Metaregresión
Se realizó análisis de metaregresión para evaluar si la cantidad del medio de contraste puede explicar el desarrollo de NIC a través de los estudios primarios, se encontró que la variable volumen de contraste no tiene un efecto estadísticamente significativo sobre el riesgo de NIC (p= 0.59). Por el contrario, al evaluar si el antecedente de diabetes se relaciona con el riesgo de NIC, si se encontró una relación estadísticamente significativa (p= 0.034). Dado que se requieren más de 10 estudios para evaluar esta variable por metaregresión, no es posible hacerlo con los estudios con bajo riesgo de sesgos ya que sólo fueron inlcuidos 6 estudios.
Desenlaces secundarios
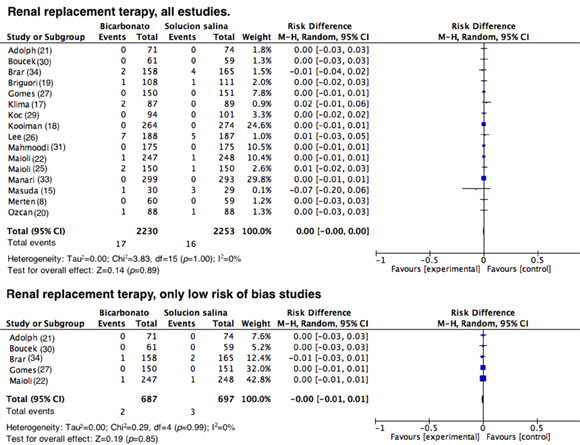
Terapia de reemplazo renal (TRR). Diez y seis estudios reportaron dentro de sus resultados la necesidad de TRR posterior a la exposición del medio de contraste. Sin embargo la cantidad de eventos fueron escasos en todos los estudios; se encontró una DR= 0.00, IC 95%= -0.00-0.00, I2 de 0%, p= 1 (Fig. 7); este resultado como ya se advirtió, fue esperado dado que en casi todos los estudios donde se evalúo este desenlace no se reportaron eventos. De manera similar se observó cuando se evaluó TRR en los estudios catalogados como de buena calidad metodológica, con una DR= 0.00 (IC 95%= -0001-0.01), I2 0%, p= 0.99 (Fig. 7).
Figura 7.
Necesidad de Terapia de Reemplazo Renal encontrada en todos los estudios y en aquellos con menor riesgo de sesgos. Diagrama de bosque donde se evalua la necesidad de terapia de reemplazo renal posterior a la administracion del medio de contraste, los resultados se expresan como diferencias de riesgos con sus respectivos intervalos de confianza.
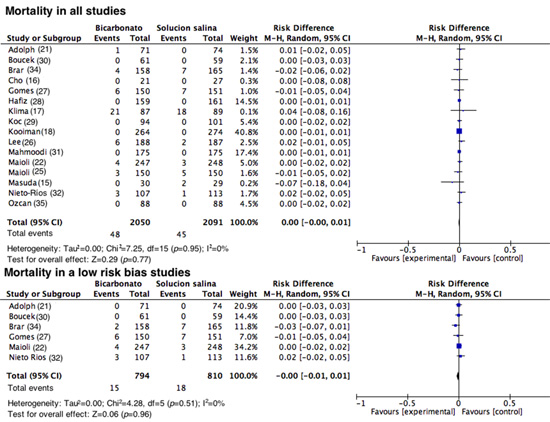
Mortalidad. Diez y seis estudios reportaron mortalidad dentro de sus desenlaces. De manera similar al desenlace de TRR, este evento fue infrecuente en ambos grupos; con una DR= 0.00(IC 95%= -0.00-0.01, I2= 0%, p= 0.95). Cuando se evaluaron los estudios de buena calidad metodológica, tampoco se encontró una disminución estadísticamente significativa del riesgo con una DR= -0.00 (IC 95%= -0.001-0.001, I2= 0%, p= 0.51) (Fig. 8).
Figura 8.
Mortalidad encontrada en todos los estudios y en aquellos con menor riesgo de sesgos. Diagrama de bosque donde se evalua la mortalidad encontrada en los primeros 28 dias posterior a la administracion del medio de contraste, los resultados se expresan como diferencias de riesgos con sus respectivos intervalos de confianza.
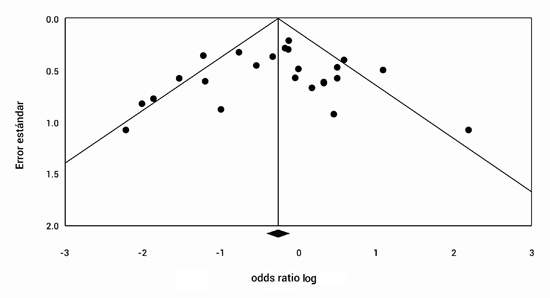
Sesgos de publicación
Al realizar la Figura de embudo se encontró poca asimetría entre los estudios (Fig. 9). El Test Egger de regresión generó una p= 0.69 (IC 95%= -2.11-1.44) la cual nos habla sobre el poco riesgos de sesgo de publicación entre los estudios.
Figura 9.
Grafico de embudo de todos los estudios evaluados. Grafico que ilustra la dispersion de la estimaciones de los efectos de la intervencion contra la precisión de cada estudio la cual aumenta cuando incrementa el tamano de la muestra, como se puede observar, esta grafica tiene una presentacion simetrica de sus estudios, lo que sugiere poco riesgo de sesgo de publicacion en los estudios evaluados.
Discusión
El número de procedimientos que requieren el suministro de medio de contraste se ha incrementado significativamente en la última década. En Estados Unidos por ejemplo, más de 10 millones de pacientes utilizan algún medio de contraste por año 36. Por otro lado, cerca de 658,000 personas son llevadas a Intervención Coronaria Percutánea anualmente, lo que equivale a un incremento del 32.6% entre 1987 y el año 2004 5. Sin embargo el uso de medio de contraste no está exento de riesgos y se han catalogado como sustancias nefrotóxicas.
La tasa mundial de NIC está cercana a los 150,000 pacientes cada año 4. Su incidencia oscila entre el 0.6 al 3.0% de la población general 37 y hasta en el 25.0% en los pacientes de alto riesgo, como lo son los diabéticos, sujetos con historia de falla cardíaca congestiva, enfermedad renal crónica 38, edad avanzada, desnutrición o el uso concomitante de medicamentos nefrotóxicos (anti-inflamatorios no esteroideos, inhibidores de la enzima convertidora de angiotensina, antagonistas del receptor 1 de angiotensina II y aminoglucósidos) 1,38. Otros factores de riesgo reportados en la literatura son el volumen del medio de contraste y la vía de administración utilizada (arterial vs intravenosa) 1,39.
Aunque la NIC esta generalmente definida como un deterioro transitorio en la función renal después de procedimientos con medio de contraste, no se puede considerar como una complicación benigna, hasta 0.8% de los pacientes pueden necesitar diálisis temporal y un 13.0% de ellos requerir TRR permanente 17, además prolonga la estancia hospitalaria, incrementa los costos médicos y el riesgo de morbi-mortalidad a corto y a largo plazo 26,27. Por esta razón cada vez han adquirido mayor relevancia los esfuerzos enfocados al estudio de estrategias preventivas de las posibles complicaciones derivadas del uso de medios de contraste.
Varios mecanismos fisiopatológicos se han sugerido para explicar la NIC; en condiciones normales la médula renal recibe poco oxígeno a pesar de que tiene alta actividad metabólica por la reabsorción de sustancias en el segmento S3 del túbulo contorneado proximal y la porción ascendente gruesa del Asa de Henle; por este motivo se requieren mecanismos como la liberación de prostaglandinas, óxido nítrico y adenosina, que regulan el flujo sanguíneo renal y el transporte transtubular, para evitar hipoxia medular. El medio de contraste tiene efectos directos e indirectos sobre la fisiología renal; inicialmente produce disrupción de la microvasculatura y cambios hemodinámicos que conducen a vasoconstricción intrarrenal prolongada, aumento de la resistencia vascular, disminución del flujo sanguíneo y diuresis osmótica, incrementando el consumo de oxígeno local y generando hipoxia medular. Este efecto induce la formación de especies reactivas de oxígeno que disminuyen la cantidad de óxido nítrico, además, al mezclarse con el anión superóxido forman el más poderoso oxidante: el peroxi-nitrito, causando mayor daño de las células endoteliales. También se presenta una actividad incrementada de los vasoconstrictores renales (vasopresina, angiotensina II, dopamina, endotelina y adenosina) y una disminución de la actividad de los vasodilatadores renales (óxido nítrico y prostaglandinas). Por otra parte, la inyección de medio de contraste tiene efectos citotóxicos directos sobre el endotelio y las células tubulares renales: contracción celular, protrusión nuclear, fenestración de la capa endotelial, formación de microvellosidades en la membrana celular y apoptosis 3,5.
Las medidas de prevención son la mejor opción para todos los pacientes con factores de riesgo de desarrollar NIC. Se han propuesto diferentes estrategias que pueden interrumpir la fisiopatología de la NIC como el uso de: 1) fármacos con propiedades antioxidantes (N- acecetilcisteína (NAC), ácido ascórbico, vitamina E, estatinas, bicarbonato de sodio y teofilina), 2) vasodilatadores (prostaglandinas, dopamina y fenoldopam), 3) alcalinizantes (bicarbonato de sodio) y 4) la expansión del volumen intravascular con solución salina (SSN) 5,18,40. La utilidad de la expansión del espacio intravascular con SSN 0.9% radica en que el volumen bloquea el efecto vasoconstrictor del medio de contraste en la médula renal al suprimir la secreción de vasopresina, inhibe el sistema renina angiotensina aldosterona e incrementa la síntesis de prostaglandinas; por otra parte, atenúa los efectos tóxicos directos del contraste sobre las células epiteliales tubulares gracias a la disminución de la reabsorción tubular de sal y agua, que permite la dilución del líquido y menor viscosidad intratubular. El BS produce la alcalinización del líquido intratubular reduciendo la lesión por radicales hidroxilos, lo que supone un mayor beneficio que la SSN 0.9% 18.
Estudios pequeños aleatorizados han mostrado que la nefroprotección con BS iniciada una hora antes de la administración del medio de contraste, puede ser útil para evitar la NIC 41. Merten et al., fueron los primeros en reportar una importante reducción en el riesgo de NIC en pacientes hidratados con BS (1.7% vs 13.6% p= 0.02), sin embargo, fue un estudio en un único centro, con sólo 119 pacientes y que se terminó prematuramente sin justificación clara 8. Otro estudio retrospectivo realizado en 7,977 pacientes expuestos a medio de contraste realizado en la clínica Mayo Rochester no pudo confirmar este hallazgo inicial del efecto protector encontrado por Merten et al., y por el contrario encontró un incremento de NIC en los pacientes en quienes se administró BS 42. Varias revisiones sistemáticas y meta-análisis realizados al respecto, han mostrado que el BS fue beneficioso para evitar la NIC; sin embargo estos meta-análisis presentaron sesgos de publicación y una heterogeneidad significativa 11,12.
El principal resultado de nuestro meta-análisis donde se incluyeron 22 ensayos clínicos controlados, aleatorizados (n= 5,686 pacientes), es que la administración de BS en pacientes de alto riesgo, que fueron expuestos a medios de contraste, comparada con el uso de SSN 0.9%, no redujo la incidencia de NIC, la necesidad de terapia de reemplazo renal, la tasa de muerte, ni se encontró diferencia en los cambios de creatinina sérica luego de la aplicación del medio de contraste.
Cuando se analizaron todos los estudios, se encontró un efecto resumen a favor del uso del BS para prevención de NIC, hallazgo similar a lo reportado por otros metaanálisis 43-46, sin embargo muchos de estos estudios presentaron alto riesgo de sesgos; en muchos no se logró determinar la realización adecuada de la asignación aleatoria y ocultamiento de la secuencia, lo que puede llevar a un error sistemático intra y entre los estudios; adicionalmente en gran parte de ellos no se realizó cegamiento de los pacientes, los médicos o en los que evaluaron los desenlaces. Por el contrario cuando se analizaron solo los estudios con bajo riesgo de sesgos, este efecto protector del BS desaparece al igual que la heterogeneidad (DR= 0.00 IC 95%= -0.02-0.03; p= 0.83, I2= 0%) .
Otro de los objetivos de este estudio fue evaluar si el tipo de contraste utilizado podía influir en el efecto del bicarbonato sobre una potencial nefroprotección; al hacer el análisis de subgrupo no se encontró diferencias significativas al utilizar medio de contraste hipo-osmolar (DR= -0.03, IC 95%= -0.07-0.01, I2= 69%, p= <0.001) vs iso-osmolar (DR= -0.01, IC 95%= -0.06-0.03; I2= 72%, p= <0.001); esto coincide con estudios recientes, que también han fallado en demostrar una diferencia estadística en la incidencia de NIC después de la administración de medio iso-osmolar vs. medios de contraste de baja osmolaridad 38,47.
En el análisis de metaregresión se quiso evaluar si la cantidad de volumen de contraste usado tenía alguna relación con el potencial efecto protector del bicarbonato para evitar el desarrollo de NIC. En los estudios que reportaron esta variable no se logró establecer una relación directa cuando se administró BS, hallazgo diferente a lo reportado en la literatura donde se ha demostrado que el volumen del medio de contraste utilizado aumenta el riesgo de NIC 48; sin embargo se debe hacer la salvedad que los estudios que soportan dicha evidencia no aportan la mejor calidad metodológica posible. También se evaluó la asociación entre el antecedente de Diabetes Mellitus y el riesgo de NIC, encontrándose este como un factor de riesgo, con una relación estadísticamente significativa (p= 0.034).
En el presente estudio los desenlaces secundarios como muerte, requerimiento de TRR y cambios en el valor de creatinina, no tuvieron ninguna mejoría cuando se comparó el uso de BS vs SSN 0.9%; esto se puede deber al pequeño tamaño de sujetos incluidos en los ensayos, a la metodología empleada con un diseño y poder insuficientes para detectar estas diferencias y el seguimiento a corto plazo. Incluso al analizar los desenlaces de acuerdo a la calidad metodológica no se modifican los resultados.
Limitaciones del estudio
La principal limitación encontrada en este meta análisis fue la pobre calidad metodológica de mucho de los estudios incluidos, esto por problemas en cuanto a la aleatorización, el ocultamiento y el cegamiento de los grupos, aspectos que influyeron de manera negativa cuando se generó un estimador del efecto de los diferentes desenlaces.
Con respecto a los criterios de inclusión, la definición de enfermedad renal crónica fue muy heterogénea, además de sólo estar basado en el valor de creatinina y/o tasa de filtración glomerular, los puntos de corte para estas variables fueron muy amplios, sin tener en cuenta el género, la edad y la masa corporal. La mayoría de los ensayos incluidos en nuestro estudio, utilizaron la elevación de la creatinina dentro de las 48 h después de la exposición a medio de contraste como la definición de NIC, sin tener presente que la elevación de la creatinina sérica se puede presentar después de 4 a 5 días de la exposición y por tanto el efecto de los protocolos de hidratación pueden no ser bien estimados.
Otra limitante importante es la falta de uniformidad en la dosis y duración de las terapias con BS o SSN 0.9% entre los diferentes ensayos clínicos. De igual forma el volumen promedio de medio de contraste fue variable y en ninguno de los estudios se reportó el peso de los pacientes, para poder estimar la dosis por kilogramo de peso. Finalmente consideramos que estos resultados no pueden ser generalizables, por una parte se debe recordar que los pacientes incluidos en su mayoría eran pacientes llevados a procedimientos específicamente cardiacos y además el tamaño de muestra no permite dar el suficiente poder y el tiempo de seguimiento en todos los estudios fue muy corto.
Conclusiones
El presente meta-análisis de ensayos clínicos demuestra que la administración de BS no es superior al suministro de SSN 0.9%, solo o con el uso concomitante de NAC, en la prevención de NIC en pacientes con factores de riesgo para ERC expuestos a medio de contraste. Tampoco se evidencia un mayor efecto benéfico con ninguna de las dos intervenciones en términos de la reducción de mortalidad y el requerimiento de terapia de reemplazo renal. Estos resultados deben ser considerados en el contexto de la marcada heterogeneidad entre los diferentes ensayos. Se requiere por tanto la realización de nuevos estudios con mayor poder y protocolos mejor estandarizados, esto con el objetivo de realizar un meta-análisis con estudios con bajo riesgo de sesgos, lo cual permita determinar cuál es la intervención ideal para prevenir la nefropatía inducida por medio de contraste.