Introducción
El síndrome de Cushing es una entidad rara producida en la mayoría de los casos (luego de excluirse consumo exógeno de esteroides) por un tumor hipofisiario productor de ACTH 1. Sin embargo, en algunos casos es causado por enfermedades suprarrenales como un adenoma unilateral, un carcinoma adrenal o por una hiperplasia adrenal bilateral bien sea una enfermedad adrenocortical pigmentada nodular, también conocida como hiperplasia bilateral micronodular, o por una hiperplasia adrenal macronodular bilateral 2-4. El estándar de manejo en la etiología adrenal del síndrome de Cushing es la resección de las adrenales enfermas, es decir la adrenalectomía unilateral en el caso de un adenoma o la bilateral para las hiperplasias. Este último caso, implica una dependencia de glucocorticoides y mineralocorticoides exógenos de por vida. Ahora bien, hay pacientes con lesiones adrenales bilaterales en el contexto de hipertensión arterial, en quienes una adrenal está produciendo aldosterona, entidad conocida como hiperaldosteronismo primario por enfermedad de Conn y la otra adrenal simplemente tiene un adenoma no productor. En estos pacientes, con un hiperaldosteronismo claramente identificado hormonalmente y con una imagen de localización, se les realiza un cateterismo bilateral de venas suprarrenales con muestreo hormonal, buscando localizar la fuente de producción de aldosterona, que puede ser uni o bilateral independientemente de los hallazgos imagenológicos 5,6. Este procedimiento ha sido descrito muy raramente para diferenciar casos de síndrome de Cushing adrenal. En este reporte describimos el primer caso de cateterismo de venas suprarrenales para el estudio del síndrome de Cushing adrenal y presentamos una reseña sobre la hiperplasia adrenal bilateral como una causa infrecuente de esta enfermedad.
Reporte del caso
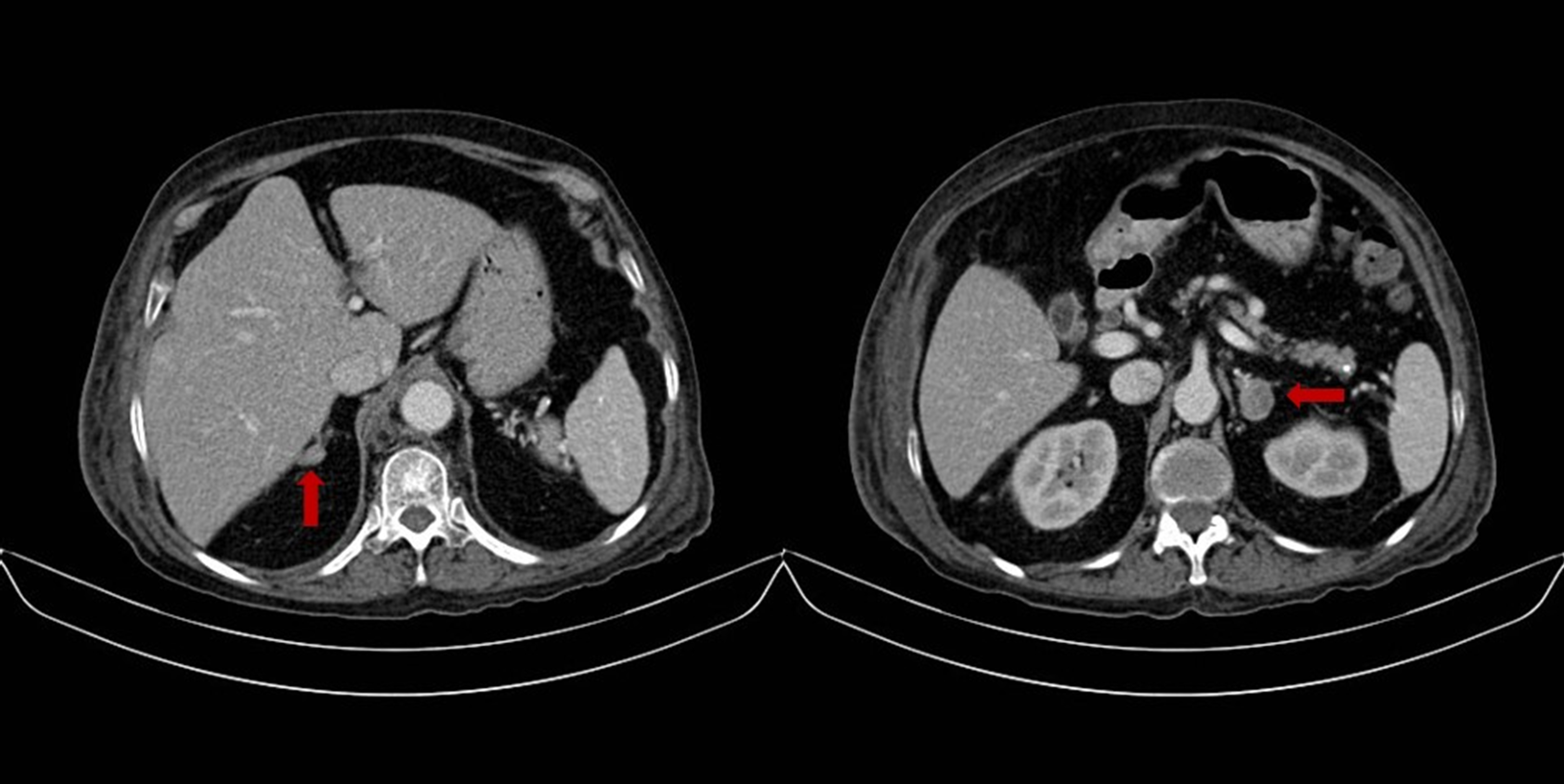
Paciente de 76 años con antecedente de hipertensión arterial controlada con 2 antihipertensivos (losartan y amlodipino) quien consultó por un cuadro clínico de pérdida de peso objetiva de 4 kg en dos meses, edema que progresó hasta la anasarca y dolor dorso-lumbar. Dentro de los estudios solicitados, se documenta en una tomografía de abdomen, un nódulo en la glándula adrenal derecha de 14x9 mm y en la glándula adrenal izquierda de 23x18 mm (Fig. 1), adicionalmente como causa del dolor lumbar se evidencian múltiples fracturas vertebrales desde la quinta vértebra cervical, en múltiples vértebras dorsales y en todas las vértebras lumbares. Como parte del estudio de los adenomas adrenales la paciente tenía un valor anormal de cortisol después de un test de supresión con bajas dosis de dexametasona (13.3 µg/dL, valor normal: <1.8 µg/dL), un valor de cortisol libre urinario normal y un nivel de potasio bajo (no se encontraba en tratamiento con diuréticos). Su examen físico aparte de los edemas era completamente normal sin signos clínicos que sugirieran hipercortisolismo. En la Tabla 1 se muestran los resultados de los principales paraclínicos de la paciente.
Figura 1.
Tomografía de abdomen. Nódulo en la glándula adrenal derecha de 14x9 mm y en la glándula adrenal izquierda de 23x18 mm
Se hizo un diagnóstico a la paciente de un hipercortisolismo independiente de hormona adrenocorticotropa (ACTH) y debido a que en la tomografía de abdomen se había documentado la presencia de dos lesiones, una en cada glándula, mayores de 10 mm, esto planteó un reto terapéutico ya que la resección de una sola de las glándulas podría no mejorar el hipercortisolismo en caso que la producción fuera bilateral y la resección de ambas glándulas en caso que la producción de cortisol proviniera de una sola de las adrenales resultaría en hipoadrenalismo permanente. Se decidió entonces realizar un muestreo venoso adrenal para tratar de determinar el origen de la producción de cortisol.
Se utilizó un protocolo descrito previamente 7 al cual se le realizaron algunas modificaciones, los autores proponen la medición de epinefrina como método para determinar la adecuada localización de los catéteres al momento de tomar la muestra, debido a que en nuestro medio no disponemos de medición de catecolaminas plasmáticas esta comprobación se realizó mediante la documentación radiográfica por venografía de la punta del catéter y se realizó medición de aldosterona para realizar las correcciones en la dilución que existen entre ambos lados 2. Se tomaron muestras de ambas venas adrenales y de la vena cava inferior (el procedimiento se muestra en la Figura 2 y los resultados se muestran en la Tabla 2). Basados en el modelo de interpretación del muestreo venoso adrenal propuesto por Young 3 se interpretó que la paciente cursaba con una hiperplasia adrenal con predominio en la producción de cortisol del lado derecho, se discutió con la pacientes y con el grupo quirúrgico el caso y se decidió entonces realizar una adrenalectomía bilateral. La paciente no presentó ninguna complicación posoperatoria y recibió terapia de reemplazo con hidrocortisona 50 mg cada 8 h durante las primeras 48 h y posteriormente recibió prednisolona 10 mg y fludrocortisona 0.1 mg como reemplazo con resolución de la hipokalemia. El resultado del estudio histológico de las glándulas fue compatible con una hiperplasia adrenal bilateral macro nodular.
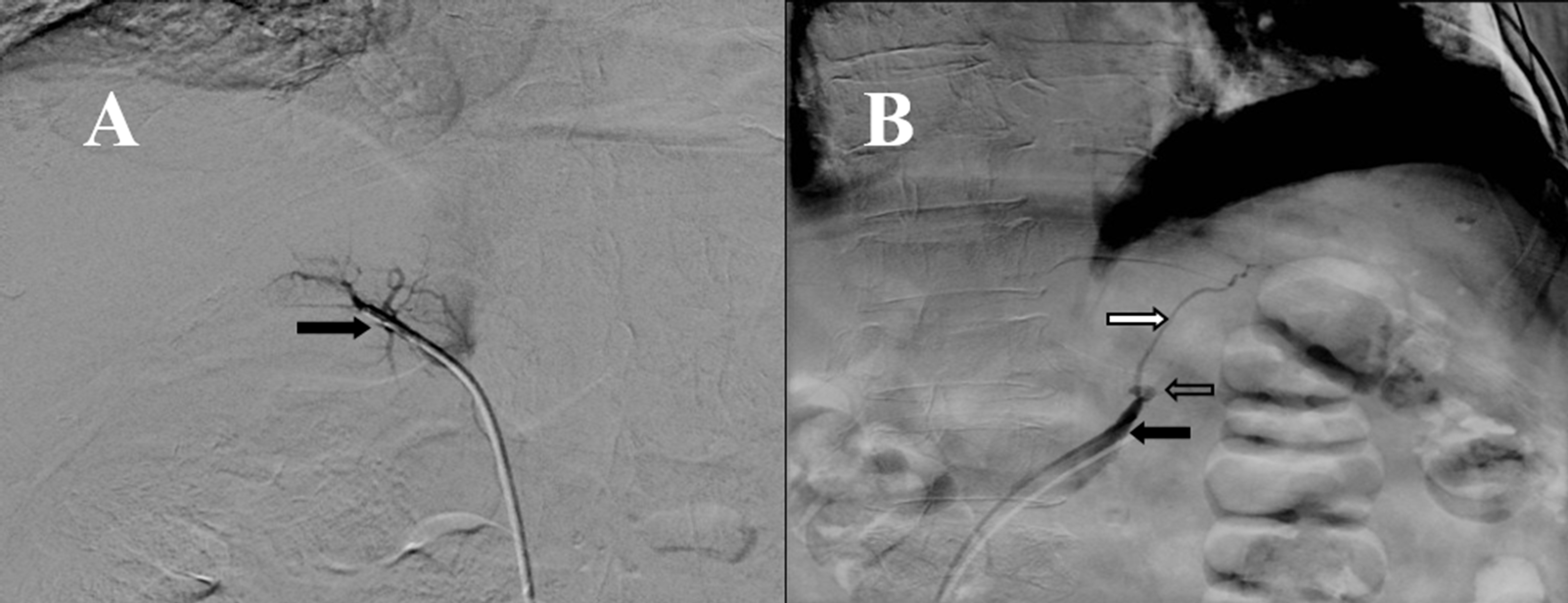
Figura 2.
Cateterismo de venas adrenales. A: Tronco común adrenal en donde confluyen la vena adrenal izquierda y la vena frénica inferior, que desembocan a la vena renal izquierda. B: Vena adrenal derecha con patrón glandular clásico, en donde se aprecia una vena adrenal central y ramas glandulares que confluyen hacia esta.
Discusión
La hiperplasia macro nodular bilateral (HAMB) o hiperplasia adrenal macro nodular bilateral ACTH independiente, es una de las causas menos frecuentes de hipercortisolismo y su verdadera frecuencia no ha sido establecida, aunque menos del 2% de todos los casos de hipercortisolismo se explican por alguna forma de hiperplasia adrenal bilateral bien sea macro o micro nodular 4. La HAMB se presenta generalmente con lesiones bilaterales mayores a los 10 mm y de manera predominante en las mujeres, generalmente su aparición es un poco más tardía al compararla con otras formas de hipercortisolismo 8 (generalmente después de la quinta década de la vida) y las manifestaciones clínicas generalmente son las de una hipersecreción autónoma subclínica de glucocorticoides o síndrome de Cushing subclínico (SCS), nuestra paciente cumplía con los dos criterios propuestos para hacer el diagnóstico de esta entidad 9. El SCS supone un reto diagnóstico debido a las pocas manifestaciones clínicas características de esta condición, las pequeñas elevaciones ocasionales del cortisol y la cantidad de pruebas disponibles y los diferentes puntos de corte propuestos por diferentes autores para las diferentes pruebas y la falta de especificidad en las características radiológicas que pueden presentarse en condiciones diferentes a la HAMB como metástasis adrenales. Nuestra paciente presentaba perdida del ritmo circadiano en la producción del cortisol evidenciado por valores elevados de cortisol a las 23:00 h y autonomía en la producción demostrado por los valores de ACTH y el test de supresión con bajas dosis de dexametasona. Y como ha sido reportado por otros autores el cortisol libre urinario tiene un pobre rendimiento diagnostico en los pacientes con SCS, nuestra paciente tenía niveles en varias mediciones completamente normales 10.
El muestreo venoso adrenal (AVS) se utiliza principalmente para el estudio de pacientes con hiperaldosteronismo primario y en este contexto inclusive en centros con alto volumen de pacientes y amplia experiencia en el procedimiento es exitoso solo en el 70-90% de los casos 6. El uso del AVS en el estudio de hipercortisolismo es poco frecuente probablemente debido a la rareza de los casos en los cuales se presenta secreción de cortisol en nódulos bilaterales, pero puede ser una prueba de gran utilidad en este grupo de pacientes. Se ha propuesto que algunos pacientes podrían ser tratados con una adrenalectomía unilateral ya que la producción de cortisol podría estar relacionada con el tamaño del adenoma 11. Pero en el caso de nuestra paciente el cateterismo reveló algo completamente distinto, el nódulo de la glándula adrenal izquierda era mucho más grande pero la producción de cortisol provenía de manera predominante del nódulo localizado en la glándula adrenal derecha, si bien se ha descrito que el 85% de las personas pueden presentar una producción de cortisol aumentado en la glándula adrenal derecha los valores de la paciente superaban el gradiente descrito 5.
Basado en lo anterior se decidió realizar la extracción de ambas glándulas adrenales y el resultado de la patología confirmó el diagnóstico de una hiperplasia macro nodular bilateral.
Conclusión
Hasta donde conocemos este es el primer caso que se reporta de utilización de AVS en un paciente con hipercortisolismo con adenomas adrenales bilaterales en nuestro país.
Al procedimiento que se encuentra reportado en la literatura se le realizaron algunas modificaciones qué ya han sido propuestas por otros autores, dada la dificultad que tenemos en nuestro medio con la medición de las catecolaminas se optó por realizar la verificación del adecuado posicionamiento de la punta del catéter mediante la imagen de la venografía y para corregir la diferencia por dilución se utilizó la medición de aldosterona, el diagnóstico bioquímico fue corroborado por el diagnóstico histológico lo cual nos permite concluir que la verificación por venografía fue adecuada.
Esta técnica permitió realizar el diagnóstico acertado y evitó la necesidad de re-intervención de la paciente en caso que hubiéramos guiado el tratamiento basado en el tamaño glandular.

