Introducción
La nefritis lúpica (NL) es la principal causa de morbilidad y mortalidad en los pacientes con lupus eritematoso sistémico (LES), presentándose en más de la mitad de los pacientes y siendo más común en hispanos y afrodescendientes 1,2. A pesar de los avances en el tratamiento, 10-22% de los pacientes con NL progresan a enfermedad renal crónica terminal (ERCT) en los primeros diez años de enfermedad 3-5. En el año 2010, según el registro anual realizado en Estados Unidos, los pacientes con NL representaron el 1.8% de los pacientes con ERCT que requirieron terapia de remplazo renal (TRR) 6,7. En un estudio realizado en Medellín-Colombia se encontró una incidencia del 77% de NL en el primer año de evolución del LES 8.
Los pacientes con ERCT secundaria a NL son generalmente más jóvenes que aquellos con ERCT por otras causas (35 años vs 47 años respectivamente) 9, por lo que el trasplante renal (TR) debe ser considerado como la terapia de elección para estos pacientes 1,3 4,10 . El TR ha sido realizado exitosamente en los pacientes con ERCT secundaria a LES desde 1959 11 . Sin embargo, la pérdida del injerto y el riesgo de recurrencia de la NL después del TR tiene reportes con incidencias muy variables 12-16.
Con respecto a la supervivencia del injerto y del paciente, diferentes grupos han mostrado tasas de éxito similar en pacientes trasplantados con ERCT secundaria a LES y los trasplantados por otras causas 17-20; sin embargo, hasta la fecha, no hay estudios que los comparen en forma simultánea con grupos con excelente pronóstico luego del trasplante, como son los pacientes con enfermedad renal poliquística (ERPQ) y otro grupo con peor pronóstico, como la población con nefropatía diabética (ND) 19-23. Este estudio tiene como objetivo principal evaluar la supervivencia del injerto y del paciente, en los pacientes trasplantados renales con diagnóstico de ERCT secundaria a NL y compararlos con un grupo de pacientes trasplantados renales con ERCT secundaria a ND y ERPQ, entidades asociadas al peor y mejor pronóstico respectivamente luego del TR.
Materiales y Métodos
Estudio descriptivo, retrospectivo, realizado en pacientes mayores de 18 años, con diagnóstico de ERCT por NL, ND y ERPQ, quienes fueron sometidos a TR entre los años 2005 y 2013 en el Hospital Pablo Tobón Uribe (HPTU) de Medellín-Colombia. Se excluyeron los pacientes menores de 18 años, los trasplantes simultáneos y los pacientes con pérdida de seguimiento.
Las variables clínicas evaluadas en los tres grupos fueron: sexo, edad, raza, tipo de diálisis, tiempo en diálisis previo al trasplante, comorbilidades asociadas, tipo de donante, número de incompatibilidades HLA, tiempo de isquemia fría, terapia de inducción e inmunosupresión utilizada. Como desenlaces principales se evaluó la supervivencia del paciente y del injerto; otros desenlaces evaluados fueron los valores de creatinina basal y la tasa de filtración glomerular (TFG) medida por CKD-EPI, al mes, seis meses, un año, tres años y al último seguimiento reportado; las complicaciones presentadas posterior a la realización del TR tales como disfunción del injerto, complicaciones quirúrgicas, infecciosas, cardiovasculares, metabólicas y neoplásicas; los tipos de rechazo del injerto confirmados por biopsia y finalmente la mortalidad con sus causas. Para todo lo anterior se tomaron las historias clínicas del servicio de trasplante renal del HPTU y se construyó una base de datos en Excel. El protocolo fue aprobado por el comité de ética del HPTU.
Se utilizó para el análisis estadístico el software SPSS versión 18; para las variables cualitativas se calcularon frecuencias, tasas (%/persona-año) y proporciones; las variables cuantitativas se describieron como medias o medianas con su respectiva desviación estándar o percentiles (p25-75), según la distribución de los datos identificados por la prueba de Shapiro Wills; para las comparaciones entre las variables cuantitativas y el desenlace se utilizó la prueba de ANOVA en las variables que cumplieron supuesto de normalidad y la prueba de Kruskall Wallis en las variables que no lo cumplieron; para las variables cualitativas se usó la prueba Chi cuadrado con un nivel de significancia de 0.05. La supervivencia del injerto y del paciente se calculó utilizando el método de Kaplan Meier; se ajustó además de acuerdo a la etiología de la ERCT (NL, ND, ERPQ) y se verificó su significancia estadística por medio del test long-rank; por último se hizo análisis de supervivencia multivariado por medio de regresión de COX, para buscar factores de riesgo o protectores involucrados en la supervivencia del injerto renal.
Resultados
Durante el período 2005-2013 se realizaron 642 trasplantes de riñón en el HPTU. De estos, 144 tenían diagnósticos de NL, ERPQ o ND como causa de la ERCT: 29 con NL (4.52%); 37 por ERPQ (5.76%) y 78 ND (12.15%). Ocho pacientes fueron excluidos, 2 por ser trasplante simultáneo hígado-riñón y 6 por pérdida en el seguimiento, quedando 136 pacientes distribuidos así: 78 (57.4%) ND, 31 (22.8%) ERPQ y 27 (19.9%) LES.
Las características demográficas de los tres grupos se muestran en la Tabla 1. El 59.6% eran hombres; 6.9% fueron de raza negra; la edad al momento del trasplante tuvo una mediana de 51 años (p25-75: 40.2-57); 61,7% estaban previamente en hemodiálisis, 26.5% en diálisis peritoneal y 11.8% pacientes no se encontraban en terapia dialítica previo al trasplante. El tiempo en diálisis tuvo una mediana de 13 meses (p25-75: 7-31 meses) y el tiempo en lista de espera previo al trasplante tuvo una mediana de seis meses (p25-75: 3-10 meses). 99.3% de los trasplantes fueron de donante fallecido; 130 (95.6%) recibieron terapia inductora; la cual fue Alemtuzumab en 83 pacientes (61.5%), Basiliximab en 20 (14.8%), Daclizumab en 10 (7.4%) y Timoglobulina en 17 (12.6%). El protocolo de inmunosupresión más frecuentemente utilizado fue el ciclosporina-micofenolato-prednisolona en 47 (34.6%), seguido de tacrolimus-micofenolato-prednisolona en 32 (23.5%), ciclosporina-azatriopina-prednisolona 26 (19.1%) y ciclosporina-prednisolona en 11 (8.1%) (Tabla 1). Al evaluar por grupos, se encontró mayor proporción de hombres con ERCT por ND y ERPQ, mientras que predominaron las mujeres en la ERCT por LES (p <0.01); los diabéticos eran significativamente de mayor edad y tenían mayor incidencia de enfermedad coronaria y enfermedad arterial oclusiva crónica al compararlo con los de NL y ERPQ (Tabla 1).
| Variable* | Lupus (n= 27) | Enfermedad poliquística (n= 31) | Diabetes (n= 78) | Valor de p |
|---|---|---|---|---|
| Mujeres | 24 (88.8) | 13 (41.9) | 18 (23.1) | <0.01 (a) |
| Edad Media (DE) en años | 32.54 (8.52) | 48.62 (8.15) | 52.75 (9.45) | <0.05 (b) |
| Raza negra vs no negra | ||||
| Raza negra | 2 (7.4) | 1 (3.2) | 7 (9) | 0.58 (a) |
| Raza no negra | 25 (92.6) | 30 (96.8) | 71 (91) | |
| Insuficiencia cardíaca congestiva | 2 (7.4) | 1 (3.2) | 3 (3.8) | 0.69 (a) |
| Enfermedad coronaria | 0 | 0 | 8 (10.2) | 0.04 (a) |
| Hipertensión arterial | 25 (92.6) | 28 (90.3) | 77 (98.7) | 0.11 (a) |
| Enfermedad cerebrovascular | 0 | 1 (3.2) | 2 (2.6) | 0.67 (a) |
| Enfermedad arterial oclusiva crónica | 0 | 0 | 13 (16.7) | <0.01 (a) |
| Tiempo en lista de espera mediana (p25-75) meses | 6 (3-10) | 6 (4-10) | 6.5 (3.25-12) | 0.95 (c) |
| Tiempo en diálisis previo al trasplante mediana (p25-75) meses | 20 (7.75-39.75) | 12 (2-22.5) | 14.5 (7.25-27.5) | 0.19 (c) |
| Tiempo de isquemia fría mediana (p25-75) horas | 12 (9.75-16) | 15 (11-20) | 15.75 (13-20.75) | 0.04 (c) |
| Incompatibilidad HLA-DR | ||||
| Incompatibilidad DR igual a 0 | 4 (14.8) | 2 (6.4) | 5 (6.4) | 0.10 (a) |
| Incompatibilidad DR igual a 1 | 10 (37) | 16 (51.6) | 49 (62.8) | |
| Incompatibilidad DR igual a 2 | 13 (50) | 13 (48.1) | 24 (30.8) | |
| Uso de terapia inductora | 27 (100) | 29 (93.5) | 74 (94.9) | 0.44 (a) |
| Tipo de terapia inductora utilizada | ||||
| Uso de Alemtuzumab | 23 (85.2) | 21 (67.74) | 39 (50) | 0.12 (a) |
| Uso de Basiliximab | 2 (7.4) | 3 (9.6) | 15 (19.2) | |
| Uso de daclizumab | 0 | 2 (6.4) | 8 (10.2) | |
| Uso de thymoglobulin | 2 (7.4) | 3 (9.67) | 12 (15.4) | |
| No inducción | 0 | 2 (6.4) | 4 (5.1) | |
| Tipo de terapia de mantenimiento utilizada | ||||
| Terapia inmunosupresora Cyc-MMF-Pred | 7 (26.9) | 15 (48.4) | 25 (32.1) | 0.016 (a) |
| Terapia inmunosupresora Tac-MMF-Pred | 6 (22.2) | 9 (29) | 17 (21.8) | |
| Terapia inmunosupresora Tac-Aza-Pred | 3 (11.5) | 0 | 6 (7.7) | |
| Terapia inmunosupresora Cyc-Pred | 2 (7.7) | 2 (6.5) | 7 (9) | |
| Terapia inmunosupresora Cyc-Aza-Pred | 2 (7.7) | 5 (16.1) | 19 (24.4) | |
| Terapia inmunosupresora Cyc-Eve-Pred | 1 (3.8) | 0 | 2 (2.6) | |
| Terapia inmunosupresora MMF-Syr-Pred | 5 (19.2) | 0 | 1 (1.3) | |
| Terapia inmunosupresora MMF-Eve-Pred | 1 (3.8) | 0 | 0 | |
| Terapia inmunosupresora Tac-Eve-Pred | 0 | 0 | 1 (1.3) | |
| *numero (%) El valor de p reportado es con base a la comparación de los tres grupos de enfermedad DR= HLA-DR; Cyc= cyclosporina; Aza= azathioprine; MMF= mycophenolate; Tac= tacrolimus; Pred= prednisolone, Eve, everolimus, Syr= sirolimus; GFR= Tasa de filtración glomerular, DE= Desviación estandard a. (a) Chi2 de pearson b. (b) Anova de un factor c. (c) Prueba Kruskall Wallis |
||||
Supervivencia
Durante el seguimiento murieron 18 pacientes (tasa de 3.9%/persona-año). El mayor número de muertes se encontró en el grupo de ERCT por ND con 13 pacientes (tasa de 5.5%/persona-año), donde la principal causa de muerte fue de origen cardiovascular en nueve pacientes, seguida de las infecciosas en tres pacientes y neoplasia en una paciente. En el grupo de NL fallecieron dos pacientes (tasa de 1.9%/persona-año): los dos por causa infecciosa. En los pacientes con ERPQ fallecieron tres pacientes (tasa de 2.5%/persona-año), una muerte de origen cardiovascular y dos infecciones; la mortalidad con injerto funcional se presentó en 11 pacientes (tasa de 2.4%/persona-año).
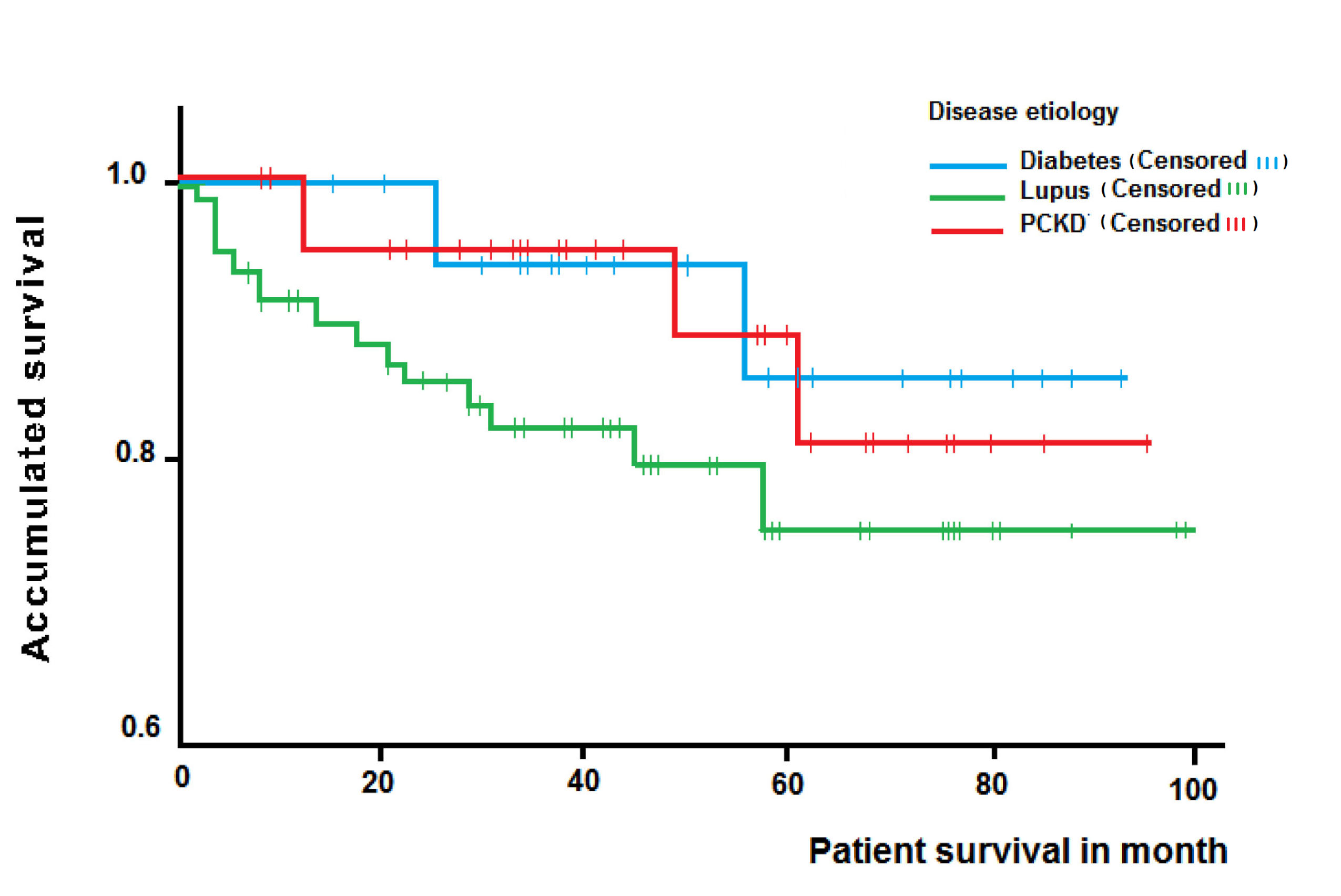
La supervivencia global del paciente a uno, tres y cinco años fue del 94.4%, 88.5% y 79.6% respectivamente; en el análisis de subgrupos, la supervivencia del paciente a uno, tres y cinco años fue del 100%, 87.5% y 87.5% en NL; 96.4%, 96.4% y 81.8% en ERPQ; 91.7%, 82.4% y 75.7% en ND; no se encontraron diferencias significativas en el tiempo de supervivencia del paciente agrupado por enfermedad (Long-rank test= 0.52) (Fig. 1).
Figura 1.
Curva de supervivencia de Kaplan-Meier de los pacientes trasplantados, por etiología de la enfermedad renal crónica terminal.
Al final del seguimiento se presentaron 26 pérdidas del injerto (tasa de 5.9%/persona-año), las cuales fueron secundarias a muerte en 18 pacientes, rechazo agudo en dos, infecciones en dos, nefropatía crónica del injerto en tres y complicaciones vasculares en uno.
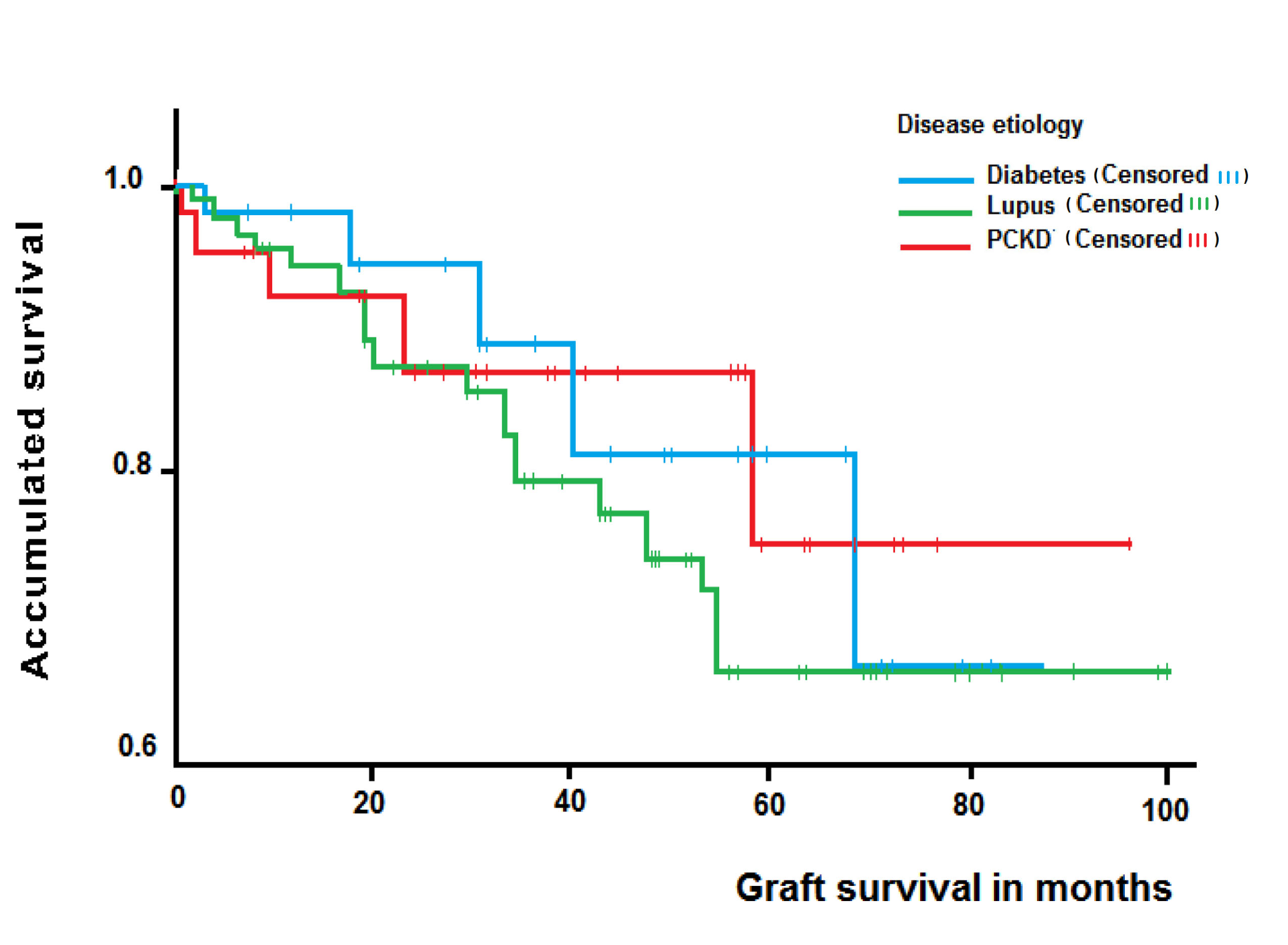
La supervivencia global del injerto censurada por muerte a uno, tres y cinco años fue de 93.3%, 86.9% y 70.8% respectivamente; en el análisis de subgrupos según etiología de la enfermedad, la supervivencia del injerto a uno, tres y cinco años fue de 96.3%, 82.5% y 82.5% en NL, 90%, 86% y 76.5% en ERPQ y 91.7%, 80.3% y 67.9% en ND, sin encontrar diferencias significativas (long rank test= 0.488) (Fig. 2).
Figura 2.
Curva de Supervivencia de Kaplan Meier del injerto de los pacientes por etiología de la enfermedad renal crónica terminal.
Se realizó un modelo de regresión de Cox ajustado por las variables que fueron significativas en el análisis univariado y por los factores de riesgo reportados previamente en la literatura. En la Tabla 2, se muestran las variables que se asocian con la supervivencia del injerto; sólo se encontró que la raza negra (Hazard Ratio= 9.1, IC 95%= 2.67-31.1) y el antecedente de rechazo del injerto (Hazard Ratio de 3.97, IC 95%= 1.76-8.94), se asocian con menor supervivencia del injerto. La etiología de la ERCT no fue un factor de riesgo para la disminución del tiempo de supervivencia del injerto (Hazard Ratio= 1.43, IC 95%= 0.52-3.93).
| Variables | HR | EE | p | IC 95% |
|---|---|---|---|---|
| Incompatibilidad HLA-DR igual a 1 | 1.28 | 1.06 | 0.814 | 0.16-10.29 |
| Incompatibilidad HLA-DR igual a 2 | 1.03 | 1.08 | 0.977 | 0.12-8.58 |
| Tiempo de isquemia fría | 1.01 | 0.04 | 0.821 | 0.93-1.09 |
| Raza | 9.11 | 0.63 | 0.000 | 2.67-31.11 |
| Rechazo del injerto renal | 3.97 | 0.41 | 0.001 | 1.76-8.94 |
| Diagnóstico lupus vs no Lupus | 1.43 | 0.52 | 0.489 | 0.52-3.93 |
| Log likelihood= 209.026. LR Chi-cuadrado= 31.4 HR= Hazard Ratio; EE= Error estandard; IC= Intervalo de confidenza; DR: HLA DR |
||||
Evolución de la función del injerto renal
Se evaluó la tasa de filtración glomerular (TFG) medida por CKD-EPI, al mes, seis meses, un año, tres años y el último valor registrado en el seguimiento; no se encontraron diferencias significativas entre los tres grupos (NL, ERPQ, ND) (Fig. 3).
Figura 3.
Tasa de filtración glomerular durante el seguimiento según etiología de la enfermedad renal crónica terminal. Note que el tiempo en el axis x no presenta proporcionalidad, la figura muestra la tendencia de disminución de creatinina
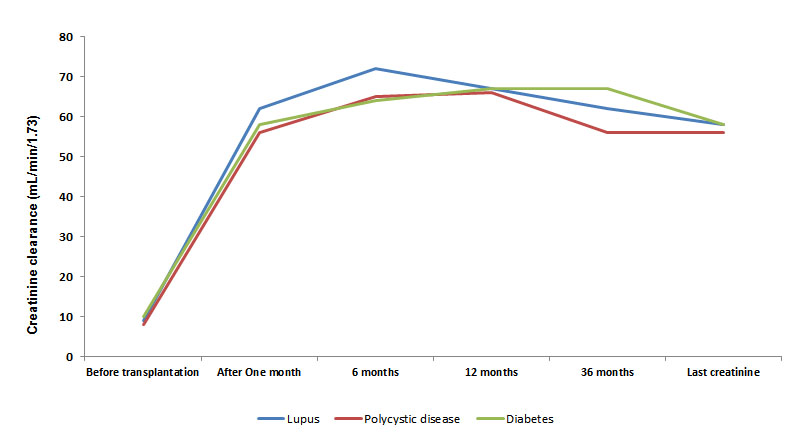
La TFG por CKD-EPI a los tres años de seguimiento tuvo una mediana de 62 mL/min/1.73 (DE 19.4) en los pacientes con NL, 56.4 mL/min/1.73 (DE 20.8) en ERPQ y 66.9 mL/min/1.73 (DE 18.16) en ND (p= 0.17) (Fig. 3). Sólo se presentó un caso de recurrencia confirmada por biopsia de NL en los pacientes trasplantados renales con diagnóstico de NL (tasa de 0.94%/persona-año).
Complicaciones
En la Tabla 3, se encuentran las principales complicaciones agrupadas por etiología de la ERCT. Las complicaciones más frecuentemente encontradas fueron la infección urinaria, la infección por citomegalovirus, y la función retardada del injerto; al agrupar por etiología de la ERCT, solo se encontraron diferencias estadísticamente significativas con la trombosis del injerto que fue mayor en ERPQ, infección de la herida quirúrgica e infección por CMV que fue mayor en ND e infecciones urinarias que fueron más frecuentes en la NL. El infarto agudo de miocardio se presentó más en el grupo con diagnóstico de ND.
| Variables* | Lupus (n= 27) | Enfermedad poliquística (n= 31) | Diabetes (n= 78) |
|---|---|---|---|
| Función retardada del injerto renal | 1 (0.94) | 4 (3.32) | 10 (4.23) |
| Trombosis del injerto | 0 (0) | 2 (1.66) | 0 (0) |
| Fístula | 1 (0.94) | 3 (2.48) | 2 (0.85) |
| Necrosis ureteral | 1 (0.94) | 1 (0.83) | 1 (0.42) |
| Infección de la herida quirúrgica | 0 | 1 (0.83) | 10 (4.23) |
| Infección por CMV | 3 (2.82) | 4 (3.32) | 15 (6.35) |
| Infecciones urinarias | 19 (17.87) | 17 (14.10) | 33 (13.97) |
| Tuberculosis | 1 (0.94) | 1 (0.83) | 3 (1.27) |
| Infarto agudo de miocardio | 1 (0.94) | 0 (0) | 5 (2.12) |
| Enfermedad cerebrovascular | 0 (0) | 1 (0.83) | 3 (1.27) |
| Enfermedad tumoral | 0 (0) | 1 (0.83) | 1 (0.42) |
| Pérdida del injerto | 5 (4.70) | 5 (4.15) | 16 (6.77) |
| Rechazo agudo confirmado por biopsia | 10 (9.40) | 8 (6.63) | 16 (6.77) |
| Mortalidad | 2 (1.88) | 3 (2.48) | 13 (5.50) |
| *n (tasas:% person-year) CMV: citomegalovirus |
|||
El rechazo confirmado por biopsia renal se presentó en 34 (tasa de 7.3%/persona-año) pacientes, sin encontrar diferencias en el número de rechazos agrupado por etiología de la ERCT (p= 0.23). Con respecto a la pérdida del injerto, esta se presentó en cinco pacientes con diagnóstico de NL (tasa de 4.7%/persona-año) (dos pacientes por rechazo agudo y los tres restantes por nefropatía crónica del trasplante); en el grupo de pacientes con diagnóstico de ND se presentaron 16 pérdidas del injerto (tasa de 6.8%/persona-año) (13 por muerte, dos por infección, y uno por rechazo agudo); en cuanto al grupo de ERPQ las pérdidas del injerto se presentaron en cinco pacientes (tasa de 4.2%/persona-año) (una por rechazo agudo, otro por causa vascular y tres por muerte).
Discusión
Este estudio fue realizado en un solo centro de trasplante renal de la ciudad de Medellín y tuvo como finalidad evaluar la supervivencia del paciente y del injerto en una población de trasplantados renales con ERCT por NL y compararlo con dos grupos de pacientes trasplantados con diagnóstico de ERPQ y ND. Como hallazgo principal no se encontró diferencias estadísticamente significativas en la supervivencia del paciente o del injerto entre los tres grupos evaluados (ND, NL y ERPQ).
Se utilizó como grupo comparador los pacientes con ERCT por ND, ya que estos pacientes por sus comorbilidades, tienen un peor pronóstico con respecto a la población trasplantada renal por otras causas, con una menor supervivencia del injerto, mayor incidencia de eventos cardiovasculares y una mortalidad precoz 19,20,22,24. El segundo grupo comparador utilizado fueron los pacientes con ERCT por ERPQ, en quienes el compromiso sistémico y las comorbilidades son menores y por lo cual el número de complicaciones es bajo y la tasa de supervivencia del injerto y del paciente es mucho mejor o al menos similar al compararlos con grupos controles 25-30.
Nuestros resultados son similares a los reportados por otros estudios, donde las tasas de supervivencia del injerto y del paciente con diagnóstico de ERCT por NL son comparables a la de los pacientes no lúpicos 14,31; Mojcik CF et al.., reportaron que la supervivencia del paciente y del injerto después del trasplante renal por NL fueron de 87.4% y 63.1% respectivamente 4; Bumgardneret al.., mostraron que no hubo diferencias en pacientes trasplantados con ERCT por NL y los trasplantados por otras causas 14; Ponticelli et al.., realizaron un estudio en 32 pacientes trasplantados renales con diagnóstico de NL, reportando una supervivencia del paciente a diez años del 96% vs 91% en los controles y del injerto del 77% en NL vs 78% en los controles 11; Fuentes et al., realizaron un estudio en 94 pacientes trasplantados renales con diagnóstico de NL vs un grupo de pacientes con ERCT secundaria a ND, encontrando que la curva de supervivencia del injerto a cinco años fue similar entre los dos grupos 32. Sin embargo otros estudios han encontrado peores resultados en la supervivencia del injerto de los pacientes con NL 33.34. Ward et al., utilizaron datos del United States Renal Data System (USRDS) encontrando que el riesgo de pérdida del injerto luego de ajustar por factores de confusión no incrementó en los pacientes con NL (HR 1.08; IC 95% 0.94-1.23 p=0.28) 35. Stone et al., reportó una supervivencia del injerto en pacientes trasplantados renales con diagnóstico de NL a 1, 2, 5 y 10 años de 81.7%, 74.7%, 45.9% y 18.5% vs trasplantados renales por ERCT secundaria a otras causas de 88.2%, 84.4%, 45.9 y 34.8% respectivamente; el 49.1% de los pacientes con NL y el 34.9% de los controles perdieron sus injerto 33,36,37.
Con respecto al grupo de ERPQ, nosotros no encontramos diferencias significativas en los desenlaces frente a los dos grupos comparadores; sin embargo, Jhonston et al., en el año 2005 reportaron una supervivencia del injerto renal a uno, cinco y diez años del 88.2%, 79.1% y 54.3% respectivamente en los pacientes con ERPQ vs 85.5%, 68.1% y 48.6% en los controles, diferencias que fueron significativas a favor de ERPQ 38; Jacquet et al. realizaron un estudio de 534 pacientes TR con ERPQ comparados con 4,779 TR por otras causas, encontrando que la supervivencia del paciente fue similar en ambos grupos (ERPQ vs no ERPQ): 93.4% vs 93.4% a cinco años, 87.4% vs 87.2% a diez años y 78.7% vs 82.4% a 15 años (p= 0.464); sin embargo la supervivencia del injerto censurada por muerte fue mejor en el grupo de ERPQ (90.4% vs 86.9% a cinco años; 81.1% vs 75.4% a diez años y 76% vs 66% a 15 años p= 0.0187) 26.
En nuestro estudio la supervivencia del paciente fue menor en la población con ND al compararlos con NL y ERPQ (supervivencia a tres años fue de 75.5% en ND Vs 87.5% en NL y 81.8% en ERPQ), sin embargo esta diferencia no fue estadísticamente significativa, lo cual explicamos posiblemente por el pequeño tamaño de muestra en la población con NL y ERPQ. Está tendencia a mayor mortalidad se explica porque en la población analizada, los pacientes diabéticos eran de mayor edad y con mass comorbilidades cardiovasculares (enfermedad coronaria y enfermedad arterial oclusiva crónica), lo cual los pone en mayor riesgo de complicaciones cardiovasculares y muerte. Estudios previos también han mostrado que los pacientes diabéticos experimentan mayor riesgo cardiovascular y mayor mortalidad 24; Rocha et al., realizaron un estudio en 62 pacientes diabéticos trasplantados renales vs 62 pacientes no diabéticos con un tiempo promedio de seguimiento de 102 meses, encontrando que la supervivencia del paciente a cinco y diez años fue de 60% y 50% para diabéticos y 96% y 84% para pacientes no diabéticos respectivamente (p <0.001) 24. Cosio et al., evaluaron el impacto de la diabetes mellitus en la morbilidad y mortalidad post trasplante, ellos encontraron disminución de la supervivencia y una mayor incidencia de eventos cardiovasculares, siendo esto la causa principal de muerte en esta población con una incidencia de 61 vs 26% al compararlo con población no diabética, además ellos observaron un aumento de la mortalidad asociada con infecciones 23,29.
En el pasado la ERCT secundaria a NL se consideró una contraindicación para el TR, porque se pensaba que existía una alta probabilidad de recurrencia en la enfermedad y mayor morbilidad. Este punto de vista cambió hace aproximadamente 30 años después de conocer reportes que lograron demostrar que los pacientes con ERCT por NL sometidos a TR tenían una tasa de supervivencia similar a los pacientes trasplantados por otras causas. Desde entonces el TR ha sido considerado un tratamiento aceptado para los pacientes con NL y ERCT 40-43. No obstante aún hoy, el pronóstico a largo plazo y la tasa de recurrencia de la nefritis continúan siendo tema de controversia, con porcentajes de recurrencias reportados entre el 0 al 30% en diferentes series 10,12,15,43-45. En nuestro estudio, la recurrencia de la NL lúpica fue muy baja (3.8%), sin embargo puede existir un subregistro, ya que en nuestro grupo no se realiza biopsia por protocolo 4,11. Tung et al., evaluaron 32 pacientes trasplantados renales con diagnóstico de NL, encontrando que la recurrencia de NL fue del 26.1%, sin embargo el 50% fue clase 1, y no tuvo un impacto negativo en la supervivencia del injerto 12.
En nuestra serie se analizaron además algunas variables que han sido reportadas previamente como factores de riesgo para la supervivencia del injerto; al realizar un modelo de regresión de Cox, se encontró que el antecedente de rechazo agudo y la raza negra fueron los únicos factores de riesgo asociados a disminución de la supervivencia del injerto. Por el contrario factores como la edad, número de incompatibilidades HLA, tiempo en diálisis, tiempo de isquemia fría, tipo de tratamiento inmunosupresor y enfermedad causante de la ERCT (NL, ERPQ y ND) no influyeron en la supervivencia del injerto. Estudios previos también han reportado que el rechazo es un factor de riesgo importante para pérdida del injerto ya que la activación de las células T llevan a una respuesta inflamatoria que en el tiempo deteriora la función del injerto renal 15.
Con respecto a la raza, estudios previos sugieren que la raza negra es un factor de riesgo para progresión de la enfermedad renal y menor respuesta a la terapia inmunosupresora 45; esto hace que los afroamericanos tengan mayor riesgo de rechazo 6 sin embargo estudios previos como el de Contreras et al., donde se compararon pacientes con TR afroamericanos vs caucásicos con diagnóstico de NL, mostraron que al ajustar por otras variables, la raza no fue un factor predictor de pérdida del injerto 45; Nee et al.., evaluaron 4,214 pacientes trasplantados renales con diagnóstico de NL y evaluaron la supervivencia del injerto de acuerdo a la raza afroamericana vs otras razas, ellos encontraron un riesgo de pérdida del injerto y muerte mayor en la raza afroamericana incluso ajustado a algunas variables como ingresos económicos 6. En nuestro estudio la raza negra fue un factor de riesgo para menor supervivencia del injerto, sin embargo la población de raza negra fue la minoría como para dar conclusiones definitivas.
A su vez son diversos los estudios que describen como el tipo de donante (vivo vs fallecido) influyen en la supervivencia del injerto; estudios previos indican que es mejor cuando se realizan trasplantes de donantes vivos a diferencia de los fallecidos 69.1% vs 56.3% respectivamente 4. Datos del USRDS evidencian que ha cinco años la supervivencia del injerto y del paciente en los lúpicos con donante vivo fue del 77% y 94% respectivamente vs 58.1% y 83.8% en los donantes cadavéricos 46. Este hecho no lo pudimos confirmar en el estudio porque en nuestra institución la mayoría de los trasplantes renales son de donantes fallecidos.
Al evaluar las principales complicaciones y agruparlas de acuerdo a la etiología de la ERC, no se encontraron diferencias estadísticamente significativas; estudios previos sugieren que los pacientes con TR por NL y síndrome antifosfolípido tienen un riesgo más elevado de enfermedad vascular, lo cual incrementa la morbimortalidad de estos pacientes 11; por otro lado este grupo poblacional tiene un mayor riesgo de presentar neoplasias como el Linfoma no Hodgkin, carcinoma escamo celular de piel y de vejiga con frecuencia asociados al uso previo de ciclofosfamida 47,48; este hecho no se evidenció en nuestro estudio, aunque nuestros resultados pueden ser causados por ser una muestra pequeña; sin embargo se encontraron pequeñas diferencias significativas con respecto a las trombosis del injerto la cual fue mayor en los pacientes con ERPQ, sin encontrar una explicación a este hallazgo; las infecciones de la herida quirúrgica fueron mas frecuentes en los diabéticos, lo que se explica porque este grupo de pacientes tienen mas riesgo de infecciones y las infecciones urinarias que fueron mas frecuentes en pacientes lúpicos, explicado a que esta enfermedad se presenta en mayor proporción de mujeres, género con mayor riesgo de infecciones del tracto urinario.
Este estudio tiene como limitaciones que se realizó en un único centro, con un número poblacional limitado y que es de carácter retrospectivo. Por otro lado aunque el análisis está ajustado a las comorbilidades, en este estudio no se pueden identificar ni medir todas las variables pertinentes que pueden influir en los resultados, por lo tanto las conclusiones tienen un poder estadístico limitado
Conclusión
Aunque el pequeño tamaño de la muestra hace que no se puedan dar interpretaciones definitivas, los resultados de este estudio sugieren que los pacientes con ERCT por NL que son llevados a TR tienen tasas de éxito similar en cuanto a supervivencia del injerto y del paciente al compararlos con otros grupos como los de ND y ERPQ. Además la tasa de complicaciones y el riesgo de recurrencia de la enfermedad son bajos y la tasa de filtración glomerular fue similar en los tres grupos evaluados. Todo esto sugiere que el TR debe ser considerado la terapia de elección para los pacientes con ERCT por NL con el fin de mejorar la calidad de vida y disminuir la morbimortalidad.