Introducción
A pesar de los esfuerzos realizados a nivel mundial, la tuberculosis (TB), sigue siendo una amenaza para la población. La Organización Mundial de la Salud notificó para el 2014, 9.6 millones (Rango: 9.1-10 millones) de casos nuevos de tuberculosis y 1.5 millones (Rango= 1.1-1.7 millones) de muertes por esta infección. Con 1.2 millones (12%) de tuberculosis asociada con infección por el VIH 1. En Colombia para el 2011 se reportaron cerca de 11,708 casos confirmados de TB, de éstos 10,731 fueron casos nuevos mientras que los restantes fueron casos previamente tratados (572 recaídas, 97 fracasos y 308 abandonos recuperados) 2. Existen diversos estados o enfermedades, pulmonares o extrapulmonares, que están casualmente relacionadas con la tuberculosis. Estas entidades pueden representar problemas de diagnóstico diferencial o de terapéutica, o ser un factor agravante, a los cuales se les ha denominado asociaciones morbosas, dentro de ellas se encuentran la enfermedad pulmonar obstructiva crónica, diabetes, condición de adulto mayor, hipercolesterolemia, cáncer de pulmón, inmunodeficiencias y enfermedades pulmonares micóticas. Por éstas últimas, se ha incrementado el interés por realizar su diagnóstico, pues muchas de las personas afectadas con enfermedad micótica han tenido una entidad pulmonar severa como la tuberculosis. La frecuencia de las infecciones micóticas oportunistas aumenta de manera progresiva, secundaria a un incremento en el número de enfermedades inmunosupresoras. Por lo tanto, es necesario que el personal médico investigue focos de infección secundaria a hongos potencialmente patógenos. Cuando no se reconoce la micosis oportunista se puede afectar el progreso de la enfermedad que podría llegar a ser letal 3,4.
Nuestro objetivo es presentar el caso clínico de una paciente sin antecedentes de inmunosupresión que presentó coexistencia de infección respiratoria micótica y tuberculosis.
Caso clínico
Se presentó al servicio de urgencias de una clínica de segundo nivel de Cartagena de Indias (Colombia), una paciente de sexo femenino de 22 años de edad, de etnia mestiza, con un cuadro clínico de seis días de evolución, con fiebre intermitente de 38° C y tos persistente, presentó hemoptisis masiva al quinto día del episodio febril. Dentro de los antecedentes personales no se encontraron enfermedades coomórbidas, tabaquismo, consumo de medicamentos ni sustancias psicoactivas. Se empleaba como recepcionista. Niega contacto epidemiológico con personas con sospecha o diagnóstico de tuberculosis. No se ha desplazado fuera de la ciudad donde habita. En los antecedentes familiares se encuentran hipertensión arterial e hiperlipidemia no clasificada.
Al examen físico de ingreso se encontró una frecuencia respiratoria de 32 respiraciones/min, frecuencia cardíaca de 84 latidos/min, una temperatura: 38° C, la presión arterial se encontró en 110/80 mmHg, el peso fue de 51 kg, la talla de 1.64 y el IMC de 19.
El paciente presentó buen estado musculonutricional. Presentó palidez generalizada, con mucosas húmedas y pálidas con buena perfusión distal. En la revisión clínica de la piel, las mucosas y la cavidad oral no se encontraron hallazgos de infecciones activas o antiguas. Al examen respiratorio se halló una disminución del murmullo vesicular en la región apical y estertores crepitantes basales en el pulmón izquierdo. El resto del examen físico fue normal.
El hemograma mostró una hemoglobina de 10.7 gm/dL; el volumen corpuscular medio (VCN): 103 µm3; ancho de la distribución eritrocitaria (ADE): 14.8% (normal: 12%-15%), leucocitos: 8,400/mm3 (60% neutrófilos, 27% linfocitos, 8% monocitos, 5% eosinófilos) y plaquetas: 262,000/mm3.
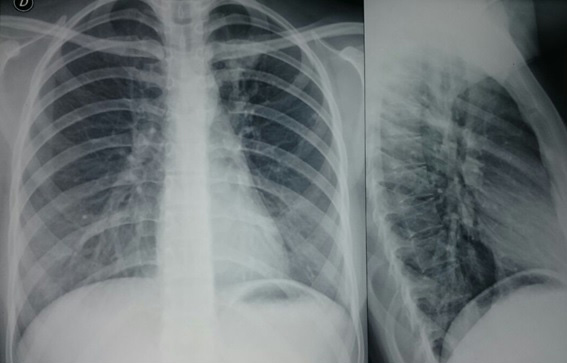
Los gases arteriales, electrolitos séricos, electroforesis de proteínas, pruebas de coagulación, cuantificación de inmunoglobulinas séricas, los estudios de valoración renal (parcial de orina y sedimento urinario, creatinina, nitrógeno ureico) y hepática (bilirrubinas, alanino transaminasa, aspartato transaminasa, fosfatasa alcalina, albúmina sérica, tiempo de protrombina) resultaron normales. El Elisa para VIH dio negativo. Los Anticuerpos antinucleares y Anti-DNA bicateriano resultaron negativos. El Derivado Proteíco Purificado (PPD) fue de 7 mm a las 72 horas de lectura. Los estudios imagenológicos informaron en la radiografía de tórax y el apicograma un área de aumento de la densidad de localización apical izquierda con ocupación intersticial en relación a proceso consolidativo (Fig. 1).
Figura 1.
Radiografía anteroposterior y lateral de tórax. Radiografia realizada al quinto dia de iniciados los síntomas, en la que se observa revistimiento de partes blandas del tórax normal. Diafragmas en posición habitual y ángulos costofrénicos libres. Se aprecia un área de aumento de densidad de localización apical izquierda con ocupación intersticial en relación a un proceso consolidativo. La vasculatura pulmonar y la aorta no muestran alteraciones. La situación, el calibre y los límites de la tráquea son normales. No hay ensanchamiento de las líneas paratraqueales, ni desplazamiento de las diferentes líneas mediastinales.
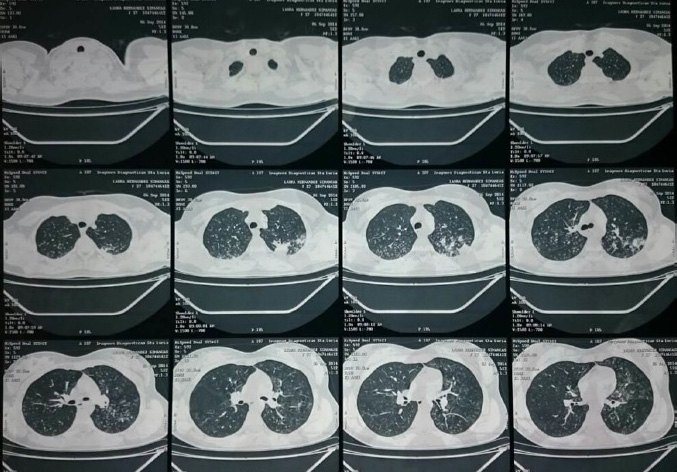
En la tomografía axial computada (TAC) de tórax se observó un engrosamiento y ocupación alveolar con área de cavitación apico posterior del lóbulo superior izquierdo. Se realizó TAC de Tórax de Alta Resolución con hallazgo de nódulos con patrón en árbol de gemación en ambos vértices pulmonares (Fig. 2).
Figura 2.
TAC de tórax en alta resolución. Los tejidos blandos y estructuras óseas de las paredes del tórax no muestran alteraciones. No hay una evidencia de derrames pleurales o lesiones de tipo intra o extra pleural. Se observa un engrosamiento y ocupación alveolar con un área de cavitación ápico posterior del lóbulo superior izquierdo con un hallazgo de nódulos con patrón en árbol de gemación en ambos vértices pulmonares. La tráquea, los bronquios fuente y lobares visualizados, están dentro de lo normal. No hay evidencias de masas mediastinales. La silueta cardiaca, los grandes vasos y las demás estructuras vasculares visualizadas no muestran cambios de significado patológico.
Se le realizó fibrobroncoscopia y lavado bronquioalveolar, en donde se visualizó a nivel de región lobar superior en pulmón izquierdo, la mucosa endobronquial eritematosa y edematosa con nódulos de aspecto blanco-amarillento con áreas necróticas y lesión cavitaria con secreción serohemática de la cual se tomó una muestra con catéter protegido, que fue analizada a la hora y 17 min, con resultados del estudio en fresco y la tinción de Gram que mostraron una estructura de ramificación de levaduras en ciernes y coloración de Ziehl-Neelsen negativo. El cultivo en medio Ogawa-Kudoh fue positivo para Mycobacterium tuberculosis. Se obtuvo crecimiento de más de 30 colonias de Candida albicans con formas pseudomiceliales del cultivo para hongos en medio Agar Dextrosa Sabouraud (SDA) y positividad para la filamentización en suero por triplicado. Los mismos estudios se analizaron en una muestra de esputo espontáneo hemoptoico obteniéndose los mismos resultados. La muestra fue pareada en el laboratorio del Instituto Nacional de Salud de Colombia con cultivo en medio líquido por MGIT (Mycobacterial Growth Indicator Tube)-960 con crecimiento de M. tuberculosis sensible a medicamentos para categoría I (isoniazida, rifampicina, pirazinamida y etambutol). Se manejó con voriconazol para infección por Candida y Terapia Acortada Estrictamente Supervisada (TAES) para tuberculosis, con isoniazida (300 mg/día), rifampicina (600 mg/día), pirazinamida (1,600 mg/día) y etambutol (1,100 mg/día) para 48 dosis y continuando la segunda fase con isoniazida y rifampicina a 150 mg/día tres veces a la semana cada una por 54 dosis. La paciente presentó mejoría de los síntomas luego del inicio del manejo y fue egresada a los 15 días de hospitalización.
Discusión
La frecuencia de las infecciones micóticas oportunistas aumenta de manera progresiva, secundaria a un incremento en el número de enfermedades inmunosupresoras. Candida albicans (C. albicans) sigue siendo la levadura más común asociada con infecciones en pacientes inmunocomprometidos 5,6. La prevalencia de coinfección de tuberculosis pulmonar con Candida a nivel pulmonar es del 15-32% en diferentes estudios 7,8. La más frecuente (de 9 a 80%) de las especies es la Candida albicans que es un componente de la microflora habitual normal del tracto digestivo y membranas mucosas. Se le considera ubicua en el ambiente hospitalario, ya sea en el aire, superficies inertes como pisos o techos y también en los alimentos 8.
Candida albicans ha emergido como un hongos potencialmente patógenos en lugar de un comensal inocuo de mucosas de pacientes con enfermedades broncopulmonares, conduciendo a incrementar las complicaciones en éstas patologías. Kali et al. 5, encontraron un 40% de coinfección con Candida, siendo la Candida albicans la más frecuente (59%), seguida de C. tropicalis (20%) y C. glabatra (20%). Aunque varios autores han documentado las especies de Candida como el agente de hongos más común aislado del esputo de pacientes con tuberculosis pulmonar, su importancia siempre ha sido un tema de controversia debido al hecho de que hasta un 32.5% de las personas sanas son portadoras de Candida en su garganta 9. Esta situación puede conducir a contaminación de la muestra de esputo. Para eliminar este problema se han utilizado diferentes estrategias tanto operativas como la toma de muestra directa en la lesión del parénquima pulmonar como microbiológicas. En la paciente del caso clínico la muestra fue obtenida por broncoscopia flexible y el diagnóstico de la infección por Candida se realizó por la presencia de levaduras en ciernes en el frotis y por el criterio de Kahanpaa 10. De acuerdo a éste criterio, el aislamiento de 3 ó más colonias de Candida, de más de 30 colonias con formas de pseudomicelios en el medio SDA son más sugestivos de una infección que una colonización 11.
Por su parte Unis et al. 12, en un estudio en pacientes con comorbilidades y que tenían diagnóstico de tuberculosis en la ciudad de Porto Alegre, encontraron una asociación fúngica prevalente con Aspergillus fumigatus (57%), seguido de Aspergillus niger (29%), Scedosporium apiospermum (7%) y Aspergillus flavus (7%). Todos los pacientes presentaron hemoptisis, otras manifestaciones clínicas incluyeron tos, pérdida de peso, fiebre, disnea, expectoración purulenta, astenia y dolor toráxico.
Los estudios de imagen en los pacientes con TB primaria pueden tener una radiografía normal en un 15%, recomendándose realizar estudios como TAC pulmonar. Adicionalmente la TAC de alta resolución, es usada para determinar la enfermedad activa, en donde es posible observar imágenes de estructuras lineales de múltiples ramificaciones de calibre similar procedentes de un único "tallo" (aspecto de "árbol en gemación") se observan con frecuencia en pacientes con amplia difusión broncogénica 13,14.
La paciente del caso clínico no tiene antecedentes ni datos clínicos que soporten una condición que conduzca a un estado de inmunosupresión y que explique la coinfección de tuberculosis y candidiasis pulmonar. La causa del evento abrupto de hemoptisis de la paciente previamente sana determinó su hospitalización para realizar estudios respiratorios y generales destinados a buscar enfermedades de base que explicaran la coinfección micótica y fúngica.
El cambio patológico en el tejido respiratorio que se produce en pacientes con tuberculosis contribuye a la favorabilidad en su patogénesis de la infección micótica y se debe sospechar en pacientes con TB en los cuales se den manifestaciones pronunciadas como tos con hemoptisis de gran volumen.
Conclusión
La coinfección de tuberculosis e infección micótica no es frecuente encontrarla descrita en pacientes sin evidencias de comorbilidades ni enfermedades inmunosupresoras. Aunque el crecimiento sinérgico entre Candida y M. tuberculosis está bien descrito, los aislados de especímenes respiratorios suelen ser ignorados considerándolo como patógeno comensal. Debe realizarse la sospecha en pacientes con hemoptisis masiva o con inadecuada respuesta al tratamiento antifímico. El hallazgo de estas condiciones clínicas conduce a que se realice estudios concernientes a patologías y situaciones que conlleven a inmunosupresión.