Introducción
La telangiectasia hemorrágica hereditaria (THH) o síndrome de Osler Weber Rendu es una enfermedad vascular multi sistémica autosómica dominante, caracterizada por telangiectasias mucocutaneas y malformaciones arteriovenosas (MAVs) que predisponen a formación de shunts y sangrados. La prevalencia es cercana a 1:5,000-8,000 1. En la mayoría de casos es asociada a mutaciones en los genes que codifican para receptores de la superfamilia del factor de crecimiento transformante β/proteína morfogénica ósea (TGF-β/BMP). Las mutaciones identificadas causan disfunción endotelial, angiogenesis y/o remodelamiento vascular 2,3. Las mutaciones en dos genes diferentes son las responsables de los 2 subtipos: THH1 (mutación en gen ENG, principalmente MAVs con compromiso pulmonar y cerebral) y THH2 ( Mutación en Acvrl1, principalmente MAVs hepáticas) 1-3.
El número y localización de las lesiones varían, incluso en la misma familia de los pacientes afectados. La mayoría de telangiectasias son en la mucosa oral, nasal y gastrointestinal 4; las MAVs pueden comprometer los pulmones 5, hígado 6, y sistema nervioso central 7. La epistaxis es generalmente, aunque no siempre, el signo más temprano 1,2. La manifestación inicial también puede ser absceso cerebral, hemorragia intracraneal o síntomas pulmonares 8. En pacientes pediátricos con THH, las manifestaciónes más comunes son epistaxis y compromiso mucocutaneo. Otros órganos afectados son pulmones y cerebro, con presencia de MAVs incluso en pacientes asintomáticos. MAVs grandes se asocian frecuentemente con complicaciones en la infancia 8,9. El compromiso hepático puede llevar a insuficiencia hepática y a falla cardiaca derecha, hipertensión portal y enfermedad biliar isquémica 10 Dado que actualmente no se dispone de una terapia sistémica eficaz, sólo se emplean tratamientos locales, según el órgano implicado. Por ejemplo, en el tratamiento de la epistaxis varias opciones como septodermoplastia, ligadura de arteria quirúrgica y láser, entre otros, son eficaces para el control local. Para el tratamiento de la hemorragia gastrointestinal, el uso de láser o sonda térmica han mostrado un beneficio a corto plazo 4,11. La embolización de MAVs del sistema nervioso central o pulmones ha demostrado ser una buena opción 12. Los pacientes asintomáticos con MAVs hepáticas no suelen ser tratados 10,11. Por otro lado, la terapia sistémica incluye estrógenos 11, tamoxifeno para el sangrado recurrente pero con restricciones debido a su efecto teratogénico 13; Y el ácido tranexámico que ha mostrado resultados prometedores pero con un potencial efecto protrombótico 14.
El bevacizumab, un anticuerpo monoclonal humanizado recombinante que inhibe el factor de crecimiento endotelial vascular (VEGF), se une a sus receptores en la superficie de las células endoteliales, inhibe la proliferación de células endoteliales, el crecimiento endotelial y causa la regresión de vasos existentes aumentando la muerte celular endotelial 15. El uso de bevacizumab intravenoso en dosis de 5-10 mg/kg cada tres semanas en THH ha demostrado disminución de episodios de epistaxis y mejoría del alto gasto cardíaco secundario a MAVs 16 y evita la necesidad de trasplante hepático después de seis meses de tratamiento en pacientes adultos con compromiso hepático en THH 17. En este artículo presentamos el caso de una paciente pediátrica con múltiples MAVs secundarias a THH, tratada con éxito con bevacizumab durante tres meses (6 ciclos).
Reporte de caso
Una paciente de 5 años de edad fue remitida a nuestra institución por insuficiencia hepática y múltiples fístulas arteriovenosas pulmonares. La madre fumó durante el primer trimestre del embarazo y se diagnosticó citomegalovirus congénito (CMV). El parto fue a las 38 semanas sin complicaciones, peso 2,500 g, longitud 42 cm. Dos meses después del nacimiento, el paciente desarrolló bronquiolitis obliterante y neumonía por CMV (carga viral >120,000 copias), deterioro de la función respiratoria y hemorragia alveolar. Requirió ventilación mecánica invasiva y terapia antiviral. En ese momento, presentó una función hepática anormal que se asoció a la infección por CMV. Además, se evidenció fibrosis hepática, ascitis, retraso del crecimiento y deterioro de la condición general. A los 5 años fue evaluada por epistaxis, telangiectasias múltiples en la cara, disnea, ascitis, hipoxemia y evidencia de múltiples fístulas arteriovenosas pulmonares. Ella fue remitida a nuestra institución debido a la complejidad del caso. La paciente fue ingresada en la unidad de cuidados intensivos pediátricos. En el examen físico, presentaba un pobre estado general con retraso del crecimiento, frecuencia cardiaca de 80 latidos por minuto, frecuencia respiratoria de 25 respiraciones por minuto, presión arterial 96/55 mmHg, temperatura 36.2o C, saturación de oxígeno 84%, peso 12.5 kg y estatura de 88 cm. Se evidenciaron múltiples telangiectasias en la cara, hipertelorismo y orejas de implantación baja. Fue necesario tratamiento con oxígeno suplementario con un dispositivo Venturi a 60%. El examen cardiopulmonar evidenció un soplo cardíaco sistólico de grado II/IV en el mesocardio. La auscultación pulmonar fue normal. En el examen abdominal se documentó una hepatomegalia (3 cm por debajo del margen costal derecho) sin esplenomegalia. También se observó acropaquia, llenado capilar de 2 segundos, cianosis periférica y central. El examen neurológico fue normal.
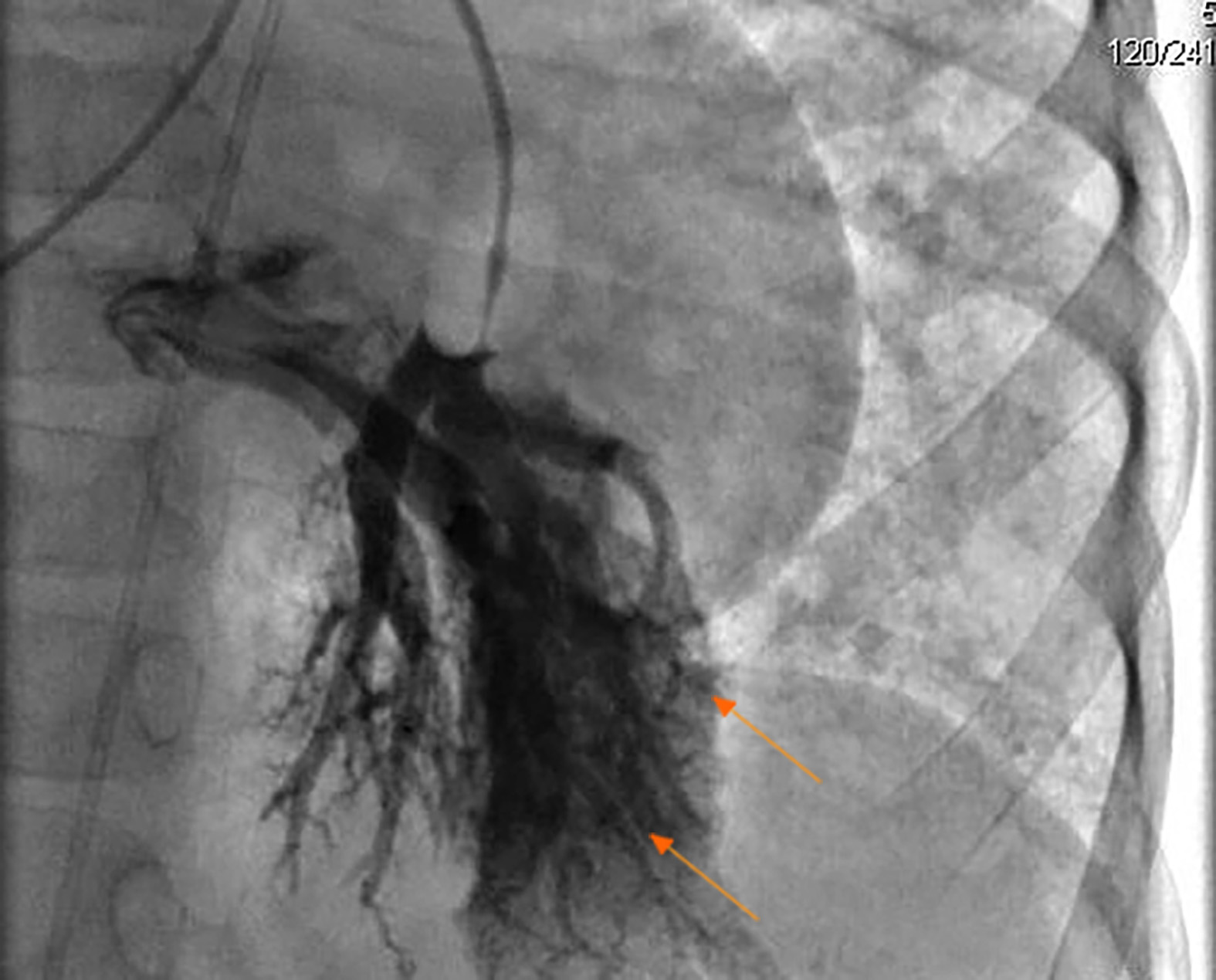
Se completaron estudios de extensión. A la admisión: Leucocitos 14,540/μL, neutrófilos 8,840/μL, linfocitos 4,420/μL, monocitos 1,060/μL, hemoglobina 15.2/μL, plaquetas 136,000/μL. Los reactantes de fase aguda fueron normales (proteína C-reactiva de 0.37 mg/dL y velocidad de eritrosedimentacion en 18 mm/h), los electrolitos fueron normales. Se documentó compromiso hepático con una bilirrubina total de 1.78 mg/dL, bilirrubina indirecta 1.01 mg/dL y bilirrubina directa de 0.77 mg/dL, además de una gamma glutamil transferasa (GGT) anormal (220 U/L, valor normal hasta 41 U/L). Las transaminasas también estaban elevadas (AST 71.2 U/L y ALT 53.6 U/L). Los demás paraclínicos mostraron una función renal normal; Proteínas totales de 5.90 g/dL, albúmina 3.17 g/dL y ferritina 291.7 ng/mL (valor de referencia 4-67 ng/mL). Se descartaron enfermedades infecciosas agudas (los isotipos IgG para CMV, Toxoplasma y Rubéola fueron positivos). El análisis inmunológico mostró una respuesta positiva al 50% para los serotipos 7-14 a Streptococcus pneumonie para Prevenar 7. Se evidenciaron altos niveles de IgE. Por otro lado, los niveles totales de IgA, IgG e IgM fueron normales. Los niveles de C3 y C4 fueron normales. Los recuentos linfocíticos fenotípicos fueron normales (CD3+: 3,542/μL-77% - de linfocitos, con una relación CD4+/CD8+: 1). Los anticuerpos antinucleares(ANAS), anti-mitocondriales y anti-músculo liso fueron todos negativos. El análisis enzimático de α1-antitripsina y α-fetoproteína fue normal. La biopsia del hígado y el bazo mostraron fibrosis perisinusoidal y septal IV/VI, hematopoyesis extramedular e hipertensión portal. Todos los análisis microbiológicos fueron negativos. La biopsia de médula ósea fue normal. Se realizaron varios estudios de imagen, incluyendo una Angiografía por Resonancia Magnética cerebral normal. La tomografía de tórax mostró dilatación anormal de las venas pulmonares y crecimiento de cavidades cardiacas derechas. La angiorresonancia esplenoportal de la circulación hepática mostró cambios regenerativos nodulares sin evidencia de lesiones focales de neovasculatura y circulación esplénica-portal permeable. La endoscopia de vías digestivas altas mostró gastropatía hipertensiva y varices esofágicas grado I-II. El ecocardiograma mostró múltiples derivaciones intrapulmonares secundarias con una prueba positiva de burbujas con contraste, funciones sistólica y diastólica preservada, estenosis pulmonar leve, gradiente pico de 36 mmHg, presión arterial pulmonar en 44 mmHg y fracción de eyección del ventrículo izquierdo del 73%. La ecografía abdominal mostró cambios regenerativos nodulares hepáticos y esplenomegalia. La ecografía Doppler esplenoportal no describió evidencia de anomalías vasculares e hipertensión portal con flujo preservado. Se realizó un cateterismo cardíaco de diagnóstico, mostrando MAVs múltiples en todos los lóbulos pulmonares, predominantemente en el pulmón izquierdo (Fig. 1).
Figure 1
El cateterismo cardíaco mostró malformaciones arteriovenosas (flechas) en el pulmón izquierdo del paciente con telangiectasia hemorrágica hereditaria
Durante la hospitalización, el paciente presentó varios episodios de epistaxis y deterioro de la función cardiopulmonar con mayores requerimientos de oxígeno secundarios a las derivaciones arteriovenosas pulmonares. Se descartó la presencia de derivaciones gastrointestinales, del hígado o del sistema nervioso central. Debido a los episodios de epistaxis espontánea y recurrente, y a la presencia de múltiples telangiectasias y MAVs pulmonares, se realizó el diagnóstico de síndrome HHT (Rendu-Osler-Weber), a pesar de no tener antecedentes familiares. Se excluyeron inmunodeficiencias o trastornos linfoproliferativos. El síndrome hepatopulmonar (HPS) también se descartó en base a la presencia de MAVs pulmonares, telangiectasias múltiples y epistaxis que eran compatibles con HHT sobre HPS. El paciente requirió oxígeno de alto flujo, broncodilatadores y tratamiento antihipertensivo. Se requirieron cinco cateterismos para el manejo, con la implantación de más de 60 coils. La intervención inicial con cateterismo trató las MAVs localizadas en el lóbulo inferior derecho (15 embolizaciones). El segundo y el tercer cateterismo se realizaron en el lóbulo inferior izquierdo y lingula. En el cuarto cateterismo, la recurrencia se evidenció en el pulmón izquierdo y se encontraron nuevas MAVs en el lóbulo inferior derecho que requirieron nuevas embolizaciones.
Debido a un desarrollo regular de nuevas comunicaciones arteriovenosas durante la terapia de cateterismo cardíaco en un período de seis meses, se planificó un tratamiento sistémico. Entre las alternativas propuestas en la literatura, se consideraron el uso de estrógenos, talidomida y bevacizumab. Debido a la edad del paciente, la toxicidad potencial y la teratogenicidad del uso de los dos primeros tratamientos estos se descartaron. Debido al éxito del tratamiento en pacientes adultos con THH y, después de múltiples reuniones realizadas por todas las especialidades médicas tratantes, el comité de ética de la institución, los padres y su autorización de servicio de salud, decidimos iniciar el bevacizumab. Bevacizumab se administró a dosis de 5 mg/kg (65 mg) cada 15 días. Tras una hospitalización de ocho meses y la infusión de 6 dosis de bevacizumab, la paciente presentó una mejoría en los síntomas respiratorios, episodios de epistaxis y en la evolución de malformaciones arteriovenosas sin recurrencia en el último cateterismo cardíaco. Al momento del alta, el requerimiento de oxígeno disminuyó del 60% FiO2 al 28%, con una saturación de oxígeno del 80%. Las telangiectasias faciales mejoraron significativamente. El ecocardiograma mostró también mejoría con disminución de la presión arterial pulmonar de 44 mmHg a 22 mm Hg y reducción en el gradiente pico de 36 mmHg a 17 mmHg (Tabla 1). La TAC torácica no mostró nuevas MAVs.
| Cateterismo | Tiempo en relación al bevacizumab | Gradiente pico de válvula aortica mmHg | Gradiente pico de válvula pulmonar (mg Hg) | Válvula tricuspide | Presion de arteria pulmonar (mg Hg) |
|---|---|---|---|---|---|
| 1 | 4 meses antes | 32.0 (sin insuficiencia) | 36 | Insuficiencia leve a moderada | 44 |
| 2 | 3 meses antes | 33.0 | 32 | Insuficiencia leve a moderada | 42 |
| 4 | Tratamiento con Bevacizumab | 28.5 | 23 | Insuficiencia leve | 32 |
| 6 | 3 meses después de finalizar el tratamiento | 27.0 | 17 | Insuficiencia leve | 22 |
Las infusiones del medicamento fueron bien toleradas, sin evidencia de infección o efectos adversos asociados con la inyección. Después de un año de seguimiento, el estado clínico del paciente permanece estable.
Después del tercer y quinto cateterismo cardiaco, no se realizó ecocardiografía. La última ecocardiografía se realizó al alta tras 6 ciclos de bevacizumab.