Introducción
Han pasado más de 30 años desde el reporte de cinco jóvenes homosexuales con una rara enfermedad, neumonía por Pneumocystis carinii, en tres centros hospitalarios de Los Angeles, Estados Unidos 1. Varios eventos ocurrieron desde entonces hasta la definición del Síndrome de Inmunodeficiencia Adquirida (SIDA) en 1982 2. No pasó mucho tiempo para que los pocos casos iniciales se convirtieran en decenas de millones, generando una de las más grandes pandemias de los tiempos modernos 3.
Para el tratamiento de la infección por VIH se han aprobado 26 medicamentos los cuales han disminuido la mortalidad por la infección. La reducción en los costos iniciales de los medicamentos antirretrovirales, la disponibilidad de medicamentos genéricos y el incremento del financiamiento internacional han marcado la expansión de su uso en países de bajos y medianos ingresos 3.
Diferentes sociedades en diversos contextos de sistemas de salud, han emitido guías de tratamiento antirretroviral en adultos y adolescentes, con actualización periódica de sus recomendaciones. En la Guía de la Sociedad Europea de SIDA, la de la Organización Mundial de la Salud (OMS) y la de la Sociedad Antiviral Internacional (Estados Unidos), se definen recomendaciones para los esquemas de inicio preferidos, con algunas diferencias entre ellas, pues la guía de la OMS aclara que en los casos en que no se pueda utilizar Tenofovir Disoproxil Fumarato/Emtricitabina (TDF/FTC), se puede utilizar Zidovudina/Lamivudina (AZT/3TC) y que los regímenes que incluyan Abacavir (ABC) no se consideran alternativas preferidas. La Guía Europea establece como esquemas preferidos aquellos que contengan TDF/FTC o Abacavir/Lamivudina (ABC/3TC), aclarando que este último debe utilizarse con precaución en casos con cargas virales mayores de 100,000 copias/mL); finalmente el panel estadounidense recomienda varios esquemas como regímenes iniciales, cada uno con una indicación o una advertencia sobre su uso dependiendo de la carga viral basal, el tercer fármaco escogido en el régimen y las condiciones específicas del paciente que contraindiquen el uso de uno o varios de los medicamentos disponibles, aclarando que la mayoría de los esquemas contienen TDF/FTC o ABC/3TC como columna vertebral del tratamiento 4-6.
En Colombia la atención de los pacientes se hizo con base en la Guía para el manejo del VIH/SIDA basada en la evidencia. En esta se recomendaban la Zidovudina (AZT) más Lamivudina (3TC) como los inhibidores de transcriptasa reversa análogos de nucleósido preferidos 7,8. En la actualización de 2014 de esta Guía, el régimen AZT/3TC pasó a ser recomendado como régimen alternativo 9. En otros países de Latinoamérica, como Argentina y Chile las tres combinaciones se mantienen dentro de los regímenes recomendados para el inicio de la terapia 10,11.
Lo anterior deja claro que existen en el mundo dos regímenes de inhibidores de transcriptasa reversa análogos de nucleósidos preferidos para incluir en los esquemas de inicio de tratamiento antirretroviral (TAR) y que en algunos países, la opción de AZT/3TC sigue siendo contemplada como recomendada o alternativa
Los resultados de las comparaciones directas de la eficacia y seguridad de los regímenes mencionados han mostrado una efectividad similar entre regímenes que contienen TDF/FTC vs AZT/3TC, con diferencias en cuanto a la seguridad de los regímenes, incluso diferenciados por género 12,13. Otros estudios han encontrado que medicamentos como 3TC y FTC son clínicamente equivalentes 14. La comparación de las combinaciones de ABC/3TC vs TDF/FTC en algunos estudios mostró una eficacia antiviral similar 15,16, mientras que en otro se encontró mayor riesgo de falla virológica en los que utilizaron ABC/3TC cuando la carga viral es mayor de 100,000 copias/mL 17.
En cuanto a la seguridad de los diferentes esquemas, también existen resultados divergentes. Se han reportado diferencias en cuanto a efectos secundarios renales, con incremento en marcadores de disfunción tubular en pacientes que recibieron TDF/FTC 18,19, sin dejar clara la relevancia clínica de tales hallazgos. De igual manera se observó un mayor impacto en la densidad ósea con los esquemas basados en TDF/FTC comparados con los esquemas basados en ABC/3TC 20,21.
No existen comparaciones que incluyan estos tres regímenes, por lo que el objetivo de esta investigación fue comparar la eficacia y seguridad de la combinación de AZT/3TC vs ABC/3TC vs TDF/FTC como integrantes del tratamiento antirretroviral de gran actividad (TARGA) en pacientes mayores de 18 años con infección por VIH e indicación de inicio de tratamiento.
Las revisiones sistemáticas de ensayos clínicos con asignación aleatoria se consideran el estándar en las decisiones del cuidado de la salud basadas en la evidencia. Muchas revisiones sistemáticas utilizan metanálisis para combinar resultados cuantitativos y resumir la evidencia disponible. De esta manera, un metanálisis puede mejorar el conocimiento acerca de una estrategia terapéutica aumentando la potencia estadística, la precisión en el tamaño del efecto del tratamiento o resolviendo controversias que surgieron de estudios aparentemente contradictorios. Sin embargo, pueden tener limitaciones que pueden afectar la validez de los resultados obtenidos, en el caso de combinar estudios con características clínicas diferentes entre los participantes en los mismos, o con resultados erróneos si se combinan estudios con riesgo de sesgo, generando un resumen inapropiado. Estas limitaciones deben tenerse en cuenta previo a la realización del metanálisis para un adecuado manejo de dichas limitaciones que lleven a obtener resultados válidos y generalizables 22. Idealmente los ensayos clínicos deberían comparar simultáneamente todas las intervenciones de interés; sin embargo, tales estudios casi nunca están disponibles. En ausencia de estudios que comprendan una comparación directa, una comparación indirecta podría proveer evidencia útil. De igual manera, la combinación de evidencia directa e indirecta puede fortalecer la evaluación de las intervenciones disponibles 23.
Materiales y Métodos
Se realizó una revisión sistemática y metanálisis en red en la que se incluyeron ensayos clínicos paralelos con asignación aleatoria, realizados con cualquier propósito (equivalencia, superioridad, no inferioridad), en un solo centro o multicéntricos, en cualquier idioma, en cualquier país y con cualquier tiempo de seguimiento. Se incluyeron estudios realizados con pacientes mayores de 13 años, con diagnóstico confirmado de infección por VIH por medio de cualquier prueba confirmatoria directa o indirecta, en quienes se decidió iniciar TARGA y que no estuvieran expuestos previamente en forma directa a ningún medicamento antirretroviral.
Las intervenciones que se compararon fueron las coformulaciones de TDF/FTC (300/200 mg cada 24 h vía oral), ABC/3TC (600/300 mg cada 24 h vía oral) y AZT/3TC (300/150 mg cada 12 h vía oral) que se hubieran realizado en comparación directa entre ellas o con placebo.
Medidas de desenlace
Los desenlaces fueron: i) mortalidad, ii) progresión clínica a SIDA (proporción de pacientes que en los estudios presentan una enfermedad definitoria de SIDA o progresan al estadio C y/o 3 de la clasificación de los Centros para el control de enfermedades de Atlanta, USA (CDC) de 1993 o 2008, luego de iniciar el tratamiento antirretroviral) 24,25, iii) respuesta virológica al tratamiento antirretroviral definida como la proporción de pacientes que alcanzaron una carga viral menor a 50 copias/mL a las 48 y 96 semanas, luego de iniciar el tratamiento antirretroviral 6, iv) falla virológica (carga viral de VIH > 50 copias/mL 6 meses después de iniciar la terapia en personas que se mantienen en tratamiento antirretroviral) 6, v) adherencia al tratamiento (Proporción de pacientes que al finalizar el tiempo del estudio continúan con el mismo esquema inicial sin interrupciones del mismo), vi) falla inmunológica (conteo de CD4 que cae desde la línea de base o es inferior a 100 células/µL persistentemente) 5, vii) reacción de hipersensibilidad a ABC (síndrome clínico multiorgánico que se presenta en las primeras 6 semanas luego de iniciar tratamiento con ABC) 4, viii) proporción de nuevos casos de Infarto Agudo de miocardio (IAM) o Evento cerebrovascular agudo (ECV) luego del inicio del tratamiento antirretroviral, ix) supresión de médula ósea definida como la proporción de nuevos casos de anemia y/o neutropenia luego del inicio del tratamiento antirretroviral, x) acidosis láctica (aumento del lactato sérico >5 mmol/L asociado a síntomas sistémicos) 6, xi) lipodistrofia (Aumento o disminución de la grasa subcutánea medida por antropometría o absorciometría de rayos x de energía dual - DXA) (26), xii) anormalidades renales (tubulopatías, nefrolitiasis, nefritis intersticial) 6, y xiii) osteopenia (mujer posmenopaúsica u hombre con ≥ 50 años con densidad mineral ósea medida por T-score en DXA -1 a -2.5) osteoporosis (mujer posmenopaúsica u hombre con ≥50 años con densidad mineral ósea medida por T-score en DXA ≤-2.5 o mujer premenopaúsica u hombre con <50 años con densidad mineral ósea medida por Z-score en DXA ≤-2 y fracturas por fragilidad) 6.
Métodos de búsqueda para la identificación de estudios
Todas las búsquedas se realizaron sin restricción de idioma o país. Se limitaron a estudios en humanos, desde 1995 (inicio de la TARGA) hasta mayo de 2014.
Se hizo una búsqueda electrónica en las siguientes bases de datos: MEDLINE, EMBASE, Registro Central Cochrane de Ensayos Controlados (CENTRAL), Base de datos Cochrane de Revisiones Sistemáticas, Literatura Latinoamericana de Ciencias de la Salud (LILACS), Índice Médico Africano, Plataforma de registros internacionales de Ensayos Clínicos de la Organización Mundial de la Salud (OMS), Clinical Trials. Además se buscaron los resúmenes, pósteres, conferencias presentadas en los congresos sobre retrovirus e infecciones oportunistas (CROI), conferencias internacionales del VIH, AIDS Clinical Trials Group Network (ACTG). Se hizo búsqueda en tablas de contenido de las siguientes revistas: New England Journal of Medicine, Journal of American Medical Association (JAMA), LANCET, Journal of the International AIDS Society, Official Journal of the International AIDS Society. Se realizó revisión de las referencias de todos los estudios encontrados.
Los términos utilizados en la búsqueda fueron "abacavir", "lamivudine", "tenofovir", "emtricitabine", "zidovudine", "randomized controlled trial", "controlled clinical trial", "randomized", "placebo", "drug therapy", "randomly", "trial", "groups" (Anexo 1).
Selección de estudios
La selección final de los estudios la hicieron dos revisores de manera independiente, ambos expertos en la atención de pacientes con VIH en Colombia y estudiantes de Epidemiología, con la asesoría de una bibliotecóloga experta en búsqueda en bases de datos de las ciencias de la salud.
Ambos revisores evaluaron todos los títulos y resúmenes y excluyeron aquellos que se consideraron irrelevantes para la revisión, por no cumplir los criterios de inclusión o por duplicación. Posteriormente realizaron evaluación del texto completo de los estudios para verificar los criterios de elegibilidad. El acuerdo entre los dos revisores se evaluó mediante estadístico kappa simple, resolviendo los desacuerdos mediante discusión entre ambos.
Extracción y manejo de las variables
Se extrajeron todas las variables que se consideraron relevantes para la comparación de los estudios y medición de los desenlaces, pertenecientes a los siguientes tipos: fuente, elegibilidad, métodos, participantes, intervenciones, desenlaces, resultados, fuente de financiación.
Evaluación del riesgo de sesgo en los estudios incluidos
Se realizó mediante los criterios recomendados por la Colaboración Cochrane 22 y mediante el programa Review Manager 5.3, que incluyen revisión de la generación de la secuencia de asignación aleatoria, ocultamiento de la asignación, cegamiento del personal participante y los pacientes, cegamiento de la evaluación del desenlace, reporte y manejo de los datos perdidos, reporte selectivo, otros sesgos potenciales.
Geometría de la red
Se definió de acuerdo con las comparaciones directas encontradas en los estudios elegidos luego de cumplir con los criterios de elegibilidad, revisión por evaluadores. Si entre todos los estudios incluidos existió al menos una comparación directa entre cada uno de los tratamientos evaluados, se definió que la geometría de la red correspondió a un asa cerrada 23.
Medidas del efecto del tratamiento
Luego de analizar el tipo de desenlaces estudiados, que corresponden a proporciones (número de pacientes con el evento comparado frente al número total de pacientes asignados a cada tratamiento) y de analizar las ventajas y desventajas de cada medida del efecto, y teniendo en cuenta que las medidas relativas son más consistentes que las medidas absolutas, así como la facilidad de interpretación por los clínicos 22, se definió que la medida más consistente con nuestros desenlaces es el riesgo relativo, con su respectivo intervalo de confianza del 95%. Al realizar la extracción de los datos, cuando se encontró un desenlace reportado con medidas continuas, se analizó si era posible extraer las medias y las desviaciones estándar con el fin de analizar mediante diferencia de medias.
Métodos de análisis
Síntesis de los datos
La estimación del efecto de cada desenlace se realizó inicialmente mediante metanálisis de comparaciones directas, con el fin de obtener el efecto de cada combinación y poder utilizarlo posteriormente en el metanálisis en red. Para tal efecto, teniendo en cuenta que los estudios podían haber reportado una cantidad escasa de sucesos y que el método genérico de inverso de la varianza puede ser menos robusto en este contexto, se utilizó el método de Mantel - Hanzel para resultados dicotómicos, con riesgo relativo como medida del efecto. De igual manera se analizaron las comparaciones mediante análisis de efectos aleatorios, pues debido a condiciones como la variabilidad del tercer medicamento entre estudios, no se puede concluir que no haya variación entre los tamaños del efecto entre los estudios. En cada medición se realizó evaluación de la heterogeneidad clínica, mediante investigación y comparación de la diversidad en las características basales de los participantes (intervenciones comparadas, edad, género, carga viral, recuento de linfocitos T CD4+) incluidos en cada estudio y de la heterogeneidad estadística (variabilidad en los efectos de la intervención) mediante el estadístico I². Cuando se encontró que existía heterogeneidad clínica o estadística (I² mayor del 40%) se evaluó mediante análisis de subgrupos por las variables consideradas modificadoras del efecto, definidas como aquellas características de los pacientes o de los estudios que pueden estar asociadas con el efecto final del tratamiento 27 y si dichas variables eran homogéneas entre las comparaciones evaluados, se definió realizar un análisis estadístico mediante metanálisis 22.
El total de pacientes expuestos en cada desenlace correspondió al total de pacientes asignados aleatoriamente a cada comparación, puesto que los análisis en cada estudio fueron por intención a tratar y con el fin de conservar la asignación aleatoria como supuesto para realizar las comparaciones directas e indirectas
Comparaciones indirectas
De acuerdo con la geometría de la red encontrada y teniendo a priori la posibilidad que fuera de asa cerrada, con mínimo una comparación directa disponible entre dos intervenciones, se propuso realizar el análisis final para cada desenlace mediante el método de comparaciones mixtas o el método de comparaciones indirectas de Bucher, los cuales tienen como supuesto fundamental que las comparaciones ocurren a través de un asa cerrada para las comparaciones mixtas y que la eficacia relativa de un tratamiento es la misma en todos los estudios incluidos en la comparación indirecta para el método de Bucher. Además, para que sus resultados sean válidos, el efecto de cualquier tratamiento debe ser intercambiable a través de los demás estudios de la red. Este método tiene la fortaleza de preservar la asignación aleatoria 28.
Existen diversos programas estadísticos que permiten realizar este tipo de comparaciones y para el caso de comparaciones con redes como la nuestra con 3 intervenciones, donde los estudios individuales son comparaciones de dos brazos, se han diseñado métodos sencillos en hojas de Excel para la obtención de los resultados 29
Evaluación de la inconsistencia
Para realizar las comparaciones indirectas es fundamental que se cumplan los principios de transitividad, que son la similitud en cuanto a las variables modificadoras del efecto y la consistencia entre los estudios, definida como el acuerdo entre las fuentes directas e indirectas de la evidencia y que se evalúa estadísticamente mediante el factor de inconsistencia a través de la aproximación específica de asa.
Evaluación de sesgos de reporte
Para evaluar la presencia de sesgos se utilizaron las siguientes estrategias: gráfico de embudo y prevención de los sesgos de idioma, publicación duplicada, ubicación, citación, mediante el cumplimiento estricto de la metodología diseñada para la revisión sistemática.
Análisis de subgrupos
De acuerdo con el conocimiento previo y reportes en estudios, se consideró que las principales causas de heterogeneidad en los efectos de cada tratamiento, definidos igualmente como modificadores del efecto, son el nivel de carga viral y el tercer fármaco. Por tal motivo, se realizaron análisis de subgrupos de acuerdo con el nivel basal de carga viral antes del inicio del tratamiento, evaluando las diferencias en los efectos entre los subgrupos con cargas virales mayores o iguales a 100,000 copias/mL y menores de 100,000 copias/mL y la respuesta diferencial de acuerdo al tercer fármaco (inhibidor de transcriptasa reversa no nucleósido, inhibidor de proteasa o inhibidor de integrasa)
Resultados
Selección de estudios
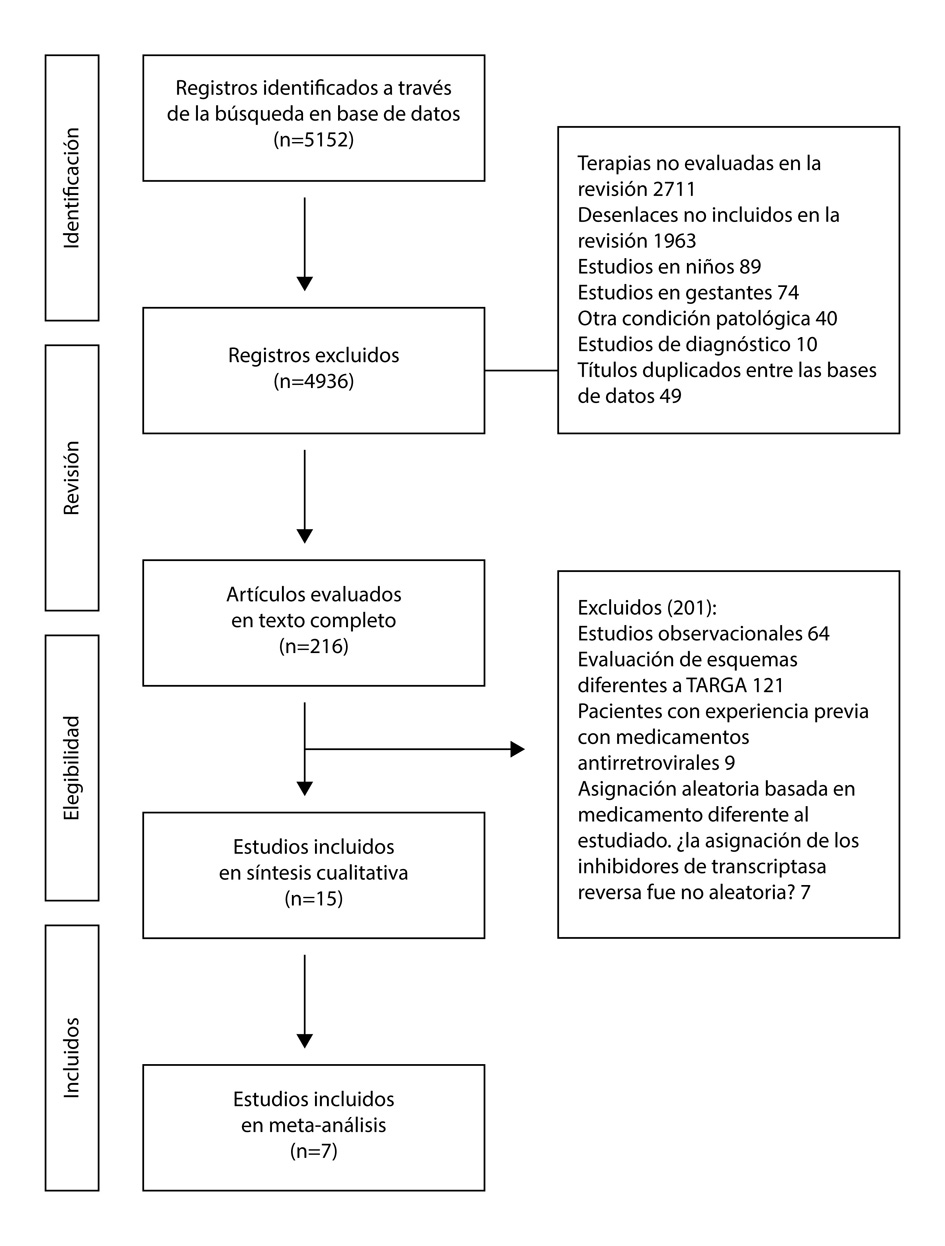
La búsqueda identificó 5,152 títulos para su evaluación inicial, de los que se excluyeron 4,936 luego de la revisión del título, resumen y posible duplicación. Fueron excluidos 2,711 debido a que la terapia evaluada no correspondía a la incluida en la revisión, 1,963 evaluaban desenlaces no estudiados en nuestra revisión, 89 fueron estudios realizados en niños, 74 en gestantes, 40 estudiaban tratamientos para otra condición patológica asociada al VIH, 10 correspondieron a estudios de diagnóstico y se detectaron 49 títulos duplicados entre las bases de datos. Los 216 artículos restantes fueron revisados en su texto completo verificando criterios de elegibilidad. Luego de esta revisión, se obtuvieron 15 publicaciones correspondientes a 7 estudios, 5 comparando ABC/3TC vs TDF/FTC, uno AZT/3TC vs TDF/FTC y uno ABC/3TC vs AZT/3TC (Fig. 1).
El acuerdo entre los dos revisores se evaluó mediante un estadístico kappa simple, obteniendo un kappa de 0.9239 (IC 95%: 0.81-1.00). Los dos desacuerdos entre los revisores se resolvieron mediante discusión entre los mismos y no hubo necesidad de acudir a un tercer revisor.
Geometría de la red
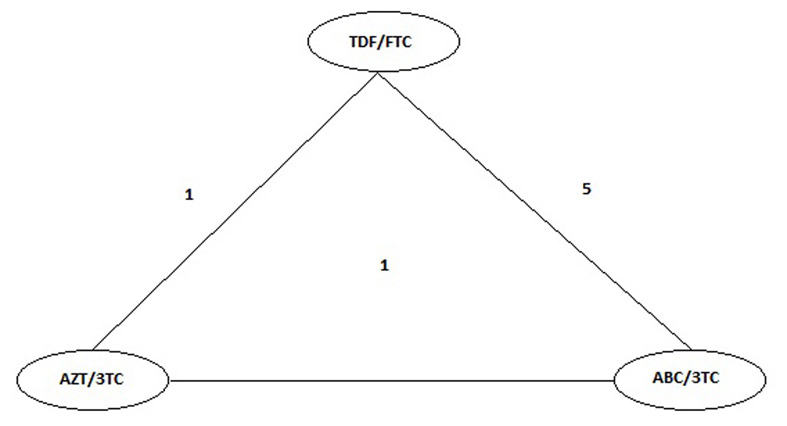
Luego de definir los estudios incluidos en el metanálisis se obtuvo la siguiente red de comparaciones directas, el número indica la cantidad de estudios entre cada nodo (Fig. 2)
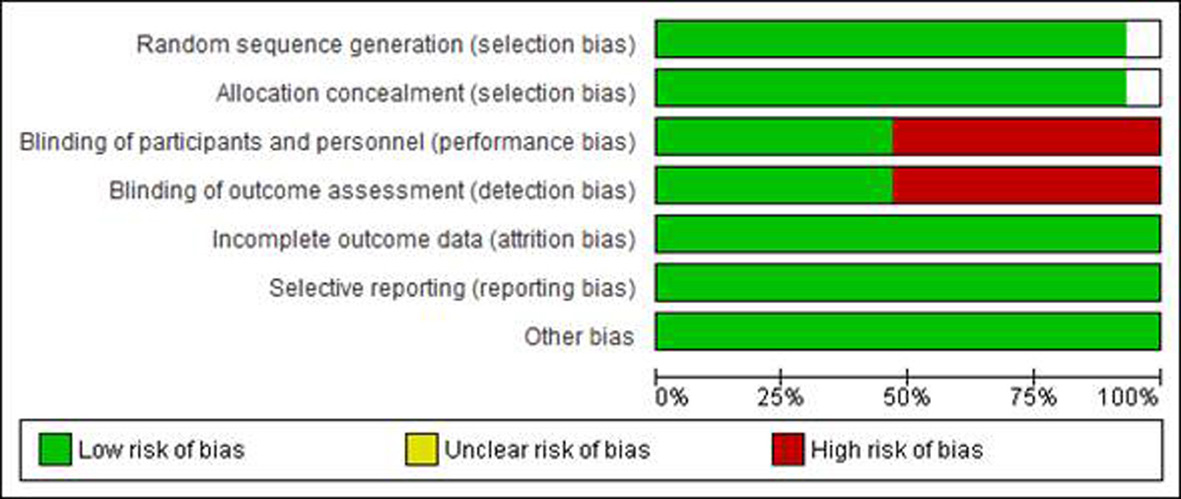
Evaluation of risk of bias in studies included
The risk of bias according to the domains recommended by the Cochrane Collaboration was evaluated with the following results (Fig. 3). Although some studies were at risk of bias because they had not been blinded and although in the publications the reasons for this were not found, it was considered satisfactory to keep them for the analysis considering that they all fulfilled the condition of adequate random assignment.
Cinco estudios reportaron resultados a 48 y/o 96 semanas y dos estudios tenían reporte de resultados sólo a las 48 semanas al momento de realizar la revisión. En todos los estudios la asignación aleatoria se hizo con base en los inhibidores de transcriptasa reversa análogos de nucleósido. Tres estudios fueron de etiqueta abierta en cuanto a su cegamiento, los demás reportaron doble ciego en la asignación y seguimiento. Todos reportaron en sus métodos análisis por intención a tratar y reportaron las causas de los datos perdidos. Tres estudios asignaron como tercer medicamento a Efavirenz (EFV) en ambos brazos. Un estudio asignó aleatoriamente, además de TDF/FTC o ABC/3TC a EFV o Atazanavir/ritonavir (ATV/r). Un estudio más asignó como tercer medicamento a ATV/r. Finalmente, un estudio asignó como tercer medicamento a Lopinavir/ritonavir (LPV/r) y uno más realizó la asignación aleatoria con el esquema completo, ABC/3TC más Dolutegravir (DTG) o TDF/FTC más EFV.
En la Tabla 1 se presentan las características basales de los pacientes para cada estudio
| Estudio | Publicación | Medicamentos utilizados | Número pacientes asignados | Edad (Mediana) | Hombres (Porcentaje) | Carga viral (Log10) | CD4 (recuento/µL) | |
|---|---|---|---|---|---|---|---|---|
| ABC/3TC vs TDF/FTC 1 | Moyle G, Europa, 2013 (31) | ABC/3TC o TDF/FTC. Todos acompañados con EFV | ABC/3TC | 195 | 38 (19-70) | 83% | 5.01 (2.88-6.78) | 240 (10-610) |
| Post F, Europa, 2010 (32) | ||||||||
| TDF/FTC | 197 | 36 (18-66) | 80% | 5.12 (3.31-6.75) | 230 (10-600) | |||
| Stellbrink H, Europa, 2010 (20) | ||||||||
| ABC/3TC vs TDF/FTC 2 | Nishijima T, Japón, 2013 (33) | ABC/3TC o TDF/FTC. Todos acompañados de ATV/r | ABC/3TC | 54 | 39 (28.8-44) | 98.1% | 4.29 (3.92-4.67) | 236.5 (194.0-301.3) |
| TDF/FTC | 55 | 35 (29-42) | 98.2% | 4.28 (3.86-4.6) | 269 (177-306) | |||
| ABC/3TC vs TDF/FTC 3 | Sax P. Estados Unidos, 2009 (34) | ABC/3TC o TDF/FTC acompañados de EFV o ATV/r | ABC/3TC Efavirenz | 465 | 37 (31 - 45) | 79% | 4.7 (4.3-5.0) | 225 (103-324) |
| Daar E. Estados Unidos, 2011 (35) | ABC/3TC Atazanavir/ritonavir | 463 | 38 (30-45) | 84% | 4.6 (4.3-5.1) | 236 (72-346) | ||
| Wyatt C, Estados Unidos, 2014 (36) | TDF/FTC Efavirenz | 464 | 39 (31-44) | 85% | 4.7 (4.4-4.9) | 234 (103-334) | ||
| McComsey G, Estados Unidos, 2011 (37) | TDF/FTC Atazanavir/ritonavir | 465 | 39 (31-46) | 83% | 4.7 (4.3-5.1) | 224 (87-327) | ||
| ABC/3TC vs TDF/FTC 4 | Walmsley S. Norteamérica, Europa, Australia. 2013 (38) | ABC/3TC más Dolutegravir | 422 | 36 (18-68) | 84% | 4.67 | 334.5 | |
| TDF/FTC más Efavirenz | 422 | 35 (18-85) | 85% | 4.7 | 339 | |||
| ABC/3TC vs TDF/FTC 5 | Smith K, Estados Unidos, 2009 (39) | ABC/3TC más Lopinavir/ritonavir | 347 | 38 | 84% | 4.9 | 214 | |
| TDF/FTC más Lopinavir/ritonavir | 347 | 38 | 80% | 4.8 | 193 | |||
| ABC/3TC vs AZT/3TC | DeJesus E, Estados Unidos, Europa, Sur y Centro América, 2004 (40) | ABC o AZT. Todos recibiendo además Lamivudina y Efavirenz | ABC/3TC | 327 | 35 (17-74) | 80% | 4.81 (2.29-5.88) | 267 (37-1,883) |
| AZT/3TC | 327 | 35 (20-74) | 82% | 4.76 (1.95-5.88) | 258 (25-1,198) | |||
| AZT/3TC vs TDF/FTC | Nicolas A. Europa, Estados Unidos. 2009 (41) | AZT/3TC o TDF/FTC. Todos acompañados de EFV | AZT/3TC | 258 | 37 | 87% | 5 | 241 |
| Pozniak A. Europa, Estados Unidos. 2006 (42) | ||||||||
| Arribas J. Europa, Estados Unidos. 2008 (43) | TDF/FTC | 259 | rowspan="2"36 | 86% | 5 | 233 | ||
| Gallant J. Europa, Estados Unidos. 2006 (44) | ||||||||
| El estudio corresponde a la comparación evaluada y publicación corresponde a las publicaciones que pertenecían al mismo estudio. Los datos, de acuerdo a lo descrito en los estudios se presentan en medianas con su rango intercuartil, en las casillas que este no se presenta se debe a que no se encontró en la publicación. | ||||||||
Síntesis de los resultados
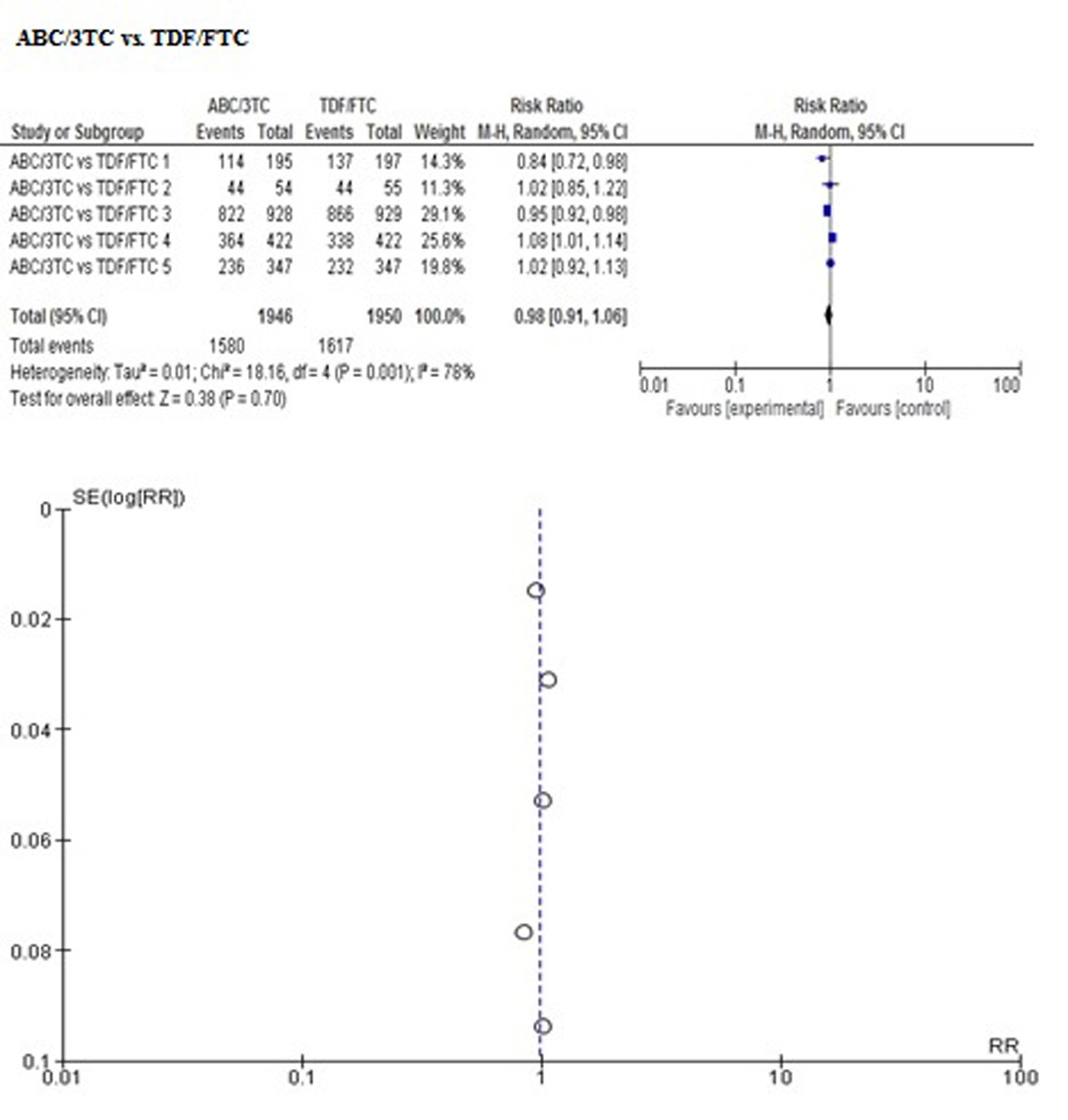
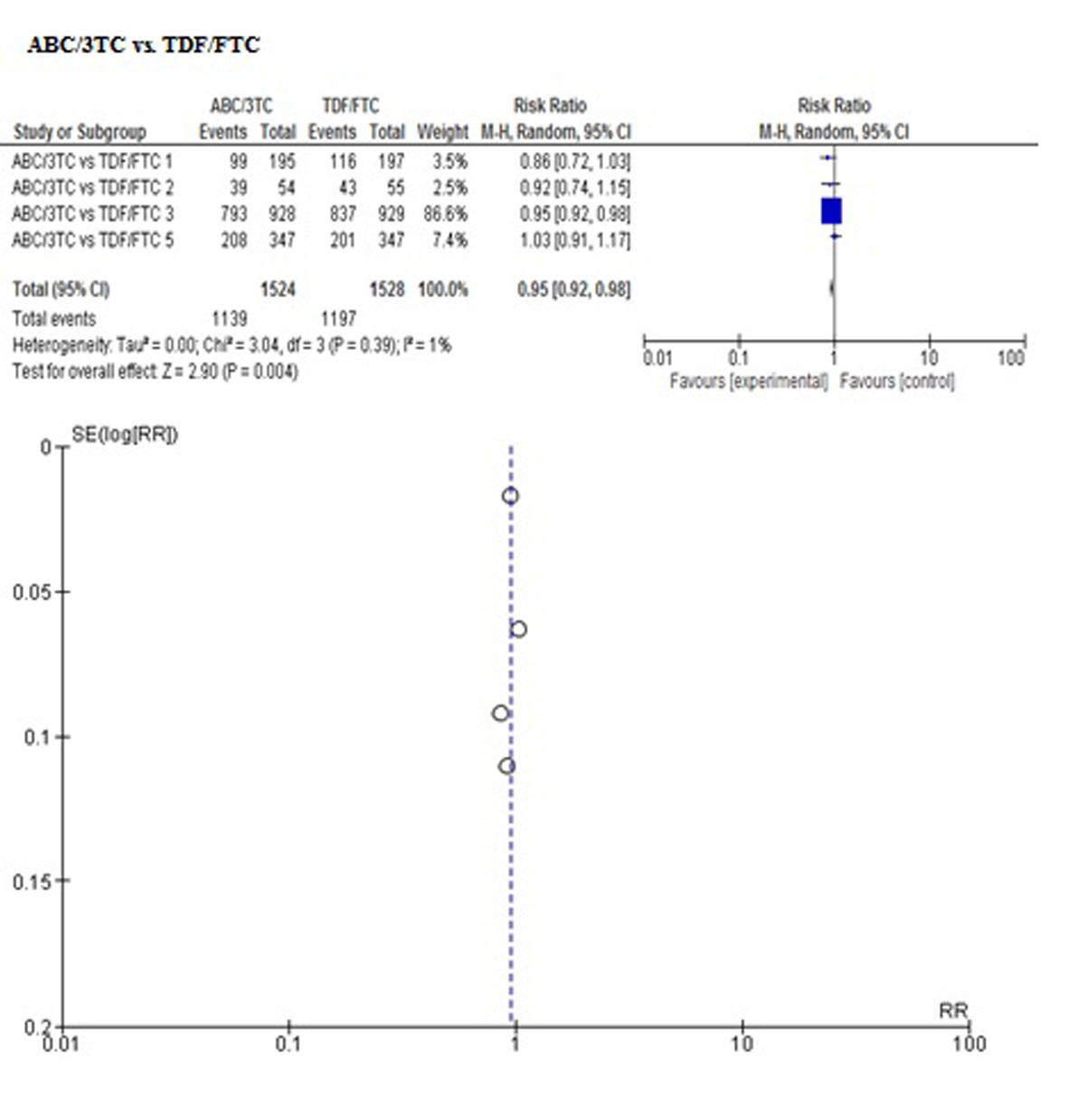
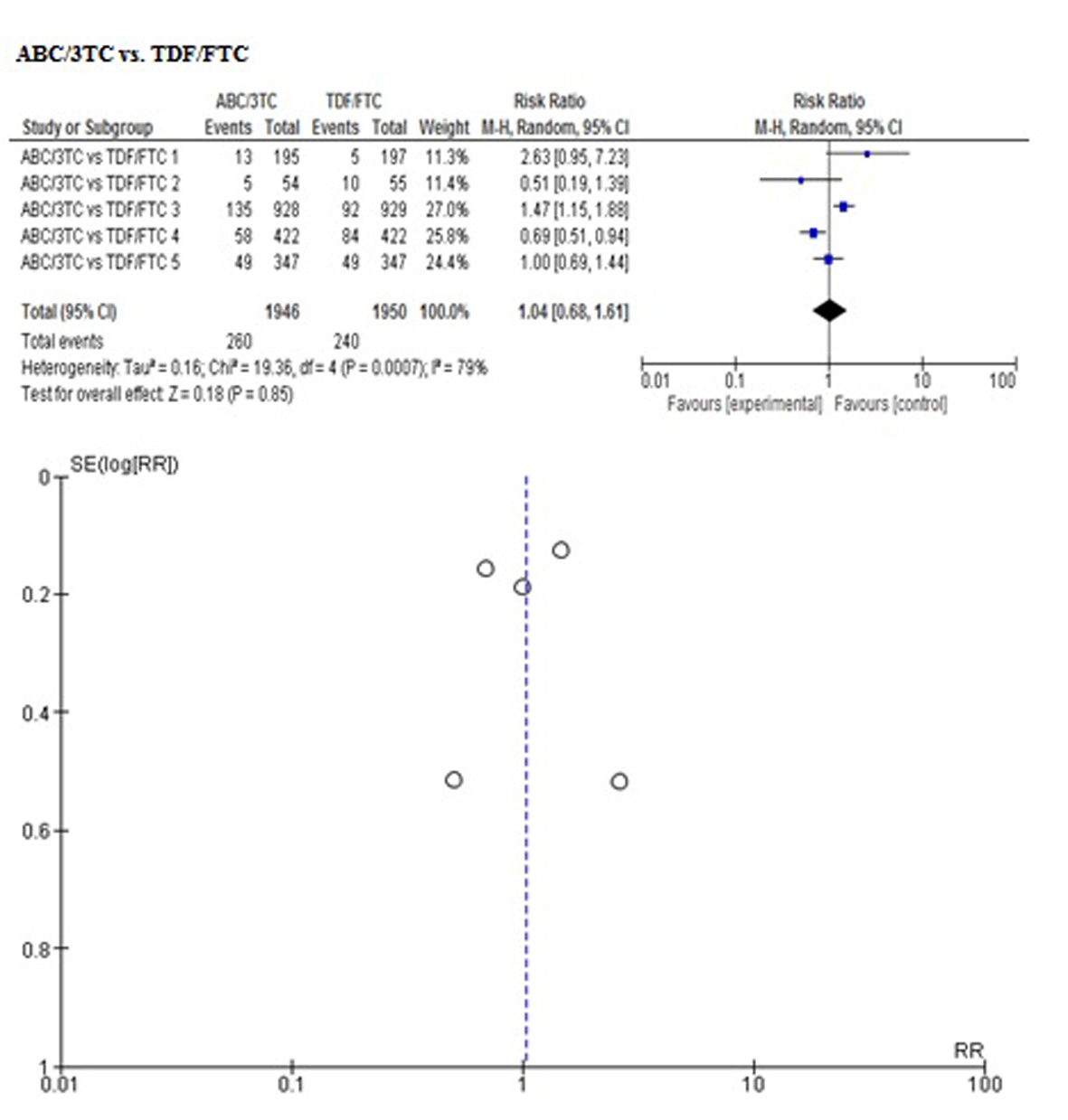
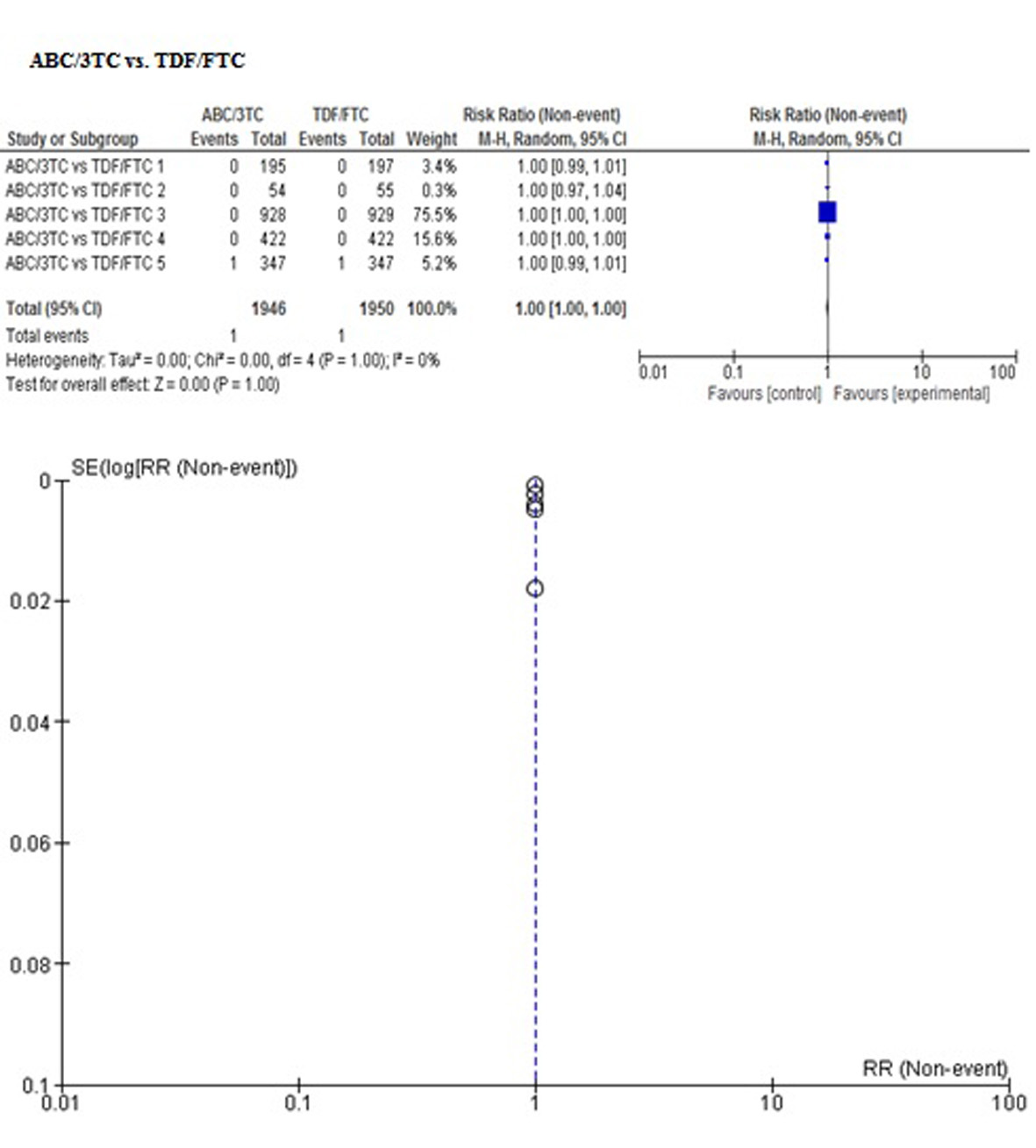
Los resultados de las comparaciones directas se presentan en las Tablas 2 y 3. No se encontraron diferencias en cuanto a mortalidad en ninguna de las comparaciones. Sólo un estudio reportó el desenlace de progresión clínica a SIDA, sin encontrar diferencias entre ABC/3TC y AZT/3TC.
| Desenlace estudiado | ||||
|---|---|---|---|---|
| Comparación | Progresión clínica a sida | Proporción de pacientes con carga viral <50 copias/mL a las 48 semanas | Proporción de pacientes con carga viral >50 copias/mL a las 96 semanas | Falla virológica |
| ABC/3TC vs TDF/FTC | No se encontraron datos | 0.98 (0.91-1.06) I² 78% | 0.95 (0.92-0.98) I² 1% | 1.04 (0.68-1.61) I² 79% |
| ABC/3TC vs AZT/3TC | 1.6 (0.53-4.84) | 1.01 (0.91-1.12) | Sólo tiene reporte a las 48 semanas | 1.54 (0.78-3.04) |
| AZT/3TC vs TDF/FTC | No se encontraron datos | 0.88 (0.79-0.98) | 0-91 (0.80 - 1.04) | 1.18 (0.94-1.49) |
| El estadístico I² se calculó sólo para la comparación ABC/3TC vs TDF/FTC, cuyos resultados se deducen de la realización de metanálisis con el método de efectos aleatorios. Las demás comparaciones sólo tenían un estudio en la comparación directa y el resultado se deduce de los datos extraídos del mismo. | ||||
| Desenlace estudiado | ||||
|---|---|---|---|---|
| Comparación | Mortalidad 96 semanas | Reacciones de hipersensibilidad | Proporción de pacientes con nuevos casos de infarto agudo del miocardio o evento cerebrovascular agudo | Supresión de médula ósea |
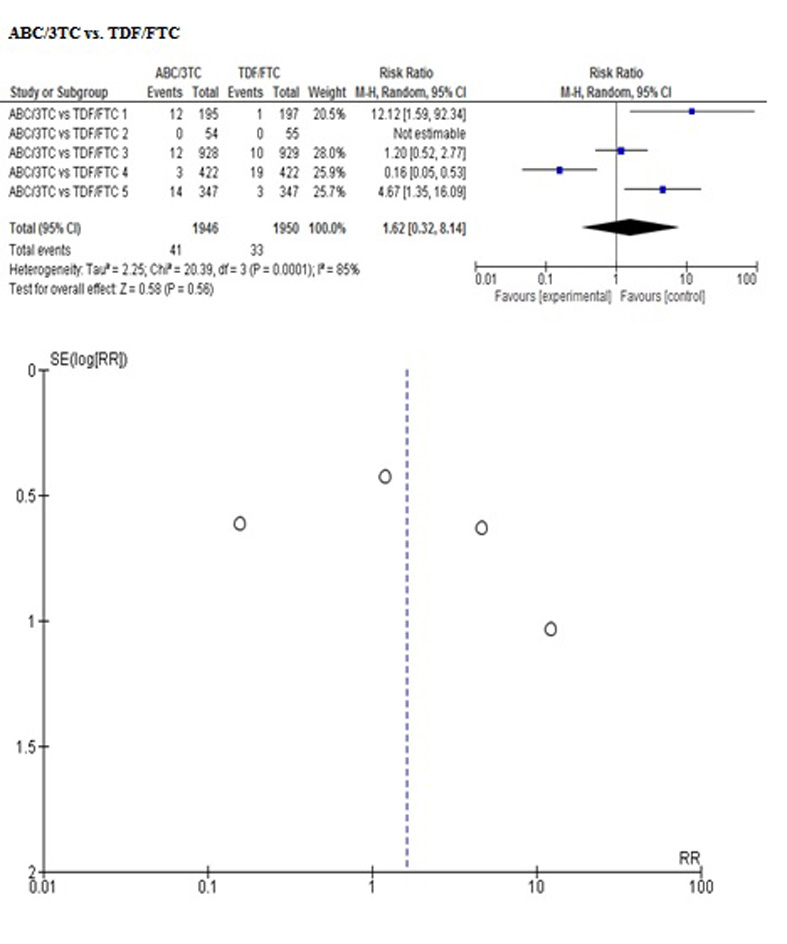
| ABC/3TC vs TDF/FTC | 1.00 (0.99-1.00) I² 20% | 1.62 (0.32-8.14) I² 85% | 1 (1-1) I² 0% | 1 (1-1) I² 0% |
| ABC/3TC vs AZT/3TC | No reportaron muertes | 9,33 (2.87-30.4) | 1.00 (0.02-50.25) | 0.41 (0.17-0.98) |
| AZT/3TC vs TDF/FTC | 1,33 (0.3-5.88) | 1,2 (0.53-2.72) | 1.00 (0.02-50.02) | 2.36 (1.42-3.92) |
| El estadístico I² se calculó sólo para la comparación ABC/3TC vs TDF/FTC, cuyos resultados se deducen de la realización de metanálisis con el método de efectos aleatorios. Las demás comparaciones sólo tenían un estudio en la comparación directa y el resultado se deduce de los datos extraídos del mismo. | ||||
Con respecto a los desenlaces lipodistrofia, anormalidades renales, osteopenia/osteoporosis, tampoco fueron reportados en todos los estudios, o se hizo con medición del desenlace por diferentes métodos de laboratorio o clínicos y en la mayoría no se tuvieron en cuenta al total de los pacientes asignados sino a una subpoblación, que decidimos no analizar por el riesgo de sesgo al perder la asignación adecuada de las variables confusoras.
Análisis de subgrupos
En las Tablas 4, 5, 6y 7 se presentan los resultados de los análisis realizados por subgrupos, de acuerdo con el valor de carga viral basal y tercer fármaco. No se realizaron metanálisis porque en cada comparación solo había un estudio. En las comparaciones directas no se encontraron diferencias estadísticamente significativas entre los tratamientos luego de diferenciar por estos subgrupos.
| Comparación | 48 semanas | 96 semanas |
|---|---|---|
| ABC/3TC vs TDF/FTC | 0.80 (0.64-1.00) | 0.90 (0.70-1.15) |
| ABC/3TC vs AZT/3TC | 1.00 (0.83-1.19) | Resultados a 48 semanas |
| AZT/3TC vs TDF/FTC | * | * |
| * No reportan eventos diferenciados por carga viral | ||
| Comparación | 48 semanas | 96 semanas |
|---|---|---|
| ABC/3TC vs TDF/FTC | 0.85 (0.70-1.04) | 0.83 (0.63-1.09) |
| ABC/3TC vs AZT/3TC | 1.01 (0.89-1.15) | Resultados a 48 semanas |
| AZT/3TC vs TDF/FTC | * | * |
| * No reportan eventos diferenciados por carga viral | ||
| Comparación | 48 semanas | 96 semanas |
|---|---|---|
| ABC/3TC vs TDF/FTC | 1.03 (0.86-1.24) | 0.94 (0.76-1.16) |
| ABC/3TC vs AZT/3TC | * | * |
| AZT/3TC vs TDF/FTC | * | * |
| * No se encontraron datos para medir el desenlace | ||
| Carga viral >100,000 copias/mL | Carga viral <100,000 copias/mL | ||||
|---|---|---|---|---|---|
| Comparación | 48 semanas | 96 semanas | Comparación | 48 semanas | |
| ABC/3TC vs TDF/FTC | 0.97 (0.83-1.12) | 0.97 (0.81-1.15) | 1.03 (0.88-1.19) | 1.08 (0.90-1.30) | |
| ABC/3TC vs AZT/3TC | * | * | * | * | |
| AZT/3TC vs TDF/FTC | * | * | * | * | |
| * No hubo comparaciones con Lopinavir/Ritonavir | |||||
Comparaciones indirectas
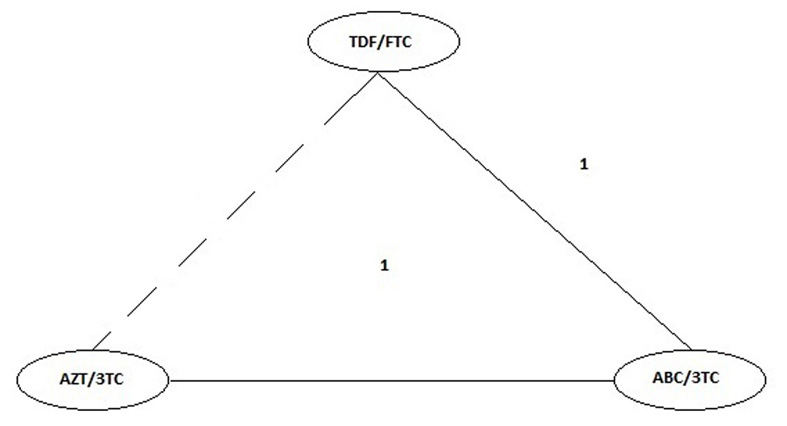
Se pudieron obtener resultados para realizar una comparación indirecta entre AZT/3TC vs TDF/FTC por medio del comparador común ABC/3TC cuando el tercer fármaco fue EFV, para el desenlace proporción de pacientes con carga viral <50 copias/mL a las 48 semanas. Para esta comparación no hubo comparaciones directas en este subgrupo, por lo cual la geometría de la red varía con respecto a la inicialmente planteada (Fig. 4). Esta comparación cumplió el principio de transitividad en cuanto a los factores modificadores del efecto nivel de carga viral basal y tercer medicamento. Al no poder realizar comparaciones mixtas (por ausencia de comparaciones directas luego del análisis de subgrupos, entre AZT/3TC y TDF/FTC, no se calculó el factor de inconsistencia. Aunque el metanálisis que se hizo de la comparación directa ABC/3TC vs TDF/FTC presentó alta heterogeneidad estadística (I²= 78%) mediante el análisis de subgrupos sólo se obtuvieron datos de un estudio con esta comparación directa, lo que permitió realizar las comparaciones indirectas basados en un estudio que comparó ABC/3TC con TDF/FTC y un estudio que comparó ABC/3TC vs AZT/3TC (Tabla 8).
Figura 4
Red final de evidencia para el metanálisis. Los números entre los nodos equivalen a la cantidad de estudios que compararon en forma directa las intervenciones unidas por la línea. Las líneas continuas corresponden a comparaciones directas, la línea discontinuas corresponden a la comparación indirecta realizada.
| Carga viral >100,000 copias/mL | Carga viral <100,000 copias/mL | |
|---|---|---|
| Comparaciónes directas | ||
| ABC/3TC vs TDF/FTC | 0.80 (0.64-1.00) | 0.85 (0.70-1.04) |
| ABC/3TC vs AZT/3TC | 1.00 (0.83-1.19) | 1.01 (0.89-1.15) |
| Comparación indirecta | ||
| TDF/FTC vs AZT/3TC | 1.25 (0.94-1.67) | 1.19 (0.94-1.50) |
Evaluación de sesgos de reporte
Con el fin de controlar los sesgos de reporte se desarrolló la búsqueda de información de acuerdo al protocolo establecido. Además se realizó inspección visual de sesgo del informe mediante gráfico de embudo para cada desenlace (se adjuntan las Figuras en el Anexo 2), observando simetría en todos, pero sin poder realizar pruebas para asimetría por el número de estudios incluidos, entre 4 a 5 en cada metanálisis realizado en la comparación directa ABC/3TC vs TDF/FTC.
Discusión
Resumen de la evidencia
Los resultados obtenidos en este metanálisis sugieren diferencias significativas en cuanto a los desenlaces de efectividad (proporción de pacientes con carga viral < 50 copias/mL) cuando se evaluaron comparaciones directas entre ABC/3TC vs TDF/FTC a las 96 semanas o AZT/3TC vs TDF/FTC a las 48 semanas, en favor de TDF/FTC. Sin embargo, todas las comparaciones se evaluaron mediante análisis de subgrupos, pues la revisión de las características basales en cada estudio, dejó claro que existían diferencias en cuanto al tercer medicamento utilizado, lo cual generó heterogeneidad clínica que no permitió concluir estos resultados como válidos inicialmente.
De la misma manera, reportes en estudios realizados con los medicamentos evaluados reportaron que existían diferencias en los desenlaces de acuerdo al nivel de carga viral del paciente, previo al inicio del tratamiento.
Mediante estos análisis se encontró que en las comparaciones directas de ABC/3TC vs TDF/FTC y ABC/3TC vs AZT/3TC, cuando el tercer fármaco fue EFV (con carga viral mayor y menor de 100.000 copias/mL), no hubo diferencias significativas en cuanto al desenlace de respuesta virológica a las 48 y 96 semanas. Estas comparaciones permitieron realizar una comparación indirecta entre TDF/FTC y AZT/3TC a las 48 semanas, que tampoco reportó diferencias significativas en el mismo desenlace a las 48 semanas.
De igual manera, no se encontraron diferencias significativas entre ABC/3TC y TDF/FTC cuando el tercer fármaco fue ATV/r o LPV/r. Sólo un estudio reportó un grupo expuesto a DTG como tercer fármaco sin poder obtener un comparador.
La forma de presentar los desenlaces en uno de los estudios (ABC/3TC vs TDF/FTC 3) no permitió extraer el número de pacientes expuestos y con el evento, lo cual pudo haber aumentado el total de pacientes y obtener otras conclusiones o darle mayor soporte a las ya obtenidas.
Se obtuvieron diferencias significativas en cuanto a algunos efectos adversos, específicamente supresión de médula ósea que afecta a AZT/3TC por tener mayor riesgo de presentarlo en comparación con TDF/FTC o ABC/3TC o reacciones de hipersensibilidad con ABC/3TC frente a AZT/3TC.
Los metanálisis en red se apoyan para su desarrollo adecuado en la asignación aleatoria de los ensayos clínicos que comparan las intervenciones médicas en forma directa. Lo anterior compromete un supuesto de similitud, mediante el cual sólo deben combinarse estudios si se considera que son clínica y metodológicamente similares. En los metanálisis en red las covariables que actúan como modificadoras del efecto, deben ser similares entre los estudios, la evidencia directa debe ser consistente con la evidencia indirecta y la evaluación de este supuesto debe basarse inicialmente en el juicio clínico sobre cómo afectan las diferencias la validez de este tipo de comparaciones 30. Lamentablemente, con los datos disponibles y la falta de cumplimiento de los supuestos de transitividad y homogeneidad, sólo fue posible realizar una comparación indirecta para un solo desenlace estudiado.
Se analizó la posibilidad de evaluar la heterogeneidad entre los estudios mediante metarregresión y análisis de sensibilidad, sin embargo, teniendo en cuenta la escasez de datos al disminuir el número de estudios potencialmente comparables de acuerdo con los factores de modificadores del efecto y a la variabilidad en las medidas resumen utilizadas en cada estudio, no fue necesario explorarla más allá del análisis de subgrupos, pues al realizarlo sólo quedó uno o ningún estudio para cada comparación.
Limitaciones
Si bien existe una gran cantidad de estudios que evalúan las intervenciones analizadas en esta revisión, pocos cumplieron con los criterios de elegibilidad para incluirse en este metanálisis de ensayos clínicos controlados y los mismos presentaron heterogeneidad en cuanto a la selección del tercer medicamento y en cuanto a los desenlaces estudiados o la definición de los mismos. De igual manera se encontraron potenciales sesgos en los mismos, específicamente en cuanto al cegamiento de los evaluadores o investigadores de la asignación de los pacientes.
Es importante tener en cuenta que los estudios incluidos en la revisión tienen resultados a 48 y 96 semanas, lo cual no da información más allá de este tiempo, y conocerla es fundamental para una enfermedad en la cual se pretende que la persona que la padece mantenga el control de la misma y una adecuada calidad de vida durante muchos años.
Al mismo tiempo, los estudios reportaron sus desenlaces con tipos de mediciones que variaron entre los mismos o con definiciones que no fueron similares en algunos desenlaces, lo que limitó la extracción de datos para los análisis estadísticos. Además, se planteó un número amplio de desenlaces para evaluar la seguridad de los esquemas revisados, lo cual generó varios desenlaces negativos al no encontrarse suficiente información en los estudios incluidos y los que lo hicieron, correspondieron a subestudios con un número de pacientes menor a los que recibían la asignación aleatoria en el estudio inicial, sin poder tomar de una manera válida estos resultados pues no se podía asegurar una adecuada distribución de variables de confusión entre los grupos comparados. Se planteó a partir de esta limitación, realizar en un futuro, un nuevo metanálisis de datos individuales, con solicitud y autorización de los autores de los estudios, con el fin de estandarizar las medidas de desenlace y poder realizar obtener datos con menor heterogeneidad y poder explorar la misma mediante técnicas como la metarregresión y/o el análisis de sensibilidad.
Otra limitación es que las guías de tratamiento actual establecen como tercer medicamento recomendado fármacos diferentes a los presentados en esta revisión y que si bien esta recomendación se basa en ensayos clínicos con asignación aleatoria, dicha asignación se realizó a partir del tercer fármaco dejando la asignación de los inhibidores de transcriptasa reversa a criterio del evaluador lo que no permitió incluirlos en esta revisión para evitar potenciales sesgos de asignación y con variables de confusión.
Por último, todos los estudios tuvieron como característica basal la realización de genotipificación previa al inicio del tratamiento, examen que permite conocer la presencia de mutaciones de resistencia a los medicamentos y con esto proveer al paciente un esquema de tratamiento con baja probabilidad de fallar por resistencia del virus. En Colombia, la guía actual no contempla la realización de este examen en este momento, sino cuando se presente la primera falla virológica, situación que limita la generalizabilidad de los resultados de los estudios analizados en nuestro país o en países donde se presente la misma situación.
Conclusiones
Consideramos que si bien, los resultados obtenidos no muestran diferencias entre los esquemas evaluados en cuanto a desenlaces de eficacia, las limitaciones discutidas previamente no permiten que estos datos sean definitivos. Los resultados plantean la necesidad de realizar nuevos estudios que ayuden a mejorar las recomendaciones de tratamiento en los pacientes infectados por el VIH, como ensayos clínicos, con una adecuada distribución de los factores modificadores del efecto entre los grupos comparados, así como evaluar la realización de una nueva revisión sistemática con metanálisis al nivel del dato individual, con el respectivo permiso de los investigadores de los estudios incluidos o modelar los resultados en el tiempo futuro mediante técnicas estadísticas adecuadas.
Referencias
Gottlieb MS. Pneumocystis pneumonia Los Angeles 1981. Am J Public Health. 2006;96(6):980–981 | |
CDC. Current trends update on acquired immune deficiency syndrome (AIDS) United States. MMWR. 1982;31(37):513–514 | |
Piot P, Quinn TC. Response to the AIDS pandemic a global health model. N Engl J Med. 2013;368(23):2210–2218 | |
Panel on Antiretroviral Guidelines for Adults and Adolescents. Guidelines for the use of antiretroviral agents in HIV-1-infected adults and adolescents. Department of Health and Human Services; http://aidsinfo.nih.gov/ContentFiles/Adultand AdolescentGL.pdf | |
World Health Organization. Consolidated Guidelines on the use of Antiretroviral Drugs for Treating and Preventing HIV Infection. Recommendations for a public health aproach. Geneva, Switzerland: WHO; 2016 | |
European AIDS Clinical Society. Guidelines. Version 8.0. 2015. http://www.eacsociety.org/files/guidelines_8_0-english_web.pdf | |
Ministerio de la Protección Social. Modelo de gestión programática en VIH-SIDA. Editorial Scripto Ltda: Bogotá; 2006 | |
Ministerio de la Protección Social. Guía para el manejo de VIH-SIDA basada en la evidencia. Ministerio de la Protección Social; Bogotá, Colombia: 2006 | |
Ministerio de Salud y Protección Social; Fondo de Población de las Naciones Unidas. Guía de práctica clínica (GPC) basada en la evidencia científica para la atención de la infección por VIH - Sida en adolescentes (con 13 años o más de edad) y adultos. GPC-2014-39. 2014. Bogotá: Ministerio de Salud y Protección Social; | |
Benetucci J, Bissio E, Bologna R, Bruno M, Cahn P, Casetti I, et al. Guía para el manejo de los pacientes adultos con infección por VIH. Ministerio de Salud; Argentina. Buenos Aires: 2013 | |
Ministerio de Salud. Guía clínica AUGE. Síndrome de la Inmunodeficiencia Adquirida VIH-SIDA. (Serie Guías Clínicas MINSAL ). Santiago de Chile: Ministerio de Salud; 2013 | |
Campbell TB, Smeaton LM, Kumarasamy N, Flanigan T, Klingman KL, Firnhaber C. Efficacy and safety of three antiretroviral regimens for initial treatment of HIV-1 a randomized clinical trial in diverse multinational settings. PLoS Med. 2012;9(8):e1001290 | |
Spaulding A, Rutherford G, Siegfried N. Tenofovir or zidovudine in three-drug combination therapy with one nucleoside reverse transcriptase inhibitor and one non-nucleoside reverse transcriptase inhibitor for initial treatment of HIV infection in antiretroviral-naïve individuals (Review). Cochrane database Syst Rev. 2010;10:Art No CD008740 | |
Ford N, Shubber Z, Hill A, Vitoria M, Doherty M, Mills EJ. Comparative efficacy of Lamivudine and emtricitabine a systematic review and meta-analysis of randomized trials. PLoS One. 2013;8(11):e79981 | |
Smith KY, Patel P, Fine D, Bellos N, Sloan L, Lackey P. Randomized, double-blind, placebo-matched, multicenter trial of abacavir/lamivudine or tenofovir/emtricitabine with lopinavir/ritonavir for initial HIV treatment. AIDS. 2009;23:1547–1556 | |
Tan DHS, Chan K, Raboud J, Cooper C, Montaner JSG, Walmsley S. Comparison of abacavir/lamivudine and tenofovir/emtricitabine among treatment-naive HIV-infected patients initiating therapy. J Acquir Immune Defic Syndr. 2011;58:38–46 | |
Sax PE, Tierney C, Collier AC, Daar ES, Mollan K, Budhathoki C. Abacavir/lamivudine versus tenofovir DF/emtricitabine as part of combination regimens for initial treatment of HIV final results. J Infect Dis. 2011;204:1191–1201 | |
Post F, Moyle GJ, Stellbrink HJ, Domingo P, Podzamczer D, Fisher M. Randomized comparison of renal effects, efficacy, and safety with once-daily abacavir/lamivudine versus tenofovir/emtricitabine, administered with efavirenz, in antiretroviral-naive, HIV-1-infected adults 48-week results from the ASSERT study. J Acquir Immune Defic Syndr. 2010;55:49–57 | |
Gallant JE, Winston JA, DeJesus E, Pozniak AL, Chen S-S, Cheng AK. The 3-year renal safety of a tenofovir disoproxil fumarate vs a thymidine analogue-containing regimen in antiretroviral-naive patients. AIDS. 2008;22:2155–2163 | |
Stellbrink H-J.Orkin C.Arribas JR.Compston J.Gerstoft J.van Wijngaerden E. Comparison of changes in bone density and turnover with abacavir-lamivudine versus tenofovir-emtricitabine in HIV-infected adults 48-week results from the ASSERT study. Clin Infect Dis. 2010;51(8):963–972 | |
Haskelberg H, Hoy JF, Amin J, Ebeling PR, Emery S, Carr A. Changes in bone turnover and bone loss in HIV-infected patients changing treatment to tenofovir-emtricitabine or abacavir-lamivudine. PLoS One. 2012;7(6):e38377 | |
Centro Cochrane Iberoamericano. Manual Cochrane de revisiones sistemáticas de intervenciones, versión 5.1.0. 2012. Barcelona: entro Cochrane Iberoamericano; | |
Jansen JP, Fleurence R, Devine B, Itzler R, Barrett A, Hawkins N. Interpreting indirect treatment comparisons and network meta-analysis for health-care decision making Report of the ISPOR task force on indirect treatment comparisons good research practices: Part 1. Value Heal. 2011;14:417–428 | |
Castro KG, Ward JW, Slutsker L, Buehler JW, Jaffe HW, Berkelman RL. 1993 revised classification system for HIV infection and expanded surveillance case definition for AIDS among adolescents and adults. MMWR Recomm Rep. 1992;41(RR-17):1–19 | |
Centers for Disease Control and Prevention. Revised Surveillance Case Definitions for HIV Infection Among Adults , Adolescents , and Children Aged < 18 Months and for HIV Infection and AIDS Among Children Aged 18 Months to < 13 Years - United States , 2008. MMWR. 2008;57(RR-10):1–8 | |
Shlay JC, Sharma S, Peng G, Gibert CL, Grunfeld C. Long-Term Subcutaneous Tissue Changes Among Antiretroviral_Naive Persons Initiating Stavudine, Zidovudine, or Abacavir With Lamivudine. J Acquir Immune Defic Syndr. 2008;48:53–62 | |
Jansen JP, Naci H. Is network meta-analysis as valid as standard pairwise meta-analysis It all depends on the distribution of effect modifiers. BMC Med. 2013;11:159 | |
Wells GA, Sultan SA, Chen L, Khan M CD. Indirect evidence: Indirect treatment comparisons in meta-analysis. 2009. Ottawa: Canadian Agency for Drugs and Technologies in Health; | |
Tobías A, Catalá-López F, Roqué M. Desarrollo De Una Hoja Excel Para Metaanálisis De Comparaciones Indirectas Y Mixtas. Rev Esp Salud Publica. 2014;88:5–15 | |
Hoaglin DC, Hawkins N, Jansen JP, Scott DA, Itzler R, Cappelleri JC. Conducting indirect-treatment-comparison and network-meta-analysis studies Report of the ISPOR task force on indirect treatment comparisons good research practices: Part 2. Value Heal. 2011;14:429–437 | |
Moyle GJ, Stellbrink HJ, Compston J, Orkin C, Arribas JR, Domingo P. 96-Week results of abacavir/lamivudine versus tenofovir/emtricitabine, plus efavirenz, in antiretroviral-naive, HIV-1-infected adults ASSERT study. Antivir Ther. 2013;18:905–913 | |
Post FA, Moyle GJ, Stellbrink HJ, Domingo P, Podzamczer D, Fisher M. Randomized comparison of renal effects, efficacy, and safety with once-daily abacavir/lamivudine versus tenofovir/emtricitabine, administered with efavirenz, in antiretroviral-naive, HIV-1-infected adults 48-week results from the ASSERT study. J Acquir Immune Defic Syndr. 2010;55:49–57 | |
Nishijima T, Takano M, Ishisaka M, Komatsu H, Gatanaga H, Kikuchi Y. Abacavir/Lamivudine versus Tenofovir/Emtricitabine with Atazanavir/Ritonavir for Treatment-naive Japanese Patients with HIV-1 Infection A Randomized Multicenter Trial. Intern Med. 2013;52:735–744 | |
Sax PE, Tierney C, Collier AC, Fischl M, Mollan K, Peeples L. Abacavir-lamivudine versus tenofovir-emtricitabine for initial HIV-1 therapy. N Engl J Med. 2009;361:2230–2240 | |
Daar ES, Tierney C, Fischl M, Sax PE, Mollan K, Budhathoki C. Atazanavir Plus Ritonavir of Efavirenz as part of a 3-Drug Regimen for Initial Treatment of HIV-1 A Randomized Trial. Ann Intern Med. 2011;154(7):445–456 | |
Wyatt CM, Kitch D, Gupta SK, Tierney C, Daar ES, Sax PE. Changes in proteinuria and albuminuria with initiation of antiretroviral therapy data from a randomized trial comparing tenofovir disoproxil fumarate/emtricitabine versus abacavir/lamivudine. J Acquir Immune Defic Syndr. 2014;67:36–44 | |
McComsey a G, Kitch D, Sax PE, Tebas P, Tierney C, Jahed NC. Peripheral and central fat changes in subjects randomized to abacavir-lamivudine or tenofovir-emtricitabine with atazanavir-ritonavir or efavirenz ACTG study A5224s. Clin Infect Dis. 2011;53(2):185–196 | |
Walmsley SL, Antela A, Clumeck N, Duiculescu D, Eberhard A, Gutiérrez F. Dolutegravir plus abacavir-lamivudine for the treatment of HIV-1 infection. N Engl J Med. 2013;369:1807–1818 | |
Smith KY, Patel P, Fine D, Bellos N, Sloan L, Lackey P. Randomized, double-blind, placebo-matched, multicenter trial of abacavir/lamivudine or tenofovir/emtricitabine with lopinavir/ritonavir for initial HIV treatment. AIDS. 2009;23:1547–1556 | |
DeJesus E, Herrera G, Teofilo E, Gerstoft J, Buendia CB, Brand JD. Abacavir versus zidovudine combined with lamivudine and efavirenz, for the treatment of antiretroviral-naive HIV-infected adults. Clin Infect Dis. 2004;39:1038–1046 | |
Margot N, Enejosa J, Cheng AK, Miller MD, McColl DJ. Development of HIV-1 drug resistance through 144 weeks in antiretroviral-naïve subjects on emtricitabine, tenofovir disoproxil fumarate, and efavirenz compared with lamivudine/zidovudine and efavirenz in study GS-01-934. J Acquir Immune Defic Syndr. 2009;52:209–221 | |
Pozniak AL, Gallant JE, DeJesus E, Arribas JR, Gazzard B, Campo RE. Tenofovir disoproxil fumarate, emtricitabine, and efavirenz versus fixed-dose zidovudine/lamivudine and efavirenz in antiretroviral-naive patients virologic, immunologic, and morphologic changes--a 96-week analysis. J Acquir Immune Defic Syndr. 2006;43:535–540 | |
Arribas JR, Pozniak AL, Gallant JE, Dejesus E, Gazzard B, Campo RE. Tenofovir Disoproxil Fumarate, Emtricitabine, and Efavirenz compared with Zidovudine/Lamivudine and Efavirenz in Treatment-Naive Patients 144-Week Analysis. J Acquir Immune Defic Syndr. 2008;47:74–78 | |
Gallant JE, DeJesus E, Arribas JR, Pozniak AL, Gazzard B, Campo RE. Tenofovir DF, emtricitabine, and efavirenz vs zidovudine, lamivudine, and efavirenz for HIV. New Engl J Med. 2006;354(3):251–260 |
Appendices
Anexo 1
| PubMed Search Line | |
| 1 | HIV(MeSH) OR HIV-1(MeSH) OR HIV Infections(MeSH) |
| 2 | Abacavir(tiab) OR lamivudine(tiab) OR tenofovir(tiab) OR emtricitabine(tiab) OR zidovudine(tiab) |
| 3 | 1 and 2 |
| 4 | 3 and systematic(sb) |
| 5 | HIV-1(MeSH) |
| 6 | 5 and 2 |
| 7 | 6 and (randomized controlled trial(pt) OR controlled clinical trial(pt) OR randomized(tiab) OR placebo(tiab) OR drug therapy(sh) OR randomly(tiab) OR trial(tiab) OR groups(tiab)) NOT (animals (mh) NOT humans (mh)) |
| EMBASE Search Line | |
| 'human immunodeficiency virus'/exp and ('abacavir'/exp or 'lamivudine'/exp or 'tenofovir'/exp or 'emtricitabine'/exp or 'zidovudine'/exp) and ((cochrane review)/lim or (systematic review)/lim or (controlled clinical trial)/lim or (randomized controlled trial)/lim or (metaanalysis)/lim) | |
| Cochrane Search Line | |
| HIV + (abacavir OR lamivudine OR tenofovir OR emtricitabine OR zidovudine) | |