En el año 2015 la revista Science escogió la tecnología CRISPR-Cas9 como el avance tecnológico más importante en los últimos años de la ciencia 1. Es esta revista se anunció el inicio de una nueva era de la biotecnología en la que se podría editar, corregir y modificar la información genética de cualquier célula de una manera factible, rápida, barata, y lo más importante, con una alta precisión. Su implementación en los laboratorios de investigación en ciencias básicas y aplicadas podría ayudar a desarrollar estrategias terapéuticas en el área de la salud con el objetivo principal de sanar enfermedades con un origen genético conocido y que hasta ahora no han podido ser curadas.
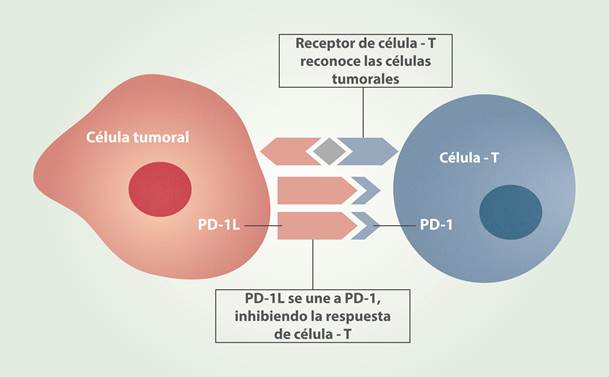
No pasó mucho tiempo desde este anuncio, cuando la revista Nature sorprendió a la comunidad científica, al publicar el 15 de noviembre 2016, que investigadores de la Universidad de Sichuan, China, lograron inyectar por primera vez, en un paciente con cáncer de pulmón, linfocitos genéticamente modificados como una estrategia terapéutica para promover la respuesta del sistema inmune y así eliminar las células tumorales malignas 2. Para lograr este objetivo, el gen que codifica la proteína PD-1, (Programmed Death-1), fue apagado con la tecnología CRISPR-Cas9, por lo que se espera que la acción del sistema inmune mediado por los linfocitos en contra del cáncer sea más efectiva. Aunque ya existen tratamientos aprobados para el cáncer de pulmón, en donde la proteína PD-1 es bloqueada por inmunoterapia, se espera que la inactivación del gen PD-1 sea una estrategia terapéutica con mayor eficiencia y estabilidad (Fig 1).
Figura 1
Las células tumorales pueden inhibir la respuesta inmune del organismo mediante la unión a proteínas en la superficie de las células T, tales como PD-1. La tecnología CRISPR-Cas9 que desactiva el gen PD-1 reactiva la respuesta inmune.
¿Pero en que consiste este novedoso avance tecnológico CRISPR-Cas9, y como logra inactivar mutaciones cancerígenas? La historia de CRISPR-Cas9 se inició en 1987, cuando un grupo de científicos Japoneses de la Universidad de Osaka, Japón, estudiando la información genética presente en las bacterias reportaron el hallazgo de unas secuencias de ADN repetidas pero sin ninguna función aparente 3. Años después, en 1993, de forma independiente el grupo del investigador Juan Francisco Martínez Mojica de la Universidad de Alicante, España, reportaron el mismo hallazgo pero en genomas de arqueas, y describieron las secuencias como repetitivas y palindrómicas, las cuales estaban separadas entre sí mediante unas secuencias espaciadores y contaban con una secuencia líder en su inicio 4. Martínez et al., llamaron a estas secuencias CRISPRs (Clustered Regularly Interspaced Short Palindromic Repeats) 5.
Al analizar las secuencias CRISPR los investigadores se dieron cuenta de su similitud con secuencias de bacteriófagos y plásmidos, y además que, se encontraban ubicadas cerca a los genes cas, los cuales codifican para un tipo de nucleasas con capacidad de cortar y degradar ADN exógeno en sitios específicos de la secuencia. Lo anterior, llevó a concluir que las secuencias CRISPR podían ser parte de un novedoso sistema de defensa de los procariotas en contra de la invasión de agentes virales y plásmidos. Este sistema está conformado por una proteína Cas unida a un ARN procedente de las secuencias CRISPR, el cual se le llamó complejo CRISPR-Cas, y que se activa con la presencia de ADN foráneo de bacteriófagos o plásmidos invasivos, el cual reconoce y degrada 6.
Estas observaciones fueron comprobadas posteriormente, con el nuevo hallazgo de que las proteínas Cas que conforman el complejo, no solo eran capaces de cortar el ADN foráneo, sino que además, podían integrar un pequeño fragmento del ADN foráneo digerido dentro de las secuencias CRISPR, y de esta forma, adquirir un memoria inmune para futuros ataques por el mismo tipo de virus. Así, el complejo CRISPR-Cas es en realidad un sistema inmune adaptativo de defensa de los procariotas, el cual se podía transmitir a la descendencia (7, 8).
Años después, en 2012, un equipo de investigadores liderado por Jennifer Doudna de la Universidad de California en Berkeley y Emmanuelle Charpentier de la Universidad de Umea, plantearon la posibilidad de modificar y implementar el complejo CRISPR-Cas para aplicarlo como herramienta biotecnológica para la edición "programable" de genomas, que se pudiera cortar de manera específica una cadena de ADN in vitro con fines terapéuticos 9. Para poder llevar a cabo esta idea, los investigadores diseñaron un protocolo que contiene tres pasos básicos. El primero consiste en el diseño y síntesis de una molécula de ARN de una solo hebra, denominada ARN guía, la cual puede unirse a la enzima Cas9, y que cumple con las mismas características moleculares de las secuencias CRISPR, es decir, que es capaz de reconocer y unirse a una secuencia específica del ADN o un gen que se quiera editar o corregir. Una vez obtenido el ARN guía unido a Cas9, el segundo paso consiste en introducir in vitro el complejo CRISPR-Cas9 a la célula que se va a tratar, y una vez dentro, el complejo reconocerá el sitio exacto del genoma donde la enzima Cas9 debe cortar (Fig. 2).
Figura 2
Edición de genes por CRISPR-Cas9 utilizando la reparación de unión final no homóloga (NHEJ) y la reparación dirigida por homología (HDR).
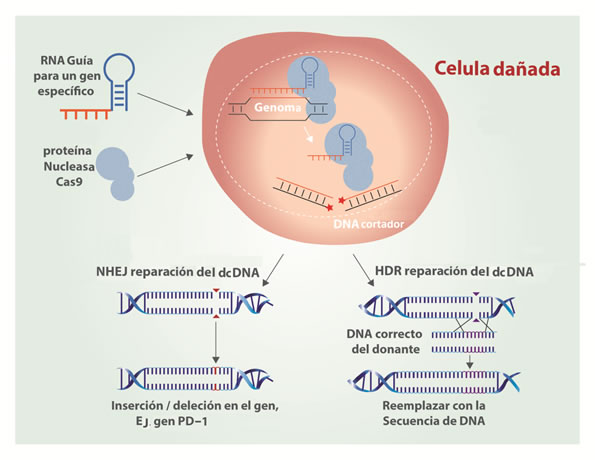
El tercer paso se inicia con la activación de los mecanismos de reparación de la célula, en respuesta al corte que realizó la endonucleasa Cas9, lo que puede ocasionar la pérdida o adición de información genética en la región del genoma que se desea editar. Esto puede conllevar a la pérdida de la función original del gen, dando lugar a una inactivación o un mal funcionamiento de la proteína que codifica. Si el objetivo es reemplazar las mutaciones cancerígenas, a este último paso se le pueden incorporar algunos cambios por una información genética correcta. Este procedimiento consiste en adicionar una molécula de ADN molde homóloga de la región que se quiere editar y que no contenga las mutaciones cancerígenas. Mediante la activación de un sistema de reparación por recombinación homóloga se reemplaza el fragmento del ADN previamente reconocido y tratado por el complejo CRIPR-Cas9 10.
Entre los objetivos del estudio publicado en Nature donde se evaluará si el tratamiento con la tecnología CRISPR-Cas9 es efectivo contra el cáncer de pulmón, se encuentra comprobar la seguridad del ensayo clínico en los pacientes 11. En el ensayo clínico se pretende tratar solo a 10 pacientes con 3 regímenes de dosis diferentes, los cuales serán seguidos con el fin de monitorear algún tipo de efecto adverso en las células linfocíticas modificadas. En la fase I del ensayo clínico que se viene desarrollando por el equipo científico del doctor Lu You, oncólogo en el Sichuan University's West China Hospital, están participando pacientes con cáncer de pulmón de células no pequeñas con metástasis que presentaron una reincidencia del cáncer después de la terapia inicial o fueron refractarios a la quimioterapia luego del tratamiento. En el procedimiento, a los pacientes se les extrajeron linfocitos de la sangre para ser tratados con el sistema de edición genómica CRISPR-Cas9 para inhabilitar el gen que codifica para la proteína PD-1. A las células linfocíticas en las que se logró inhibir la expresión del gen PD-1, se les analizó su viabilidad y linfoproliferacion para descartar la aparición de nuevas mutaciones por el tratamiento. A continuación, los linfocitos fueron transfundidos a un solo paciente, al cual se le está realizando seguimiento a la espera que las células modificadas lleguen al tejido tumoral y activen una respuesta inmunitaria contra las células del cáncer. Entre los riesgos que existen por el tratamiento terapéutico con la tecnología CRIPR-Cas9, es que se pueda presentar una respuesta autoinmune excesiva. Aunque la información disponible sobre los avances del proyecto es positiva, ya que el paciente no ha presentado efectos adversos, y además, se planea inyectar una segunda dosis de linfocitos modificados, aun se deben esperar los resultados finales del estudio pionero en la tecnología CRISPR-Cas9 para la inhibición de genes en pacientes con cáncer. Igualmente, se deben realizar más estudios que evalúen la seguridad de la tecnología y la posible aparición de efectos adversos.
La tecnología de edición de genes CRISPR-Cas9 por ahora es la mejor apuesta para alcanzar una cura terapéutica efectiva a las enfermedades de origen genético como algunos tipos de cáncer; pero, en el futuro el desarrollo de estas herramientas aumentará los usos potenciales y la población que pueda ser beneficiada. Por esta razón se hace prioritario el desarrollo de pautas éticas para la investigación y aplicación clínica de la edición de genes en humanos con el propósito de prevenir el riesgo ético con el uso de estas herramientas. En particular, se requiere mayor estudio sobre los riesgos de la edición de genes con fines eugenésicos, generar inequidad al mejorar características físicas, intelectuales o cosméticas y la trasmisión a la descendencia de los genes editados. La ética tiene que discutirse haciendo la distinción entre las investigaciones de edición de genes en células somáticas, en células germinales o en embriones humanos.
En este sentido, la comunidad científica realizó en diciembre del 2015 una reunión internacional denominada "International Summit on Human Gene Editing" 12, en la cual participaron las academias de ciencias, ingeniería y medicina de los Estados Unidos, el Reino Unido, y China, en donde se discutieron las precauciones que se deben tener para la implementación de técnica CRISPR-Cas9 en las investigaciones con seres humanos. En la reunión presentaron sus puntos de vista los investigadores proponentes de la técnica y científicos que habían aplica la técnica en embriones humanos, además, participaron científicos y filósofos con preparación en bioética y abogados conocedores de leyes de patentes. Las conclusiones más importantes del evento fueron la necesidad de establecer normas legales, éticas y de seguimiento para la realización de investigación básica y preclínica de edición de genes en humanos, y el uso de la técnica en células somáticas para aplicaciones clínicas, y con ciertas restricciones, en células de la línea germinal o embriones, por lo menos hasta obtener la información suficiente sobre la seguridad y la eficacia de la misma. En este último punto se recomendó seguir la discusión y estandarización de las normas referentes a un uso aceptable de las técnicas de edición de genes en la línea germinal humana con fines terapéuticos a nivel mundial. Sin embargo, recientemente, el comité de ética de la agencia de investigación Biomédica de Francia (INSERM) sentó su postura al respecto y recomendó la prohibición de todas las modificaciones genéticas de la línea germinal 13. Además, propuso la creación de un comité europeo de expertos de diferentes disciplinas para evaluar el alcance, la eficacia y la seguridad de CRISPR-Cas9, y de un grupo de seguimiento de las partes interesadas para promover el debate abierto sobre los aspectos sociales de estas tecnologías.