Proceso para el desarrollo de una vacuna contra la fase hepática de Plasmodium vivax
Sócrates Herrera, M.D.1, Leonardo Victoria, M.D.2, Olga Fernández, B.Sc.2, Anilza Bonelo, Ph.D.3, Blanca Liliana Perlaza, Ph.D.2 Constanza Zapata, B.Sc.2, Deidre Overgaaw, M.D.4, Mauricio León, M.D.2, Edna Galindo, M.D.2, Nayibe Valencia, B.Sc.2, Lina María Acuña, M.D.2, Gustavo Quintero, M.D.V.5, Nora Restrepo, Ph.D.6, Juan Diego Vélez, M.D.7, Fabián Méndez, M.D., Ph.D.8, Adriana Villegas, B.Sc.9, Giampietro Corradin, Ph.D.10, Myriam Arévalo-Herrera, Ph.D.11
1. Profesor Titular, Director del Instituto de Inmunología, Facultad de Salud, Universidad del Valle, Cali. e-mail: sherrera@inmuno.org
2. Investigador Asociado, Centro Internacional de Vacunas, Cali. e-mail: leovic@inmuno.org
3. Profesora, Departamento de Microbiología, Escuela de Ciencias Básicas, Facultad de Salud, Universidad del Valle, Cali. e-mail: abonelo@inmuno.org
4. Investigador Asociado, Universidad de Groningen, Holanda. e-mail: Overgaaw@inter.NL.net
5. Investigador Asociado, Fundación Centro de Primates, Cali. e-mail: gquintero@inmuno.org
6. Docente, Facultad de Química, Universidad de Antioquia, Investigador Asociado, Medellín. e-mail: norestre@matematicas.udea.edu.co
7. Investigador Asociado, Fundación Clínica Valle del Lili, Cali. e-mail: jdvelez@telesat.com.co
8. Profesor Asistente, Escuela de Salud Pública, Facultad de Salud, Universidad del Valle, Cali. e-mail: fmendez@inmuno.org
9. Bacterióloga, Laboratorio Asoclinic, Cali. e-mail: avillegas@inmuno.org
10. Investigador Asociado, Instituto de Bioquímica de Lausana, Suiza.
11. Profesora Titular, Escuela de Bacteriología y Laboratorio Clínico, Facultad de Salud, Universidad del Valle, Cali. e-mail: marevalo@inmuno.org
Recibido para publicación marzo 19, 2004 Aprobado para publicación enero 28, 2005
RESUMEN
INTRODUCCION: Anualmente se producen en el mundo entre 80 y 100 millones de casos de malaria ocasionada por Plasmodium vivax, segunda especie de Plasmodium en importancia a nivel mundial y primera en el continente americano. Ante la falla de los métodos clásicos de control de la malaria, derivada de la creciente resistencia de los mosquitos a los insecticidas y de los parásitos a los medicamentos disponibles, se ha trabajado intensamente en la búsqueda de vacunas que puedan prevenir completamente la infección o limitar los efectos patológicos de la enfermedad.
OBJETIVOS: Este trabajo describe el proceso de desarrollo de una vacuna experimental dirigida contra las formas pre-eritrocíticas del parásito, para lo cual se ha seleccionado la proteína circumesporozoito (CS) que se expresa de forma abundante en la superficie del parásito y que se halla comprometida en el proceso de invasión hepática.
METODOLOGÍA: El proceso consistió en una exhaustiva caracterización inmunológica de la proteína, mediante péptidos sintéticos de diferente longitud, seguida de pruebas de toxicidad e inmunogenicidad en animales con los tres péptidos largos que cubren las regiones N, R y C de la CS. Como etapa inicial de la prueba en humanos, se hizo un ensayo clínico fase I que probó la seguridad e inmunogenicidad, de cada uno de los péptidos formulados en el adyuvante Montanide ISA-720. El ensayo fue al azar, doble ciego y comprometió a 23 voluntarios sanos, hombres y mujeres entre 18 y 33 años de edad, sin historia de malaria.
CONCLUSIONES: La vacuna fue muy bien tolerada y demostró buena seguridad e inmunogenicidad en los ensayos preclínicos así como en todos los voluntarios, facilitando el avance a ulteriores fases de investigación clínica.
Palabras claves: P. vivax; Malaria; Vacunas, Estadíos pre-eritrocíticos; Ensayos clínicos.
SUMMARY
INTRODUCTION: Plasmodium vivax causes approximately 80-100 million clinical cases every year. It is the most prevalent human malaria parasite in the American continent and its prevalence is second only to P. falciparum worldwide. Due to the emergence of medication-resistant parasites and an increase in insecticide-resistant mosquitoes, research to find a vaccine that could prevent or limit the clinical manifestations of the disease has increased greatly. During the last two decades, significant progress has been achieved in this attempt; however, the development of a P. vivax vaccine has been hampered due to the lack of sustainable in vitro parasite cultures.
OBJECTIVES: We describe the development and testing of a vaccine to P. vivax pre-erythrocytic stages. We selected the circumsporozoite (CS) protein, an antigen abundantly expressed on the parasite surface.
METHODOLOGY: After extensive immunological characterization in vitro, three long peptides (N, R and C) were synthesized, and the toxicity and immunogenicity of these peptides were thoroughly assessed in animals. To determine the safety and immunogenicity in humans, a randomized, double blind clinical trial was conducted. The trial included 23 healthy volunteers who received 100 µg of N, R and C of each peptide formulated in Montanide ISA-720 adjuvant.
CONCLUSIONS: The vaccination was well tolerated and proven to be safe in both animals and volunteers; thus, additional clinical trials utilizing this vaccine candidate are indicated.
Key words: P. vivax; Malaria; Vaccine; Pre-erythrocytic stages; Clinical trials.
La malaria representa una de las enfermedades infecciosas de mayor prevalencia en el mundo. A pesar de que el número real de casos está probablemente subestimado, la Organización Mundial de la Salud (OMS), calcula que cada año se producen por lo menos 500 millones de casos clínicos en todo el mundo1.
Plasmodium vivax ocupa el segundo lugar en términos de prevalencia de casos de malaria después de P. falciparum, y es responsable de una alta tasa de morbilidad estimada en cerca de 100 millones de casos al año, principalmente en regiones de Asia y América Latina2. La enfermedad genera una importante incapacidad física, como consecuencia de la fiebre, el escalofrío, la sudoración, la adinamia, y demás síntomas clásicos de la malaria; también se caracteriza por recidivas periódicas.
La gran mortalidad y morbilidad ocasionadas por P. falciparum y P. vivax, así como los problemas derivados de la resistencia del parásito a los medicamentos antimaláricos y la resistencia de los mosquitos a los insecticidas, se suman a las serias limitaciones en la aplicación sistemática de las medidas de control; lo cual ha llevado a considerar que la vacunación sería la estrategia con mayor balance costo-beneficio para el control de la enfermedad.
Las siguientes evidencias sustentan la factibilidad del desarrollo de una vacuna antimalárica:
1. En áreas con malaria, estable o inestable, alta o baja endemia, los individuos expuestos a la transmisión de malaria por períodos largos, presentan una disminución del riesgo de muerte y de complicaciones severas de la enfermedad3,4;
2. En estos individuos se observan casos de malaria asintomática y una reducción notable de la parasitemia3;
3. Los individuos no-inmunes reducen significativamente su parasitemia luego de la transferencia pasiva de anticuerpos provenientes de pacientes inmunes a la malaria4
4. La inmunización experimental con esporozoitos atenuados con radiación, induce una protección completa contra la infección. Sin embargo, producir vacunas basadas en parásitos atenuados, representa un reto técnicamente difícil de afrontar5.
Por estas razones, se ha aprovechado el acceso a técnicas de biología molecular y síntesis peptídica, para la identificación y prueba de antígenos parasitarios que representan un potencial como vacunas6. En los últimos cinco años, se han hecho grandes progresos en la prueba de moléculas candidatas derivadas de los diferentes estadios de P. falciparum7, así como de combinaciones de las mismas. Desde hace dos años, luego de la publicación del genoma de P. falciparum8 y de los progresos en el estudio de su proteoma9 se viene aplicando una promisoria estrategia para la selección de epítopes relevantes en el desarrollo de vacunas, que combina los análisis genómicos y proteómicos10. En el caso de P. vivax, debido a las restricciones que impone la falta de métodos de cultivo in vitro, este progreso ha sido más limitado.
El desarrollo de una vacuna funcional contra la malaria por P. vivax enfrenta numerosas dificultades biológicas, técnicas y económicas. Primero, este Plasmodium tiene un genoma estimado en 30 Mb, que se distribuye en 14 cromosomas, con un total aproximado de 5,000 a 6,000 genes que aún no han sido secuenciados en su totalidad11. Por analogía con P. falciparum, este genoma daría lugar a la expresión de un proteoma que está fuera del alcance de las capacidades técnicas existentes para su análisis. El complejo metabolismo de P. vivax y su preferencia por células inmaduras (reticulocitos) ha dificultado el desarrollo de técnicas de cultivo que permitan la producción de material parasitario en las concentraciones requeridas para lograr un mayor avance en su análisis químico e inmunológico. Adicionalmente, en vista de su bajo índice de mortalidad, se destinan muy pocos recursos a promover la investigación en esta especie, a pesar de que la morbilidad es significativa y que en la mayoría de las regiones donde la malaria es endémica, existe la presencia simultánea de P. falciparum y P. vivax. En estas comunidades, las vacunas antimaláricas que se han de aplicar, deberían poseer simultáneamente elementos constitutivos de las dos especies del parásito de manera que se impida la selección de una de ellas y un potencial desequilibrio epidemiológico. En estas condiciones, se impone la necesidad de desarrollar vacunas polivalentes, que reduzcan la transmisión y prevalencia de las dos especies de parásito y, en forma ideal, contra todas las que afectan al ser humano.
Actualmente existen alrededor de 12 candidatos a vacuna contra la malaria que se evalúan en ensayos clínicos, cuatro de ellos derivados de la proteína CS de P. falciparum o combinaciones de esta proteína con otros antígenos no maláricos12,13. En P. vivax, hasta el momento, sólo existen tres candidatos a vacuna evaluados en voluntarios humanos, los péptidos sintéticos derivados de la proteína CS descritos en este estudio, una proteína recombinante que corresponde aproximadamente al 70% de la proteína CS14 y la proteína Pvs25, derivada de los estadios de ooquinetos/ooquistes que se desarrollan en el intestino del mosquito. La función de esta última sería bloquear la transmisión de malaria del ser humano al mosquito15.
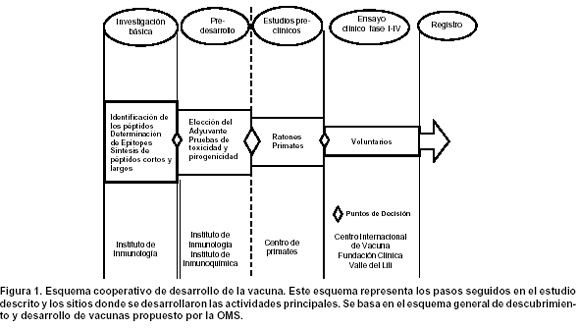
Durante más de una década, el grupo de Cali ha concentrado sus esfuerzos en crear la infraestructura para el desarrollo de una vacuna contra la fase hepática de P. vivax, que requiere de un proceso que ya está bien definido por la Organización Mundial de la Salud (OMS)16. Este proceso se inicia con una fase de búsqueda de nuevas moléculas candidatas a vacuna, que se estudian subsecuentemente en ensayos pre-clínicos donde hay pruebas in vitro, análisis de potencia y pruebas in vivo en modelos animales (roedores y primates), con el propósito de seleccionar aquellos antígenos más promisorios para su evaluación en ensayos clínicos. Estos últimos se desarrollan en cuatro fases progresivas (I-IV)16, de cuyo éxito depende que las vacunas se puedan registrar para su comercialización y uso masivo en comunidades endémicas o en riesgo de malaria. Aquí se describe parte del proceso, seguido en el desarrollo de una vacuna contra la fase hepática de Plasmodium, desde la búsqueda del antígeno hasta la fase I de ensayos clínicos (Figura 1).
MATERIALES Y MÉTODOS
Inmunógenos péptidos sintéticos. Se sintetizaron múltiples péptidos de distinta longitud y secuencia, correspondientes a la proteína CS, con la técnica F-moc de fase sólida17. Inicialmente se sintetizaron 28 péptidos de 20 aminoácidos, traslapados en 10 residuos cada uno (p1 a p28), que abarcan la totalidad de la proteína. Después se sintetizaron 6 péptidos de 9-10 residuos con los epítopes CD8+ y 3 péptidos largos (N, R, C) de más de 70 aminoácidos (aa). El péptido N corresponde al extremo amino (N-terminal) comprendido entre los aa 20-96 (76 aa). El péptido C cubre el extremo carboxilo (C-terminal), comprendido entre los aa 301-372 (71 aa) y el péptido R está conformado por tres repeticiones del péptido p11, localizado entre los aa 96-104 (27 aa) del dominio central de la proteína (CS secuencia común), unido en su extremo amino, a un epítope universal de células T (ptt-30) derivado de la toxina tetánica18. Los péptidos cortos se emplearon para caracterizar la proteína y los péptidos largos se utilizaron para medir el efecto de la vacunación en ensayos pre-clínicos en ratones y primates y en ensayos clínicos de fase I en seres humanos.
Calidad de los péptidos largos. Los péptidos largos se sintetizaron bajo las normas de “buenas prácticas de laboratorio” (Good Laboratory Practice, GLP) en el Instituto de Bioquímica de la Universidad de Lausana, Suiza19. Los análisis bioquímicos permitieron purificar cada uno de los péptidos por el método de cromatografía de alta resolución (HPLC)20 y asegurar la secuencia correspondiente de cada fragmento por el método de espectrometría de masas (MS)20. Los péptidos se empacaron en presentaciones individuales de 36 y 120 mg, en el Departamento de Farmacia del Hospital Cantonal Vaudoise de Lausana, Suiza, donde se realizaron las pruebas de esterilidad mediante análisis microbiológico de gérmenes aerobios y levaduras. Los análisis de pirogenicidad se realizaron por cinética de endotoxinas por métodos cromogénicos (USP 21,CFR 610.12, Guidelines for sterility testing for biologicals).
Estudios pre-clínicos de la vacuna
Toxicidad. Las pruebas de seguridad general las hizo el laboratorio LCG Bioscience en Turín, Italia. Se inmunizaron tres grupos de cinco ratones hembras de la cepa CD-1 BR y dos cobayos hembras, cepa Dunkin Hartley Albino (casa Charles River Italia S.p.A, via Independenza 11-23885 CALCO) cada uno con uno de los péptidos largos N, R o C.
Se realizó una inmunización intraperitoneal con 100 mg del péptido en 1 ml de solución salina, se evaluó la presencia de signos clínicos mediante la observación de cambios sistémicos y locales relacionados con toxicidad, alteraciones del comportamiento y mortalidad a los 30 minutos, 2, 4 y 6 horas después de la inmunización, continuando con las evaluaciones dos veces al día hasta completar seis días de observación. Todos los procedimientos siguieron los protocolos operativos estandarizados por la compañía LCG-Bioscience.
Pruebas de inmunogenicidad en animales de experimentación
Potencia. Los estudios de potencia de los péptidos se llevaron a cabo en 60 ratones BALB/c hembras de 3-4 semanas de edad, procedentes del bioterio del Instituto de Inmunología del Valle (MVDC-260901). Los ratones se inmunizaron vía subcutánea (SC) en la base de la cola, con cada uno de los tres péptidos N, R o C, derivados de la proteína CS de P. vivax. Los grupos de 20 ratones se distribuyeron en 5 subgrupos (A, B, C, D y E) y se les inmunizó con una sola dosis de 0.1, 0.3, 3, 10 ó 30 mg de cada uno de los péptidos en condiciones de laboratorio (Bench Quality, BQ) según las indicaciones de Buenas Prácticas de Laboratorio (BPL). Los títulos de anticuerpos contra cada uno de los péptidos sintéticos se midieron mediante la técnica de ELISA en los días 0, 15 y 30 post-inmunización. Se consideraron títulos positivos en diluciones del suero iguales o mayores a 1:100.
Inmunogenicidad en ratones. Se tomaron 12 ratones BALB/c hembras entre 3 y 4 semanas de edad, del bioterio del Instituto de Inmunología del Valle, y se distribuyeron en tres grupos. A cada grupo se le asignó su inmunización con uno de los tres péptidos N, C o R en tres dosis de 50 mg/péptido formulados en adyuvante de Freund en una proporción 50:50 con solución salina. De cada grupo se eligieron, dos animales para inmunizarlos por vía intraperitoneal (IP) y otros dos por vía SC en la base de la cola (BC). Dos de los cuatro ratones de cada grupo recibieron la primera dosis de inmunización con la mezcla de los péptidos N y C y las dos dosis siguientes con la mezcla de los tres péptidos (N, R y C) con el fin de que la respuesta inmune se iniciara contra los péptidos de las regiones flanqueantes de la proteína y luego una respuesta contra la región central (R), que, como se sabe, es altamente inmunogénica21. Se realizó medición de los títulos de anticuerpos contra cada uno de los péptidos en los días 0, 14, 35 y 42 mediante la técnica de ELISA.
Inmunogenicidad en primates. Los estudios de inmunogenicidad se realizaron en 24 monos Aotus lemurinus griseimembra machos o hembras de más de 800 g de peso, criados en la Fundación Centro de Primates en Cali. El protocolo correspondiente (código: 1106-04-382-98, CT-409-98) fue aprobado por el Comité de Ética Animal de la Universidad del Valle (FUCEP-070600). Los estudios de inmunogenicidad de los péptidos con secuencias potencialmente inductoras de citotoxicidad (CD8+)22 se hicieron en un grupo de 6 animales que se inmunizaron con 2 dosis de 100 mg de cada uno de los péptidos (PV 1, PV 3, PV 5 y PV 6) formulados en adyuvante de Freund, por vía subcutánea. A los Aotus se les sangró 4 ml antes de cada inmunización y 10 días después de la última, para determinar por el método ELISA, la producción de Interferón gamma (IFN-g ) en el sobrenadante del cultivo de linfocitos estimulados con el inmunógeno correspondiente.
La inmunogenicidad de los péptidos largos se determinó en tres grupos de 6 Aotus cada uno (Grupos A-C), vacunados por vía subcutánea en los días 0, 40 y 120. El grupo A estuvo constituido por 6 animales que se inocularon con 100 mg/dosis de la mezcla de los péptidos (N+R+C) formulados en el adyuvante Montanide ISA-720 para uso en seres humanos23. El grupo B constituido por 6 animales que recibieron el adyuvante de Freund considerado de referencia por su potencia, pero que no se puede usar en humanos por su toxicidad24. El grupo control C se inoculó con placebo (adyuvante mezclado con agua destilada). La inmunogenicidad de los péptidos se determinó mediante las técnicas ELISA después de cada inmunización e IFAT en los días 30 y 130 después de la última inmunización.
Estudios clínicos de la vacuna
Según los estándares de la OMS, en los ensayos clínicos de fase I se prueba la seguridad e inmunogenicidad del candidato a vacuna16. Estos estudios se realizaron bajo normas de Buenas Prácticas Clínicas (Good Clinical Practice, GCP), con un protocolo aprobado por el Comité de Ética Humana de la Universidad del Valle y de la Fundación Clínica Valle del Lili. Este estudio lo supervisó el Dr. R. Palacios, monitor clínico asignado por el Programa Especial de Investigación y Entrenamiento en Enfermedades Tropicales de la Organización Mundial de la Salud (TDR/OMS). Igualmente se asignaron 2 monitores externos de evaluación de datos, la Dra. G. Palma de Colciencias (Bogotá, Colombia) y el Dr. W. Rojas de la Corporación de Investigaciones Biológicas (CIB, Medellín, Colombia).
Sujetos humanos. Los voluntarios participantes en este estudio fueron 23 adultos jóvenes sin antecedentes de malaria, 16 hombres y 7 mujeres, que aceptaron voluntariamente por escrito, ser vacunados con los péptidos sintéticos largos derivados de la proteína CS de P. vivax, según el protocolo MVDC-2002-001. El tamaño de la muestra se calculó, por razones de conveniencia, en 7 individuos por péptido (N, R o C) y 2 individuos para el grupo control; sin embargo, este tamaño es el mínimo número necesario para obtener resultados significativos, si se supone que la ocurrencia de sucesos adversos es una situación rara.
La convocatoria de participación se hizo a través de afiches, conferencias y asesorías personalizadas. Las personas interesadas en participar firmaron el consentimiento informado para iniciar el proceso de selección, que consistió en una evaluación clínica completa y exámenes de laboratorio que incluyeron pruebas hematológicas, bioquímicas, inmunológicas, pruebas para descubrir enfermedades infecciosas como VIH (Abbott Axsym), sífilis (Organon Teknika) hepatitis B y C (Abbott Axsym), deficiencia de G6PD (Sigma) y determinación de anticuerpos antimaláricos21 con el fin de determinar el estado de salud, los antecedentes de exposición a malaria y la ausencia de algún tipo de alergia.
Una prueba de embarazo cuantitativa (Abbott Axsym) se practicó a las mujeres antes de cada inmunización y en los seguimientos programados. Durante este proceso, se seleccionó a los 23 voluntarios que cumplieron los criterios de inclusión como ser adultos sanos entre 18 y 33 años, usar métodos anticonceptivos durante el período del estudio, no viajar a zonas endémicas para malaria, no recibir otro tipo de vacuna, ser localizable durante el período del estudio y expresar por escrito su deseo de participar en el estudio mediante la firma del consentimiento informado. A cada sujeto se le explicó en forma clara, la libertad de retirarse en cualquier momento sin que esto implicara algún tipo de sanción o pérdida de los beneficios de participar en el estudio.
Esquema de inmunización y dosis. Los voluntarios se distribuyeron al azar en tres grupos de 7 personas para ser inmunizados con uno de los tres péptidos (N, R o C) formulados en el adyuvante Montanide ISA-720, respectivamente. Se asignaron como controles dos voluntarios en cada uno de los tres grupos y recibieron una mezcla del adyuvante Montanide ISA-720 con solución salina como placebo en una relación 3:7. La dosis del péptido sintético para cada inmunización fue de 100 mg, en un volumen final de 500 ml de cada una de las formulaciones. El esquema de vacunación consistió en tres inmunizaciones que se administraron en los meses 0, 2 y 6 aplicadas vía intramuscular en la región deltoidea, alternando los brazos para cada inyección. Con el fin de mantener la condición de doble ciego del estudio, ni los voluntarios, ni los investigadores, tuvieron acceso a la información sobre la asignación del péptido que se utilizó para cada voluntario.
Evaluación de seguridad. Los voluntarios se observaron durante una hora postinmunización, a cuyo término se les realizó un examen físico completo que incluyó la medición de talla, peso, toma de signos vitales y la evaluación de los sistemas otorrinolaringológico, cardiovascular, pulmonar, gastrointestinal y neurológico para garantizar el estado de salud y descubrir posibles reacciones adversas; además se hicieron nuevas evaluaciones a las 8 y 24 horas y 7 días postinmunización. Las visitas de seguimiento incluyeron un examen médico completo y pruebas paraclínicas, a saber: cuadro hemático completo, pruebas de coagulación, perfil hepático, pruebas de función renal, glicemia, anticuerpos antinucleares (ANA), que se llevaron a cabo en los meses 1, 2, 6 y 9 luego de administrar la primera dosis de la vacuna.
Evaluación de inmunogenicidad en humanos. Se efectuaron siete evaluaciones para determinar la respuesta inmune humoral. Los títulos de anticuerpos se midieron por el método ELISA contra su inmunógeno y por la prueba de inmunofluorescencia indirecta (IFAT) contra la proteína nativa, usando como antígeno esporozoitos de P. vivax con la proteína CS homóloga, procedentes de la Unidad de Entomología del Instituto de Inmunología según método descrito previamente25.
RESULTADOS
Inmunógenos . Los estudios de espectrometría de masas demostraron que todos los péptidos sintetizados con el método F-moc19 tenían la masa esperada. Para el caso de los péptidos largos sintetizados en condiciones BPL, los estudios de esterilidad y pirogenicidad fueron aprobados y certificados por la unidad de producción del Departamento de Farmacias del Hospital Cantonal Vaudoise de Lausana, Suiza.
Fase pre-clínica
Análisis de toxicidad. El uso de los péptidos (N, R y C) en los tres grupos experimentales no produjo efectos tóxicos sistémicos o locales, lo cual se estableció por la ausencia de mortalidad, cambios clínicos, alteraciones en el comportamiento de los animales (ratones y conejos), pérdida de peso o cambios en el sitio de la inoculación durante el período de observación. Análisis de potencia e inmunogenicidad en ratones y primates. Los estudios de potencia en ratones mostraron una respuesta de anticuerpos variable como se observa en la Figura 2, que osciló entre títulos de 1:100 a 1:500.000 siendo mayores los títulos obtenidos con los péptidos C y R en condiciones BQ; sin embargo, en todos los grupos de ratones se produjo respuesta de anticuerpos con dosis de 10 y 30 mg, independientemente de la calidad del péptido. Los ratones inmunizados con el péptido C, presentaron la mejor respuesta, pues se obtuvo aumento en los títulos con solo 3 mg de péptido con calidad BQ y de 10 mg del péptido BPL.
Los resultados de inmunogenicidad en ratones con los péptidos largos (Figura 3) demostraron que con una dosis más alta (50 mg), se logra incrementar la respuesta de anticuerpos (1:80.000-1:1.000.000). A excepción del grupo inmunizado intraperitonealmente (IP) con el péptido C terminal, el cual mostró una alta respuesta de anticuerpos, la mejor ruta de inmunización es la subcutánea (SC).
Los datos obtenidos de monos inmunizados con péptidos largos demostraron una buena seguridad cuando los mismos se formularon en Montanide ISA-720, e indicaron gran potencia inmunológica al administrarlos como formulaciones en adyuvante de Freund, que mostró la toxicidad esperada (granulomas cutáneos severos), que los hace inaceptables para el uso en seres humanos. En resumen, se observó una alta inmunogenicidad y el reconocimiento de la proteína nativa del parásito.
En cuanto a la inmunogenicidad de los péptidos cortos que contienen epítopes citotóxicos, como se observa en el Cuadro 1, los linfocitos de los Aotus inmunizados reconocieron los péptidos con estos epítopes y desencadenaron una elevada producción de IFN-g con rangos que variaban de 236-3,598 pg/ml, mientras que los niveles antes de la inmunización fueron de sólo 0-4 pg/ml.
Fase clínica
Selección de voluntarios. Se realizaron 12 reuniones (entre seminarios y talleres), a las que asistieron un total de 450 personas. En ellas se explicaron completamente los procedimientos, beneficios y riesgos de participar en el estudio. De este grupo, un total de 60 asistieron a sesiones de asesoría personalizada durante las cuales se atendieron preguntas adicionales y quienes decidieron participar en el estudio se convirtieron en voluntarios potenciales; de ellos 41 expresaron por escrito su deseo de participar al firmar el consentimiento informado. Durante la evaluación clínica se determinó que 13 personas presentaban algún criterio de exclusión; las restantes cumplieron con todos los criterios de inclusión, y de ellas, 5 decidieron retirarse voluntariamente. Al final del proceso de selección se incluyeron 23 personas como se muestra en la Figura 4. Un mes después de la primera dosis de inmunización, una de las personas se retiró del estudio debido a su necesidad de viajar a una zona endémica para malaria y se la reemplazó antes que al grupo restante se le administrara la segunda dosis de inmunización, cumpliendo satisfactoriamente todo el esquema de vacunación.
Seguridad general. Los análisis de seguridad demostraron que ninguno de los individuos presentó eventos adversos serios, definidos de acuerdo con los criterios comunes de toxicidad versión 2.0 DCTD, NCI, NIH, DHHS, marzo 1998. El esquema de vacunación se completó satisfactoriamente en los 23 voluntarios. Las inmunizaciones se relacionaron con la presencia de signos o síntomas leves, de los cuales el dolor en el sitio de inyección fue el más frecuente, la duración de este dolor nunca se informó más allá de las primeras 48 horas después de la inmunización, y en todos los casos los voluntarios coincidieron en afirmar que era similar al causado por cualquiera de las vacunas clásicas. El dolor no tuvo una relación directa con el péptido administrado. El hallazgo clínico que tuvo la mayor frecuencia en las evaluaciones post-inmunización, fue la presencia de edema leve, que se resolvió en todos los casos antes de 48 horas, sin relacionarse en ningún caso con el péptido administrado. Los seguimientos paraclínicos en el transcurso del estudio no mostraron alteraciones con respecto a la vacuna en ninguno de los casos.
Inmunogenicidad en voluntarios humanos. Los resultados preliminares de inmunogenicidad, medida por la respuesta de anticuerpos contra cada uno de los péptidos sintéticos que se utilizaron como inmunógenos en pruebas de ELISA, mostró un incremento de anticuerpos específicos contra cada uno de los péptidos largos los cuales oscilaron entre 1:200 y 1:6.400 (Cuadro 2), encontrándose títulos mayores contra los péptidos N y R. Para los tres péptidos largos, los títulos de anticuerpos alcanzados se sostuvieron durante el período de seguimiento hasta 3 meses después de la última inmunización, siendo más altos que los alcanzados por el grupo control (Cuadro 2). Más importante aún es que los sueros de los voluntarios inmunizados reconocieron la proteína nativa expresada en la superficie del esporozoito evaluado mediante la técnica de inmunofluorescencia (dato no presentado).
DISCUSIÓN
En el presente estudio se ha descrito el empleo de una amplia gama de facilidades establecidas conjuntamente entre el Instituto de Inmunología de la Universidad del Valle y el Centro Internacional de Vacunas (Cali, Colombia), que representa una infraestructura única para el desarrollo y prueba de vacunas contra la malaria. Por medio de esta infraestructura, con importantes ventajas comparativas, se ha establecido una agenda que incluye varias estrategias orientadas a acelerar el desarrollo de una vacuna multivalente eficaz contra las dos especies de malaria más comunes a nivel mundial. Tales estrategias comprenden, el análisis simultáneo de la inmunogenicidad de múltiples antígenos maláricos como candidatos potenciales contra la malaria causada tanto por P. falciparum como por P. vivax26, la identificación de epítopes relevantes en dichas proteínas21 y más recientemente una estrategia genómica para el desarrollo de vacunas de ADN.
En el presente trabajo se describe parcialmente el análisis de la proteína CS de P. vivax que ha se ha sometido a una cuidadosa caracterización inmunológica. La presencia de epítopes B, T-CD4+ y T-CD8+ a través de toda su secuencia ya se había definido antes21,27,28, y se ratificó para algunos de ellos en el presente estudio. La identificación de los mismos permitió utilizar la estrategia de síntesis química de péptidos largos con múltiples de estos epítopes capaces de complementarse en la inducción de una adecuada respuesta inmune humoral y celular. La técnica de síntesis de péptidos largos desarrollada por uno de nosotros (GC)20 , ha permitido la rápida producción de numerosos péptidos candidatos a vacuna en cantidades suficientes para pruebas preclínicas y clínicas; además, ésta técnica permite una fácil purificación sin riesgo de contaminantes naturales provenientes de cultivos celulares. Los resultados de las pruebas de toxicidad general de los péptidos en roedores y las pruebas de potencia inmunogénica de los mismos, indicaron la factibilidad de llevar a cabo estudios preclínicos en primates no humanos y ensayos clínicos en voluntarios humanos. Los primeros se realizaron con el fin de determinar:
a. La inmunogenicidad de péptidos reconocidos por células CD8+ humanas en monos Aotus y
b. La inmunogenicidad de combinaciones de los péptidos largos N, R y C en el mismo modelo animal.
Los linfocitos CD8+ juegan un importante papel en la protección contra la fase hepática de la malaria29 en la medida en que estas células tienen la capacidad de inducir la destrucción directa de hepatocitos infectados30 y la producción de IFN-g31,32 capaces de bloquear el desarrollo del parásito dentro del hepatocito33,34. Por otra parte, estos resultados son de gran importancia para confirmar la utilidad del modelo Aotus en estudios en malaria, pues los mismos permiten inferir que los epítopes CD8+ analizados, cuya respuesta en el humano esta restringida genéticamente por moléculas HLA-A2.1, son igualmente reconocidas por los linfocitos de Aotus, lo que permite suponer una homología entre las moléculas clase I de seres humanos y estos primates. El grupo de Cali en la actualidad analiza esta homología de manera sistemática. Los resultados de estudios previos hechos en Cali con la proteína de estadios hepáticos de P. falciparum, LSA-3, permiten suponer que los mecanismos de protección en Aotus y seres humanos son por lo menos parcialmente similares, lo que confirma el valor de este modelo experimental y permite acelerar el descubrimiento y análisis de nuevas moléculas con potencial para desarrollar vacunas de uso humano.
Además, debido a la alta inmunogenicidad del fragmento R21, la estrategia de inoculación inicial con los péptidos N y C seguida de la combinación N+R+C probada en Aotus, indicó que se puede generar una mejor respuesta contra los epítopes presentes en esa región y evitar la distracción en la respuesta por epítopes altamente inmunogénicos como el R22. En todos los casos, los anticuerpos inducidos por la inmunización de roedores y Aotus con estos péptidos largos que contienen epítopes B, reconocieron no sólo los inmunógenos, sino la proteína CS sobre esporozoitos, indicando que la estructura de esos epítopes se conserva en los péptidos sintéticos y simula la estructura de la proteína nativa. Igual deducción puede hacerse de resultados obtenidos en monos Aotus inmunizados con los péptidos largos en los que se dio una dosis de refuerzo con esporozoitos frescos de P. vivax. Este procedimiento indujo un refuerzo en la respuesta de producción de IFN-g22.
De igual manera los sueros de los voluntarios humanos inmunizados con los péptidos largos formulados en Montanide ISA-720, revelaron altos títulos de anticuerpos, capaces de reconocer la proteína nativa cuando se analizaron mediante la técnica de IFAT. La similitud en el reconocimiento de los epítopes contenidos en la proteína CS, por parte de los individuos semi-inmunes de las áreas endémicas, por los monos Aotus inmunizados21 y posteriormente por los voluntarios inmunizados en este estudio, indican su condición de epítopes dominantes, altamente inmunogénicos y con un posible efecto protector contra la infección por P. vivax. En vista de la gran complejidad del ciclo de vida del Plasmodium, y de los múltiples componentes tanto del parásito como de la respuesta inmune contra la malaria, es fácil predecir que el empleo de la proteína CS de P. vivax o de los fragmentos descritos antes, no sean por sí solos capaces de conferir una inmunidad suficiente para tener un impacto epidemiológico duradero en las comunidades endémicas; sin embargo, los resultados de los estudios descritos aquí, demuestran un gran potencial de este antígeno como subunidad para ser incluida en una vacuna multivalente.
Estudios en progreso indican que su homólogo de P. falciparum tiene una importante capacidad protectora, lo que genera un argumento a favor de la proteína CS de P. vivax. En este último, el bloqueo de la fase hepática reviste la mayor importancia debido al comportamiento biológico del parásito, que termina en la generación de hipnozoitos, responsables de las recidivas características de la enfermedad.
Finalmente, los resultados de estudios sistemáticos y secuenciales en el proceso de desarrollo de una vacuna, en este caso, la proteína CS de P. vivax, demuestran que es posible prever el éxito en el desarrollo de una vacuna contra la malaria.
En la actualidad se adelantan trabajos complementarios, con proteínas de otros estadios de P. vivax, en el marco de un programa internacional llevado a cabo por el Consorcio para la Investigación Científica, en el que participan el Instituto de Inmunología del Valle, el Centro Internacional de Vacunas, la Fundación Centro de Primates35 y otras instituciones de Colombia, que trabajan en colaboración con numerosos centros de investigación del mundo.
AGRADECIMIENTOS
Queremos expresar nuestra gratitud a todas las personas que aceptaron participar como voluntarios en este estudio, a Luz Helena García por el trabajo realizado en la convocatoria, reclutamiento y seguimiento de los voluntarios, a Liliana Soto, Ana Milena Lenis y Carolina Ramírez por el apoyo técnico, a Antonio Ramírez por su apoyo logístico importante en el éxito del estudio, a los monitores independientes de datos doctora Gloria Palma y doctor William Rojas, a la Organización Mundial de la Salud y al monitor clínico asignado por la OMS doctor Ricardo Palacios. Este estudio fue cofinanciado por Colciencias, la Secretaría Departamental de Salud del Valle y la Fundación Centro Internacional de Vacunas.
REFERENCIAS
1. WHO. Malaria is alive and well and killing more than 3000 African children every day. http://www.who.int/inf-fs/en/fact094.html 2003; Press Release WHO/33 25.
2. Daly TM, Long CA. A recombinant 15-kilodalton carboxyl-terminal fragment of Plasmodium yoelii yoelii 17XL merozoite surface protein 1 induces a protective immune response in mice. Infect Immun 1993; 61: 2462-2467.
3. McGregor IA. Mechanisms of acquired immunity and epidemiological patterns of antibody responses in malaria in man. Bull World Health Organ 1974; 50: 259-266.
4. Sabchareon A, Burnouf T, Ouattara D, et al. Parasitologic and clinical human response to immunoglobulin administration in falciparum malaria. Am J Trop Med Hyg 1991; 45: 297-308.
5. Nardin E, Zavala F, Nussenzweig V, Nussenzweig RS. Pre-erythrocytic malaria vaccine: mechanisms of protective immunity and human vaccine trials. Parasitologia 1999; 41: 397-402.
6. Doolan DL, Hoffman SL. DNA-based vaccines against malaria: status and promise of the Multi-Stage Malaria DNA Vaccine Operation. Int J Parasitol 2001; 31: 753-762.
7. Druilhe P, Daubersies P, Patarapotikul J, et al. A primary malarial infection is composed of a very wide range of genetically diverse but related parasites. J Clin Invest 1998; 101: 2008-2016.
8. Gardner MJ, Hall N, Fung E, et al. Genome sequence of the human malaria parasite Plasmodium falciparum. Nature 2002; 419: 498-511.
9. Doolan DL, Southwood S, Freilich DA, et al. Identification of Plasmodium falciparum antigens by antigenic analysis of genomic and proteomic data. Proc Natl Acad Sci U S A 2003; 100: 9952-9957.
10. Doolan DL, Aguiar JC, Weiss WR, et al. Utilization of genomic sequence information to develop malaria vaccines. J Exp Biol 2003; 206: 3789-3802.
11. TIGER TIfGR. Introduction. The Plasmodium vivax Genome Database. http://www.tigr.org/tdb/e2k1/pva1/intro.html 2004.
12. Graves P, Gelband H. Vaccines for preventing malaria. Cochrane Database Syst Rev 2003: CD000129.
13. Ballou WR, Arévalo-Herrera M, Carucci D, et al. Update on the Clinical Development of Candidate Malaria Vaccines. Am Trop Med Hyg 2004; In press.
14. Herrington DA, Nardin EH, Losonsky G, et al. Safety and immunogenicity of a recombinant sporozoite malaria vaccine against Plasmodium vivax. Am J Trop Med Hyg 1991; 45: 695-701.
15. Miles AP, Zhang Y, Saul A, Stowers AW. Large-scale purification and characterization of malaria vaccine candidate antigen Pvs25H for use in clinical trials. Protein Expr Purif 2002; 25: 87-96.
16. WHO. Guidelines for good clinical practice (GCP) for trials on pharmaceutical products. WHO, Technical Report Seried 1995; Nº 850, Annex 3.
17. Atherton E, Logan CJ, Sheppard RC. Peptide syntesis. II. Procedures for solid phase synthesis using N alpha fluorenymethoxy-carbamino-acids on polyamide syntesis of substance P and acyl-carrier protein 65-74 decapeptide. J Chem Soc Perk 1988; 1: 538-548.
18. Panina-Bordignon P, Tan A, Termijtelen A, Demotz S, Corradin G, Lanzavecchia A. Universally immunogenic T cell epitopes: promiscuous binding to human MHC class II and promiscuous recognition by T cells. Eur J Immunol 1989; 19: 2237-2242.
19. Roggero MA, Servis C, Corradin G. A simple and rapid procedure for the purification of synthetic polypeptides by a combination of affinity chromatography and methionine chemistry. FEBS Lett 1997; 408: 285-288.
20. Roggero MA, Filippi B, Church P, et al. Synthesis and immunological characterization of 104-mer and 102-mer peptides corresponding to the N- and C-terminal regions of the Plasmodium falciparum CS protein. Mol Immunol 1995; 32: 1301-1309.
21. Arévalo-Herrera M, Roggero MA, González JM, et al. Mapping and comparison of the B-cell epitopes recognized on the Plasmodium vivax circumsporozoite protein by immune Colombians and immunized Aotus monkeys. Ann Trop Med Parasitol 1998; 92: 539-551.
22. Herrera S. Use of long syntehetic peptides to study the antigenicity and immunogenicity of the Plasmodium vivax circumsporozoite proten. Int J Parasitol 2004; 34: 1535-1546.
23. Aucouturier J, Dupuis L, Deville S, et al. Montanide ISA 720 and 51: a new generation of water in oil emulsions as adjuvants for human vaccines. Expert Rev Vaccines 2002; 1: 111-118.
24. Singh M OHD. Advances in vaccine adjuvants. Nat Biotechnol 1999; 17: 1075-1081.
25. Herrera S, Plata C de, González M, et al. Antigenicity and immunogenicity of multiple antigen peptides (MAP) containing P. vivax CS epitopes in Aotus monkeys. Parasite Immunol 1997; 19: 161-170.
26. Arévalo-Herrera M, Herrera S. Plasmodium vivax malaria vaccine development. Mol Immunol 2001; 38: 443-455.
27. Arévalo-Herrera M, Valencia AZ, Vergara J, et al. Identification of HLA-A2 restricted CD8(+) T-lymphocyte responses to Plasmodium vivax circumsporozoite protein in individuals naturally exposed to malaria. Parasite Immunol 2002; 24: 161-169.
28. Herrera S, Escobar P, Plata C de, Avila GI, Corradin G, Herrera MA. Human recognition of T cell epitopes on the Plasmodium vivax circumsporozoite protein. J Immunol 1992; 148: 3986-3990.
29. Weiss WR, Mellouk S, Houghten RA, et al. Cytotoxic T cells recognize a peptide from the circumsporozoite protein on malaria-infected hepatocytes. J Exp Med 1990; 171: 763-773.
30. Renggli J, Valmori D, Romero JF, et al. CD8+ T-cell protective immunity induced by immunization with Plasmodium berghei CS protein-derived synthetic peptides: evidence that localization of peptide-specific CTLs is crucial for protection against malaria. Immunol Lett 1995; 46: 199-205.
31. Clark IA, Rockett KA. Nitric oxide and parasitic disease. Adv Parasitol 1996; 37: 1-56.
32. Clark IA, Awburn MM, Whitten RO, et al. Tissue distribution of migration inhibitory factor and inducible nitric oxide synthase in falciparum malaria and sepsis in African children. Malar J 2003; 2: 6.
33. Doolan DL, Hoffman SL. The complexity of protective immunity against liver-stage malaria. J Immunol 2000; 165: 1453-1462.
34. Hoffman SL, Doolan DL. Malaria vaccines-targeting infected hepatocytes. Nat Med 2000; 6: 1218-1219.
35. Arévalo-Herrera M, Herrera S. Translation research in P. vivax from protective immune. TMRC Grant 2001; AI49486-01.