Introducción
La enfermedad vascular cerebral (EVC) isquémica o infarto cerebral, es causada por la interrupción del flujo sanguíneo cerebral ocasionada por un trombo promovido por la ateroesclerosis o la cardioembolia 1. El infarto cerebral aterotrombótico es el subtipo más común de los infartos cerebrales, tiene una frecuencia aproximada del 37% 2 y es la consecuencia clínica de la enfermedad ateromatosa. Múltiples factores inducen la aterogénesis, principalmente lipoproteínas de baja densidad (LDL) oxidadas, las cuales desencadenan una respuesta inmunológica en la pared del vaso sanguíneo y participan en el desarrollo de la ateroesclerosis 3. El grado de oxidación de las LDL depende del balance de agentes oxidantes/antioxidantes y de la cantidad de LDL existente 4. Por otro lado, se sabe que las lipoproteínas de alta densidad (HDL) tienen un papel anti-ateroesclerótico, ya que metabolizan moléculas de LDL oxidadas de la pared arterial, transportándolas al hígado para su eliminación 5,6. Esta capacidad de la HDL es debida a la asociación de enzimas como la paraoxonasa 1 (PON1) y la acetilhidrolasa del factor activador de plaquetas (PAF-AH) que disminuyen la peroxidación de las LDL 4,7.
PON1 es una enzima de 355 aminoácidos, sintetizada en el hígado y secretada en la sangre, donde se encuentra unida a las HDL 8,9. PON1 presenta, un polimorfismo en la posición 192 en la región codificante, que se caracteriza por una sustitución de una glutamina (Q) por una arginina (R) y otra en la posición 55, donde se evidencia un cambio de una leucina (L) por una metionina (M) 10. El polimorfismo Q192R afecta la capacidad para hidrolizar los compuestos organofosforados como el paroxón 11. Las dos aloenzimas del polimorfismo Q192R tienen afinidades y actividades catalíticas diferentes frente a varios sustratos 12. Estos polimorfismos también modifican la capacidad de la PON1 para proteger in vitro a las LDLs de la oxidación.
A partir del efecto observado de los polimorfismos comunes de la PON1 sobre la protección por las HDL ante la modificación oxidativa de las LDL, se ha sugerido que los individuos homocigotos para Q y para M de la PON1 podrían ser menos susceptibles a desarrollar enfermedades de origen ateroesclerótico, y que individuos homocigotos para R y para L podrían ser más propensos a desarrollar dichas enfermedades 13. La frecuente asociación del genotipo RR de PON1-192 con el riesgo de enfermedades cardiovasculares refleja una eficiencia disminuida en el metabolismo de lípidos oxidados y/o una menor estabilidad de esta aloenzima, comparada con el genotipo QQ 14. En este contexto, los polimorfismos Q192R y L55M, así como la actividad enzimática de la PON1, se han considerado una herramienta que puede contribuir a la estimación del riesgo de padecer las enfermedades referidas. Por lo tanto, el objetivo del presente estudio fue investigar la relación de los polimorfismos genéticos de PON1 con la EVC isquémica, de etiología ateroesclerosa.
Materiales y Métodos
Se realizó un estudio de casos y controles en el Instituto Nacional de Neurología y Neurocirugía (INNN), de la Ciudad de México, durante el año 2005. Los participantes o familiares responsables, firmaron un consentimiento informado, contestaron un cuestionario (datos demográficos, clínicos y de estilos de vida) y proporcionaron una muestra de sangre venosa para análisis bioquímicos y moleculares. Los casos fueron sujetos hospitalizados de 35 a 85 años de edad con diagnóstico reciente de EVC isquémica de tipo aterotrombótica en fase aguda. Los controles fueron sujetos entre 35 y 75 años que pasaron las pruebas establecidas para la donación de sangre del mismo hospital. El estudio fue aprobado por el Comité de Bioética del INNN (No. 67/01).
Para los ensayos bioquímicos se empleó el autoanalizador Hitachi 912 (Roche, Basel, Switzerland). La determinación de colesterol total sérico (TC) y triglicéridos TG se realizó con CHOD-PAP, HDL-C con HDL-C plus 3ª generación y LDL-C con LDL-C 2ª generación, todas de Roche Diagnostic.
La actividad paraoxonasa se determinó en suero a través de modificaciones al método de Eckerson 15, 20 µL de suero más 980 µL de amortiguador pH 8 (Tris 10 mM, CaCl2 1 mM, 2.6 M de NaCl µL, 1 mM de paraoxón), midiendo el producto de hidrólisis (p-nitrofenol) a una longitud de onda de 412 nm durante 5 min, (se utilizó un coeficiente de extinción molar de 17,100 16. Para la actividad arilesterasa se utilizaron 2,995 µL de acetato de fenilo 1 mM en un amortiguador pH 8 (Tris 10 mM, CaCl2 1 mM) y 5 µL de suero. La velocidad de hidrólisis se determinó midiendo el producto (fenol) a una longitud de onda de 270 nm, se monitoreó durante 3 min y se tomó el valor antes y después de la incubación. Se ajustó la absorbancia en base a su coeficiente de extinción molar de 1,310 M−1cm−1 (15.
Para la determinación de los polimorfismos genéticos de PON1-Q192R y PON1-L55M, el DNA genómico se extrajo a partir de sangre completa mediante un Kit comercial (AquapureTM Genomic DNA kit, Bio-rad Laboratories, Hercules, CA). La identificación de los genotipos de PON1 se realizó por PCR 17, con posterior digestión de los productos amplificados con enzimas de restricción BspPI (Fermentas) para PON1-Q192R y Hin1II (Fermentas) para PON1-L55M. Los fragmentos digeridos fueron separados por electroforesis y visualizados en geles de poliacrilamida al 7.5% y 20% para PON1-L55M (dos fragmentos de 126 y 44 pb) y PON1-Q192R (dos fragmentos de 66 y 33 pb), respectivamente. El personal de laboratorio llevó a cabo la genotipificación de las muestras en una prueba ciega que incluyó muestras control (identificadas previamente mediante secuenciación) y las muestras experimentales para su validación. La concordancia con las muestras control fue del 100%.
Las variables categóricas se compararon mediante Chi cuadrado. Las variables con distribución normal se compararon mediante t de Student o ANOVA, aquellas variables no normales se analizaron con la prueba U de Mann-Whitney y posteriormente se transformaron a valores logaritmos para realizar las pruebas de regresión. Se evaluaron las variables en una regresión lineal simple, aquellas con un valor de p menor o igual a 0.1, se incluyeron en un modelo saturado de regresión lineal múltiple, eliminando aquellas que perdían significancia estadística, se mantuvieron edad y sexo por ser potenciales confusoras. Los datos fueron analizados con el programa estadístico SPSS® versión 13, con una significancia estadística de 0.05.
Resultados
En el presente trabajo se incluyeron 28 casos de infarto cerebral aterotrombótico y 29 controles. En la Tabla 1 se observa que la edad, el sexo y el consumo de alcohol y tabaco fueron distintos entre casos y controles. Los parámetros clínicos de IMC, lípidos séricos (a excepción de triglicéridos) e hipercolesterolemia fueron similares entre ambos grupos.
| Controles (n= 28) | Casos (n= 29) | p* | |
|---|---|---|---|
| Edad (años) † | 48 (43-54.5) | 61 (53-71.5) | 0.001 |
| Hombre/mujer | 21/8 | 13/17 | 0.024 |
| IMC (kg/m2) † | 27.12±0.80 | 27.77±0.78 | 0.568 |
| TG (mg/dL) † | 31.02 | 23.41 | 0.073 |
| C-Total (mg/dL) † | 213.62±10.06 | 191.98±9.05 | 0.116 |
| C-HDL (mg/dL) † | 28.18 | 22.82 | 0.193 |
| C-LDL (mg/dL) † | 124.41±9.97 | 124.22±6.31 | 0.987 |
| HTA, n (%) | 2(6.9) | 16(55.2) | < 0.001 |
| DM, n (%) | 0(0.0) | 9(31.0) | 0.001 |
| Consumo de tabaco n (%) | 2(6.9) | 8(27.6) | 0.037 |
| Consumo de alcohol, n (%) | 0(0.0) | 8(28.6) | 0.002 |
| LL | 66.7 | 69 | 0.282 |
| LM | 29.6 | 17.2 | |
| MM | 3.7 | 13.8 | |
| Alelo L | 81.5 | 77.6 | 0.610 |
| Alelo M | 18.5 | 22.4 | |
| Genotipo PON1-Q192R | |||
| 21.4 | 27.6 | 0.786 | |
| QR | 50.0 | 41.4 | |
| RR | 28.6 | 31.0 | |
| Alelo Q | 46.4 | 48.3 | 0.843 |
| Alelo R | 53.6 | 51.7 | †Las variables continuas están expresadas como la media ±error estándar o mediana (cuartil 25-cuartil 75) * Valor de la significancia para t de Student o Chi cuadrado. Para triglicéridos (TG), colesterol de HDL (C-HDL) y colesterol de LDL (C-LDL) el valor de la significancia fue para U de Mann Whitney. C-Total: colesterol total |
Las frecuencias de las tres clases genotípicas correspondientes a los polimorfismos Q192R y L55M de la PON1 (Tabla 1) no fueron estadísticamente diferentes (p= 0.786 y p= 0.282, respectivamente) entre el grupo control y de casos, posteriormente se compararon las distribuciones alélicas de Q/R para el polimorfismo Q192R y L/M para el polimorfismo L55M las cuales tampoco fueron diferentes entre ambos grupos.
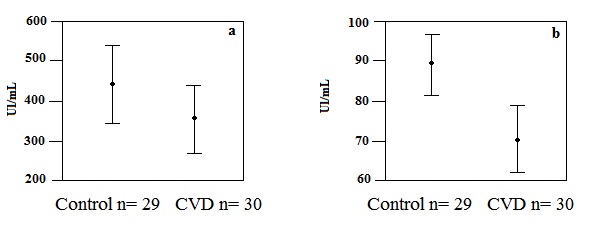
La actividad paraoxonasa de la PON1 fue mayor en el grupo control (450.27 UI/mL) en relación al grupo de casos (348.35 UI/mL), aunque no fue estadísticamente significativo (p= 0.093). Situación similar a la actividad arilesterasa de la PON1, que fue mayor en el grupo control (89.96 UI/mL) en relación al grupo de casos (69.63 UI/mL), siendo esta diferencia estadísticamente significativa (p= 0.001) (Fig. 1).
Figura 1
Actividades paraoxonasa y arilesterasa de la PON1 en suero. Las barras representan el intervalo de confianza al 95%. p= 0.093 para paraoxonasa (a) y p= 0.001 para arilesterasa (b), por t de Student
En el análisis de regresión simple para la actividad paraoxonasa (Tabla 2), se observa que dicha actividad fue explicada por los niveles séricos de triglicéridos, por la actividad arilesterasa, por ambos polimorfismos y por el diagnóstico (casos vs controles). En el modelo de regresión múltiple se demostró que la edad, la actividad arilesterasa y el polimorfismo Q192R, fueron los factores que determinaron de manera significativa e independiente en un 78.5% la variación de la actividad paraoxonasa. También se encontró que el diagnóstico (p=0.85 en el modelo saturado, dato no mostrado), no influyó en la actividad paraoxonasa de los sujetos de este estudio.
| Regresión simple | β1 | r2 ajustado | |
|---|---|---|---|
| Edad | -450.54 | 0.022 | 0.136 |
| Sexo | -38.85 | -0.011 | 0.532 |
| IMC | 9.41 | 0.008 | 0.232 |
| TG* | 201.54 | 0.035 | |
| C-Total | 0.77 | 0.007 | 0.252 |
| C-HDL | 105.59 | -0.018 | 0.731 |
| C-LDL | -0.026 | -0.022 | 0.975 |
| Hipercolesterolemia | 37.98 | -0.013 | 0.594 |
| HTA | -37.70 | -0.012 | 0.576 |
| DM | -51.78 | -0.011 | 0.548 |
| Tabaquismo | 39.78 | -0.014 | 0.630 |
| Alcoholismo | 28.01 | -0.017 | 0.756 |
| Estatinas | -36.63 | -0.017 | 0.769 |
| Diagnóstico* | -101.92 | 0.032 | |
| Actividad arilesterasa* | 2.13 | 0.030 | |
| PON192* | 232.72 | 0.563 | |
| PON55* | -127.73 | 0.127 | |
| Edad | -327.80 | 0.0370 | |
| Actividad arilesterasa | 3.993 | 0.785 | < 0.0001 |
| PON192 | 271.43 | < 0.0001 | *Variables con un valor p≤ 0.1 †variables estadísticamente significativas ( TG: triglicéridos, C-Total: colesterol total, C-HDL: colesterol de HDL, C-LDL: colesterol de LDL, β1: valor de la pendiente y r2 ajustado: coeficiente de correlación |
En relación a la actividad arilesterasa (Tabla 3), en el análisis de regresión simple, las variables de diagnóstico, edad, colesterol total, alcoholismo y el polimorfismo Q192R estuvieron relacionados con la actividad. En el análisis de regresión múltiple, la edad, el consumo de alcohol y el colesterol total (este último con una significancia marginal) determinaron de manera significativa e independiente la variación de la actividad arilesterasa, aunque sólo lo explicaron en un 27.6%. La d iferencia estadística obtenida de la actividad arilesterasa entre controles y casos dejo de ser significativa al ajustarla durante la regresión lineal múltiple.
| Regresión simple | β1 | r2 ajustado | |
|---|---|---|---|
| Edad* | -89.70 | 0.134 | 0.003 |
| Sexo | -2.68 | -0.014 | 0.669 |
| IMC | -0.028 | -0.019 | 0.970 |
| TG | 13.27 | 0.010 | 0.225 |
| C-Total* | 0.120 | 0.062 | 0.042 |
| C-HDL | 21.01 | -0.008 | 0.433 |
| C-LDL | 0.092 | 0.012 | 0.214 |
| Hipercolesterolemia | 1.43 | -0.017 | 0.841 |
| HTA | -6.28 | -0.002 | 0.353 |
| DM | -5.12 | -0.011 | 0.554 |
| Tabaquismo | -9.66 | 0.007 | 0.242 |
| Alcoholismo* | -26.41 | 0.173 | 0.001 |
| Estatinas | -11.45 | -0.002 | 0.354 |
| Diagnóstico* | -20.33 | 0.175 | 0.001 |
| PON192* | -9.08 | 0.064 | 0.032 |
| PON55 | 2.57 | -0.013 | 0.601 |
| Edad | -64.74 | 0.019 | |
| C-Total | 0.103 | 0.276 | 0.051 |
| Alcoholismo | -15.578 | 0.041 | *Variables con un valor †variables estadísticamente significativas ( TG: triglicéridos, C - Total: colesterol total, C-HDL: colesterol de HDL, C-LDL: colesterol de LDL, β1: valor de la pendiente y r2 ajustado: coeficiente de correlación |