Homocisteína y polimorfismos de cistationina b sintasa y metilentetrahidrofolato reductasa en población sana de Colombia*
Marta Bermúdez, Biol.1, Ignacio Briceño, M.D., Ph.D.2, Fabián Gil, M.Sc.3, Jaime Bernal, M.D., Ph.D.4
* Trabajo de Tesis de grado para optar al título de Especialista en Pediatría de los doctores Mirey Siuffi y Mario Angulo.
1. Residente, Departamento de Pediatría, Escuela de Medicina, Facultad de Salud,. Universidad del Valle, Cali, Colombia. e-mail: mireysiuffi@yahoo.com marioangulo@hotmail.com
2. Profesor Titular, Departamento de Pediatría, Escuela de Medicina, Facultad de Salud, Universidad del Valle, Cali, Colombia. e-mail: cvelasco@univalle.edu.co
3. Profesor Asociado, Escuela de Bacteriología y Laboratorio Clínico, Facultad de Salud, Universidad del Valle, Cali, Colombia. e-mail: vhduenas@univalle.edu.co
4.Profesora Auxiliar, Escuela de Bacteriología y Laboratorio Clínico, Facultad de Salud, Universidad del Valle, Cali, Colombia. e-mail: crojasc@telesat.com.co
5. Grupo de Investigación en Gastroenterología, Hepatología y Nutrición Pediátrica GASTROHNUP. Cali, Colombia. e-mail: gastrohnup@univalle.edu.co
Recibido para publicación diciembre 3, 2005 Aceptado para publicación enero 17, 2006
RESUMEN
Introducción: Durante los últimos años la hiperhomocisteinemia moderada (>17 mM) y la presencia de las variantes polimórficas de los genes comprometidos en el metabolismo de la metionina, como la cistationinab sintasa (CBS) y la metilentetrahidrofolato reductasa (MTHFR), se han asociado con riesgo de enfermedad vascular.
Objetivos: Se definieron los niveles de homocisteína basales y post-carga de metionina en una población de 102 personas asintomáticas, y se calcularon las frecuencias de las variantes alélicas c.699 C >T (exón 6) c.1080 C>T (exón 10) de la CBS, y de c.677 C>T (exón 1) de la MTHFR. Se estudió la asociación entre estas variantes alélicas y la hiperhomocisteinemia.
Metodología: La homocisteína se cuantificó en ayuno y post-carga de metionina. Se utilizó la técnica de PCR para la amplificación de los exones 6 y 10 de la CBS, 1 de la MTHFR y mediante análisis de restricción, se hallaron las frecuencias alélicas de los polimorfismos c.699 C >T y c.1080 C>T, y de c.677 C>T. El estudio de asociación se hizo mediante la prueba de Chi2 corregido con la prueba de Fischer.
Resultados: Los niveles medio +2 DE de homocisteína fueron: basal 10.52 mM + 5.8 y post-carga de metionina en 30.14 + 16.20. Se identificaron 8 personas con hiperhomocisteinemia moderada, una basal y siete postcarga de metionina. La comparación entre los valores de homocisteína post-carga de metionina en los hombres 32.43 + 8.64 y las mujeres 28.03 + 7.02 presentó una diferencia significativa (p = 0.006). Estos resultados mostraron que individuos homocigotos T/T para la variante termolábil 677 de la MTHFR tienen un riesgo (Odds ratio) de 5.14 (p = 0.034) de ser hiperhomocisteinémicos.
Conclusiones: Se identificaron individuos hiperhomocisteinémicos postcarga de metionina. Se encontró asociación entre los portadores T/T del polimorfismo c.677 de la MTHFR y la hiperhomocisteinemia. La frecuencia de portadores de este polimorfismo es la más alta informada hasta el momento en la literatura.
Palabras clave: Hiperhomocisteinemia. Enfermedad vascular. Metilenetetrahidrofolato reductasa. Cistationina ß sintasa. Polimorfismos.
Homocysteine and polymorphisms of cystathionine synthase and methylenetetrahydrofolate reductase in a healthy population from Colombia
SUMMARY
Introduction: Recently, moderate hyperhomocysteinemia (>17 mM) and the presence of polymorphic variants of the genes involved in methionine metabolism as cystathionineb synthase (CBS) and 5,10-methylenetetrahydrofolate reductase (MTHFR) have been associated with vascular disease.
Objectives: The aims of this study were to quantify basal and post methionine load levels of homocysteine in a Colombian healthy population and to identify the frequencies of the allelic variants c.699 C >T (exon 6), c.1080 C>T (exon 10) of CBS, and c.677 C>T (exon 1) of MTHFR. Association studies between these allelic variants and hiperhomocisteinemia were performed.
Methods: A group of 102 healthy individuals, without geographic origin, ethnic group or social-economic stratification were studied for polymorphisms c.699 C >T (CBS exon 6), c.1080 C>T (CBS exon 10) and c.677 C>T (MTHFR exon 1) by restriction analysis and the allele frequencies were calculated. Association study was performed using Fisher exact test.
Results: Quantification of basal homocysteine levels (10.52 mM + 5.8) and after methionine load (30.14 +16, 20) was performed. Among individuals 8 were identified with moderate hyperhomocysteinemia, one having basal and the seven post methionine load. Post methionine load in males produced values of 32.43 + 8.64 and were significantly different from that of females (p=0.006) who had values of 28.03 + 7.02. Our results showed that homozygous individuals (TT) for the 677 C/T variant have a risk of 5.14 (odds ratio, p=0.034) of being hyperhomocysteinemic.
Conclusions: Hyperhomocysteinemic patients were identified by methionine load test. A positive association between homozygous of the polymorphism 677 of MTHFR was found. The frequency of this polymorphism in Colombia is the highest reported in the literature.
Key words: Hyperhomocysteinemia. Vascular disease. Metilenetetrahidrofolato reductasa. Cistationine ß sintase. Polymorphisms.
La enfermedad cardiovascular es compleja y multifactorial, y es la mayor causa de muerte en los países industrializados1. Se origina por la interacción entre los genes y el medio pues crea un gradiente de susceptibilidad a la enfermedad. El elevado riesgo de mortalidad por enfermedad cardiovascular no se puede explicar totalmente por los factores de riesgo tradicionales como hiperlipidemia, tabaquismo e hipertensión; en la actualidad, un factor independiente, la hiperhomocisteinemia, se relaciona con el desarrollo de esta enfermedad2,3. El aumento de homocisteína se debe tanto a causas ambientales (nutricionales y el estilo de vida) como genéticas4. Entre las causas genéticas están las mutaciones y polimorfismos en el gen de alguna de las enzimas comprometidas en el metabolismo de la homocisteína5.
La homocisteína es un aminoácido trombogénico, sulfurado, que se forma en el metabolismo de la metionina. La homocisteína se cataboliza a cisteína por la vía de transulfuración con la intervención de dos enzimas dependientes de la vitamina B6 (cistationina b sintasa CBS MIM # 236200, EC 4.2.1.22 y cistationasa EC 4 41.1) o puede ser remetilada a metionina, proceso en el que interviene la enzima metilentetrahidrofolato reductasa (MTHFR) (MIM #236250, EC 1.5.1.20) dependiente del ácido fólico y la vitamina B12. Esta enzima cataliza la conversión de 5,10 metilentetrahidrofolato, en una reacción dependiente de NADPH, a 5-metiltetrahidrofolato; este metabolito que se produce en una reacción fisiológica irreversible, es uno de los tres dadores del grupo metilo en la conversión de homocisteína a metionina por la enzima metionina sintasa6. Hasta el momento no se conoce con exactitud cómo la hiperhomocisteinemia contribuye al desarrollo de la enfermedad cardiovascular, ni cuáles son los factores que desencadenan el aumento de homocisteína observado en estos pacientes. Refsum et al.6 clasifican la hiperhomocisteinemia en moderada como la homocisteína total en plasma en el rango de (17-30 µM), intermedia (30-100 µM) y severa (>100 µM). Aras et al. 7 relacionan las mutaciones sinónimas con la expresión de las enzimas y, la estabilidad del trascrito, que resulta en actividad reducida de la CBS; estos autores encontraron que los polimorfismos sinónimos del gen de la CBS (c.699 C>T en el exón 6 y c.1080 C>T en el exón 10) muestran una asociación con hiperhomocisteinemia postcarga de metionina. Proponen que puede haber un desequilibrio de ligamiento de estos polimorfismos silentes con elementos reguladores que estimulan la trascripción del gen de la cistationinab sintasa, para aumentar de esta forma los niveles plasmáticos de homocisteína.
Sebastio et al.8 encontraron en pacientes con hiperhomocisteinemia severa, una mutación en el exón 8 de la CBS, 844ins 68, consistente en una inserción de 68 pb así: 53 pares de bases del intrón 7 y 15 pares de bases del exón 8. Esta inserción produce sitos alternativos de empalme. Sin embargo, estudios posteriores de Tsai et al.9 mostraron que la secuencia insertada se elimina a través del empalme o «splicing» de la parte distal del intrón 7 – exón 8 y resulta así un tamaño normal de mRNA de CBS en portadores. Esta mutación se ha investigado como factor de riesgo en la enfermedad oclusiva arterial en relación con hiperhomocisteinemia, con resultados contradictorios; mientras Kluijtmans et al.10 no encontraron asociación entre este polimorfismo y la enfermedad vascular, Francis et al.11 informan que la presencia en estado heterocigótico de la mutación 844ins68 no es per se un factor de riesgo para el desarrollo de la enfermedad oclusiva prematura, pero cuando se encuentra en combinación con MTHFR variante termolábil, aumenta cuatro veces el riesgo de enfermedades oclusivas por aumento del grado de hiperhomocisteinemia.
Frosst et al.12 informaron el polimorfismo c.677 C >T en el gen de la MTHFR asociado con actividad reducida de la enzima. Brattstron et al.13 encuentran un alza de 20% en los niveles de homocisteína plasmática en los portadores homocigóticos de este polimorfismo.
Boers et al.14 comunicaron que la hiperhomocisteinemia se puede descubrir por el alza en la concentración de homocisteína en el plasma después de carga de metionina en cerca de 30% de los pacientes con enfermedad oclusiva arterial periférica y cerebrovascular.
Se estima que en el país aproximadamente cinco colombianos presentan un evento coronario por hora y al día ocurren 45 muertes relacionadas con enfermedad coronaria 15; la alta frecuencia de esta enfermedad en la población contribuye de una manera importante a la morbimortalidad y se constituye en un problema de salud pública. Por esta razón es necesario mejorar la identificación de las personas en riesgo de desarrollarla como consecuencia de un aumento de homocisteína. Una primera aproximación consiste en conocer los niveles de homocisteína basal y postcarga de metionina así como también las frecuencias alélicas de los polimorfismos 844ins 68 en el exón 8, c.699 C >T en el exón 6 y c.1080 C>T en el exón 10 de la CBS, y de c.677 C>T en la MTHFR en una población sin factores de riesgo tradicionales para el desarrollo de enfermedad cardiovascular. Esta estrategia permitirá hacer comparaciones con pacientes que han sufrido enfermedad cardiovascular y buscar haplotipos que identifiquen personas en riesgo de desarrollar enfermedad cardiovascular.
METODOLOGÍA
Población. De la población general, se tomó una muestra de 102 voluntarios. Se incluyeron individuos en apariencia sanos, de ambos sexos, provenientes de diversos lugares de Colombia con residencia en la ciudad de Bogotá, y edades comprendidas entre 18 y 50 años. No se estratificó por procedencia, grupo étnico, o nivel socio-económico. Previa firma del consentimiento informado, se aplicó un cuestionario con datos de historia clínica para obtener información sobre antecedentes familiares de enfermedades vasculares, estilo de vida, (hábito de fumar, ejercicio, dieta). Se excluyeron individuos con colesterol mayor de 200 mg/dl, triglicéridos por encima de 150 mg/dl, tensión arterial superior a 120/80, con niveles de glucosa menor de 70 mg/dl o mayor de 110 mg/dl. El Comité de Ética de la Facultad de Medicina de la Pontificia Universidad Javeriana, aprobó el protocolo de este estudio.
Protocolo de carga oral de metionina. Se tomó una muestra de sangre en ayuno y luego se suministró una carga oral de metionina (100 mg/kg de peso)16, en jugo de naranja a cada una de las personas participantes en el estudio; transcurridas 4 horas, se tomó una segunda muestra de sangre (en ambos casos 5 ml en tubo seco).
Cuantificación de homocisteína total plasmática. La concentración de homocisteína total plasmática se determinó con el método de inmunoensayo competitivo17.
Principios biológicos del procedimiento. Este método (IMx de Abbott) se basa en un inmunoanálisis de polarización de la fluorescencia (FPIA). La homocisteína y las formas de homocisteína como disulfuro mixto y unidas a proteínas presentes en la muestra, se reducen y forman homocisteína libre al utilizar ditiotreitol (DTT). La homocisteína total libre se convierte en S-adenosil-L-homocisteína (SAH) por medio de la enzima SAH hidrolasa y exceso de adenosina. El paso posterior consiste en medir y cuantificar las moléculas de SHA por disminución de la luz polarizada.
Análisis de polimorfismos. El ADN genómico se aisló de sangre periférica mediante el kit de purificación de ADN (Promega, Madison, WI). Para el estudio del polimorfismo c.699C >T se amplifico el exón 6 de la CBS con los primers: forward 5´ CAGCAACC CCCTGGCTCA GT 3´ y 5´ CAGCCATGCCCTGTGT TTGCTATT3´. Las condiciones de PCR fueron: 92°C por 3 minutos 35 ciclos de (92 por 1 minuto, 64°C por 1 minuto 72° C por 30 segundos.) y finalmente a 72°C por 7 minutos. Se obtuvo un fragmento de 289 pares de bases, al digerir con la enzima de restricción RsaI y separar los productos en gel de poliacrilamida al 12% se obtuvieron fragmentos de 177, 92 y 20 pares de bases cuando el genotipo es C/C y, 177 y 112 pares de bases cuando el genotipo es T/T18.
Polimorfismo c.1080 C >T de la CBS. Se amplifica con los primers forward 5´ CAGTGCCCACCCCAGCTCATTA 3´ y reverse 5´ GGCCTCCTCCCCTCCCA GTTCT 3.´ Las condiciones de PCR utilizadas fueron: a 95° C por 20 segundos, luego 35 ciclos de (95° C por 5 segundos, 66°C por 30 segundos y 68°C por 40 segundos), finalmente a 68° C por 10 minutos. El tamaño del fragmento fue de 465 pares de bases. Al digerir con la enzima de restricción BstUI y separar los productos en gel de poliacrilamida del 12% se observaron fragmentos de 219, 178, 68 y 20 pares de bases cuando el genotipo es C/C; el polimorfismo T hace que se pierda un punto de corte con la enzima de restricción produciendo los fragmentos 246 y 21918.
Polimorfismo c.677C >T de la MTHFR. Se utilizaron los primers: forward: 5´ TGAAGGAGAAGGTGTCTG CGGGA3´ y reverse: 5´ AGGACGGTGCGGT GAGTG 3´ con las siguientes condiciones experimentales: 94°C por 3 minutos; 35 ciclos (94°C por 0.5 minutos, 62°C por 1 minuto y 72° C por 30 seg.) y finalmente 72° C por 7 minutos. Se obtuvo un producto de 198 pares de bases que no es cortado por la enzima de restricción Taq I. La presencia del polimorfismo crea sitio de restricción y se generan los fragmentos 177 y 21 pares de bases que se separaron en gel de poliacrilamida al 12%19.
Análisis estadístico. Para descubrir la diferencia entre las concentraciones promedio de homocisteína en ayuno (basal) y post-carga de metionina en el grupo de los hombres y de las mujeres se utilizó la prueba t de Student para muestras pareadas. Un valor de p <0.05 se consideró significativo. Las diferencias entre las frecuencias del alelo raro se obtuvieron con la prueba de proporciones para muestras independientes. En el análisis estadístico de la información se empleó el programa STATA versión 8.2. Para cuantificar la asociación entre el genotipo c.677 C>T y el nivel de homocisteína (individuos con valores normales e individuos hiperhomocisteinémicos) se calculó el OR y un intervalo de 95% de confianza, a partir de un cuadro de cuatro casillas.
RESULTADOS
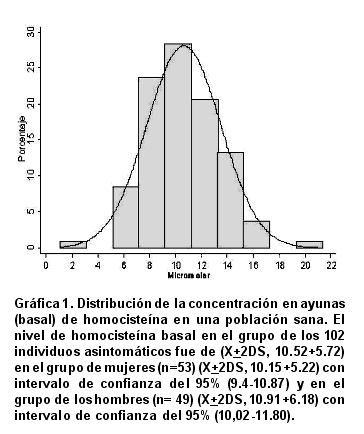
Se estudio una población de 102 personas voluntarias sanas, 53 mujeres y 49 hombres. Después de un ayuno de 12 horas, se cuantificaron los niveles de homocisteína. Estos valores se distribuyeron normalmente entre 1.0 y 22 mM (Gráfica 1).
Para el cálculo del valor normal de homocisteína basal se tomó como criterio la media + 2 DE de los 102 individuos, obteniéndose un valor <16.32 mM. Se encontró una persona con una concentración de homocisteína en ayunas de 21 mM, que corresponde a hiperhomocisteinémica moderada, de acuerdo con la clasificación de Refsum et al.6, entre la homocisteína basal de los hombres (n = 49) y mujeres (n = 53) (Cuadro 1). No se encontraron diferencias estadísticamente significativas en los niveles basales de homocisteína por sexo, luego de ajustar por edad, ejercicio, hábito de fumar y dieta (p= 0.168). Luego de administrar 100 mg/kg de metionina, se encontró una diferencia significativa (p =0.006) en el aumento de homocisteína total entre hombres (32.43 + 8.64) y mujeres (28.03 + 7.02) (Cuadro 2).
Se consideraron hiperhomocisteinémicos post-carga, a las personas con valores de homocisteína X + 2 DE (>46.34 mM); con este criterio se identificaron 7 personas con valores superiores a este punto de corte. En este estudio en total se encontraron 8 individuos con hiperhomocisteinemia moderada; 7 post-carga de metionina y un individuo con hiperhomocisteinemia basal (siete hombres y una mujer).
Al comparar los valores de homocisteína basal, el delta es decir la diferencia entre el nivel de homocisteína post-carga de metionina y el nivel basal, las veces que el valor de homocisteína aumentó, con el hábito de fumar, el ejercicio y la dieta, no se encontraron diferencias significativas con el grupo de personas que no fuman, no hacen ejercicio ni dieta (Cuadro 3), esto puede significar que ninguna de estas variables afecta el resultado obtenido de la cuantificación de homocisteína.
Se analizaron los polimorfismos c.699C>T, 844 inserción 68 y c.1080 C>T de la CBS y c.677 C>T de la MTHFR. El polimorfismo 844 inserción 68 está presente, con muy baja frecuencia (0.026), en la población estudiada (Cuadro 4). Al comparar el polimorfismo c.699 C>T en el grupo de personas con hiperhomocisteinemia post-carga (homocisteína >46.34 mM) y los que muestran valores normales (homocisteína <46.34 mM) se encontró para ambos grupos que el genotipo W/W se presenta en mayor frecuencia alélica con respecto a los genotipos W/M y M/M, mientras que en el polimorfismo c.677 C>T, el genotipo M/M corresponde a 0.71 en hiperhomocisteinémicos (homocisteína >46.34) contra 0.51 en individuos con valores normales de homocisteína (<46.34) como se muestran en los Cuadros 4 y 5.
DISCUSIÓN
La hiperhomocisteinemia se define como la concentración de homocisteína total en el plasma mayor de X +2 DE en ayunas, post-carga de metionina o las dos de forma simultánea. En los últimos años se ha encontrado que la hiperhomocisteinemia es un factor de riesgo para el desarrollo de enfermedad vascular20. En este estudio se identificaron ocho personas con hiperhomocisteinemia moderada, de una población sana de Colombia, una de ellas por cuantificación de la homocisteína basal y los otros siete post-carga de metionina. La concentración de homocisteína en ayuno (basal) en la población mostró una distribución normal de frecuencia (10.52 mM + 5.8) con valores similares a los informados en la literatura (6,21). No se encontraron diferencias estadísticamente significativas en los niveles basales de homocisteína por sexo, luego de ajustar por edad, ejercicio, hábito de fumar y dieta (p= 0.168).
La hiperhomocisteinemia puede tener un origen nutricional (deficiencia de vitaminas B6, B12 o de folato) o genético (termolabilidad de la MTHFR o por el estado heterocigoto de la deficiencia de CBS). La hiperhomocisteinemia en ayunas se puede atribuir a una alteración en la remetilación de homocisteína a metionina, por deficiencia de metilenetetrahidrofolato reductasa, o de la vitamina B12; en estos casos no se observa hiperhomocisteinemia luego de la carga de metionina22. En este estudio se identificó un individuo con las características anteriormente mencionadas. El nivel promedio de homocisteína post-carga de metionina en el grupo de los hombres mostró una diferencia significativa (p = 0.006) con respecto al de las mujeres. Estos resultados indican una posible deficiencia de vitamina B6, mayor en los hombres que en las mujeres porque cuando existe deficiencia de esta vitamina, luego de una carga de metionina se produce hiperhomocisteinemia22. En la población de hombres con homocisteína basal normal puede haber niveles bajos de vitamina B6 más que en las mujeres, sin embargo esta concentración permite una buena tolerancia a la metionina de la dieta. Sin embargo, el déficit de vitamina B6 se hace evidente cuando se somete el organismo a una sobrecarga de metionina; debido a que este aminoácido se transforma en S-adenosilmetionina, conocido inhibidor de la MTHFR y activador de la CBS, es decir la vía de transulfuración se estimula con la carga de metionina. Igualmente al comparar las veces que aumentó la homocisteína luego de la carga de metionina en el grupo de hombres y de mujeres, la diferencia es significativa. La cuantificación de vitamina B6 en el grupo de estudio permitirá evaluar si el aumento de homocisteína post-carga, se deba a una deficiencia de vitamina B6 mayor en los hombres que en las mujeres. La estratificación entre el hábito de fumar, dieta, ejercicio e historia familiar de eventos cardiovasculares no mostró relación con los niveles de homocisteína, en la población estudiada.
Por otra parte varios estudios han informado asociación entre el estado heterocigoto por deficiencia de la CBS con hiperhomocisteinemia moderada. Los hiperhomocisteinémicos hallados en este estudio no son portadores de la mutación p.T191M de la CBS, más frecuente en Colombia, Bermúdez et al.23 Franchis et al. 11 relacionan la existencia del polimorfismo 844 inserción 68 con un efecto protector de hiperhomocisteinemia, esta variante genética se encontró con muy baja frecuencia (0.026) en la población estudiada. El polimorfismo c.699C>T no mostró relación con los niveles de homocisteína, mientras el polimorfismo c.1080 C>T mostró diferencia significativa cuando se comparó la frecuencia del alelo M entre el grupo de las personas hiperhomocisteinémicas con los normales.
El polimorfismo c.677C>T responsable de la variante termolábil de la enzima metilentrahidrofolato reductasa produce una actividad reducida de esta enzima y, como consecuencia, niveles aumentados de homocisteína y asociación con enfermedad cardiovascular24; un elevado número de estudios de casos y controles asocian esta variante genética con un mayor riesgo de presentar problemas vasculares. Las frecuencias para el alelo T y el genotipo TT varían entre 0.11/0.00 en afroamericanos y 0.59/0.35 en población mexicana19. En la población de estudio se observó una frecuencia para el alelo T de 0.5 comparable con (0.487) obtenido por Camacho et al.25 en la población con niveles normales de homocisteína, pues aún es más alta (0.71) en los hiperhomocisteinémicos moderados.
Este trabajo permitió conocer los niveles basales y post-carga de homocisteína, como también las frecuencias alélicas de las variantes polimórficas c.699 C>T, 844 inserción 68 de la CBS y, c.677 C>T de la metilentetrahidrofolato reductasa, en una población asintomática de Colombia. Se identificaron hiperhomocisteinémicos moderados basales y, otros evidenciaron post-carga de metionina quizá por deficiencia de vitamina B6 y adicionalmente estos individuos homocigotos T/T para la variante termolábil de la 677C>T con un riesgo (Odds ratio) de 5.14 (p = 0.034) de ser hiperhomocisteinémicos; esto puede aumentar significativamente la susceptibilidad al desarrollo de enfermedad vascular en esta población.
En la población asintomática estudiada se demostró el aumento de homocisteína; para evaluar el riesgo de este aumento en la población colombiana, es necesario cuantificar la homocisteína y analizar los polimorfismos estudiados en este trabajo, en pacientes egresados de las unidades de cuidados intensivos con diagnóstico de infarto agudo del miocardio, en búsqueda de haplotipos que identifiquen personas en riesgo de desarrollar enfermedad cardiovascular.
REFERENCIAS
1. The World Health Report 2002. Reducing risks, promoting healthy life. Geneva: WHO; 2002.
2. Woo KS, Chook P, Lolin YI, Cheung ASP, Chan LT, Sun YY, et al. Hyperhomocyst (e) inemia is a risk factor for arterial endothelial dysfunction in humans. Circulation 1997; 96: 2542-2544.
3. Graham IM, Daly LE, Refsum HM, Robinson K, Brattstrom LE, Ueland PM, et al. Plasma homocysteine as a risk factor for vascular disease. JAMA 1997; 277: 1775-1781.
4. Mudd D, Levy HI, Kraus JP. Disorders of transsulphuration. En: Scriver C, Beaudet A, Sly W, Valle D (eds.). The metabolic and molecular bases of inherited disease. 8th ed. New York: McGraw Hill Inc.; 2001. p. 2007-2056.
5. Verhoef P, Stampfer MJ, Buring JE, Gaziano JM, Allen RH, Stabler SP, et al. Homocysteine metabolism and risk of myocardial infarction: Relation with vitamins B6, B12 and folate. Am J Epidemiol 1996; 143: 845-859.
6. Refsum H, Ueland PM, Nygard O, Vollset SE. Homocysteine and cardiovascular disease. Annu Rev Med 1998; 49: 31-62.
7. Aras O, Hanson NQ, Yang F, Tsai MY. Influence of 699C-T and 1080C-T polymorphisms of the cystathionine B synthase gene on plasma homocysteine levels. Clin Genet 2000; 58: 455-459.
8. Sebastio G, Sperandeo MP, Panico M, Francis R, Kraus JP, Andria G. The molecular basis of homocystinuria due to cystathionine b synthase deficiency in Italian families, and report of four novel mutations. Am J Hum Genet 1995; 56: 1324-1333.
9. Tsai MY, Bignell M, Schwichtenberg K, Hanson NQ. High prevalence of a mutation in the cystathionine b-synthase gene. Am J Hum Genet 1996; 59: 1262-1267.
10. Kluijtmans LAJ, Boers GHJ, Verbruggen B, Trijbels FJM, Novàkovà IRO, Blom HJ. Homozygous cystathionine b synthase deficiency; combined with factor V leiden or thermolabile methylenetetrahidrofolate reductase in the risk of venous thrombosis. Blood 1996; 91: 2015-2018.
11. Franchis R, Fermo I, Mazzola G, Sebastio G, Di Minno G, Coppola A, et al. Contribution of the cystathionine b synthase gene (844ins68) polymorphism to the risk of early-onset venous and arterial occlusive disease and of fasting hyperhomocysteinemia. Thromb Haemost 2000; 84: 576-582.
12. Frosst P, Blom HJ, Milos R, Goyette P, Sheppard CA, Matthews RG, et al. A candidate genetic risk factor for vascular disease: A common mutation in methylenetetrahidrofolate reductase. Nat Genet 1995; 10: 111-113.
13. Brattstrom L, Israelsson B, Norrving B, Bergqvist D, Thorne J, Hultberg B, et al. Impaired homocysteine metabolism in early-onset cerebral and peripheral occlusive arterial disease. Atherosclerosis 1990; 81: 51-60.
14. Boers GHJ, Smals AGH, Trijbels FJM, Fowler B, Bakkeren JAJM, Schoonderwaldt HC, et al. Heterozygosity for homocystinuria in premature peripheral and cerebral occlusive arterial disease. N Engl J Med 1985; 313: 709-715.
15. Bohórquez R, Isaza D. Diagnóstico y tratamiento del infarto agudo del miocardio. En: Texto de Cardiología. Bogotá: Sociedad Colombiana de Cardiología; 1999. p. 450-466.
16. Dudman NPB, Wilcken D, Wang J, Lynch JF, Macey D, Lundberg P. Disordered methionine/homocysteine metabolism in premature vascular disease. Arterioscler Thromb 1993; 13: 1253-1260.
17. Shipchandler MT, Moore EG. Rapid, fully automated measurement of plasma homocyst (e) ine with the Abbott IMx analyzer. Clin Chem 1995; 41: 991-994.
18. Lievers KJA, Kluijtmans LAJ, Heil SG, Boers GHJ, Verhoef P, Heijer M, et al. Cystathionine B-synthase polymorphisms and hyperhomocysteinemia: an association study. Eur J Hum Genet 2003; 11: 23-29.
19. Mutchinick OM, López MA, Luna L, Waxman J, Babinsky VE. High prevalence of the thermolabile methylenetetrahidrofolate reductase variant in Mexico: A country with a very high prevalence of neural tube defect. Mol Genet Metab 1999; 68: 461-467.
20. Casas JP, Bautista LE, Smeeth L, Sharma P, Hingorani AD. Homocysteine and stroke: evidence on a causal link from Mendelian randomisation. Lancet 2005; 365: 224-231.
21. Córdoba A., Arbeláez L, Castañeda S. Concentración plasmática de homocisteína en ayunas. Acta Med Colomb 2002; 27: 196-197.
22. Ubbink JB, Van der Merwe A, Delpot R, Allen RH, Stabler SP, Riezier R. The effect of a subnormal vitamin B-6 status on homocysteine metabolism. J Clin Invest 1996; 98: 177-184.
23. Bermúdez M, Frank N, Bernal J, Urreizti R, Briceño I, Merinero B, et al. High prevalence of CBS p.T191M mutation in homocystinuric patients from Colombia. Hum Mutat 2006; 27: 296-303.
24. Kolling K, Ndrepepa G, Werner K. Methylenetetrahidrofolate reductase gene C677T and A1298 C polymorphisms, plasma homocysteine, folate, and vitamin B12 levels and the extent of coronary artery disease. Am J Cardiol 2004; 93: 1201-1205.
25. Camacho O, Giusti B, Restrepo CM, Abbate R, Pepe G. Frequency of factor V (FV) Leiden and C677T methylenetetrahidrofolate reductase (MTHFR) mutations in Colombians. Thromb Haemost 1998; 79: 883-884.