Estudio del efecto antihipertensivo de la Salvia scutellarioides en un modelo de ratas hipertensas
Jorge Ramírez, M.D., MSc.1, Mauricio Palacios, M.D, MSc.2, Oscar Gutiérrez, M.D., M.Sc.3
1. Profesor Auxiliar, Departamento de Ciencias Fisiológicas, Escuela de Medicina, Universidad del Valle, Cali, Colombia. e-mail: jorgehramirez31@yahoo.com
2. Profesor Auxiliar, Departamento de Ciencias Fisiológicas, Escuela de Medicina, Universidad del Valle, Cali, Colombia. e-mail: maopalacios@uniweb.net.co maopalacios@yahoo.com
3. Profesor Asistente, Departamento de Ciencias Fisiológicas, Escuela de Medicina, Universidad del Valle, Cali, Colombia. e-mail: ogutie@telesat.com.co
Recibido para publicación: mayo 25, 2005. Aprobado para publicación: enero 17, 2006.
RESUMEN
Introducción: La infusión de los tallos y hojas de la planta Salvia scutellarioides (nombre vulgar: mastranto) es ampliamente utilizada en la medicina tradicional colombiana por sus efectos antihipertensivos y diuréticos. Hasta el momento no se han realizado estudios experimentales que validen el efecto antihipertensivo de la S. scutellarioides.
Objetivo: Estudiar el efecto de la S. scutellarioides en la presión arterial con un modelo de ratas hipertensas.
Metodología: Se tomaron treinta ratas machos repartidas en 5 grupos homogéneos y al azar así: grupo 1 solución salina (5 ml/kg p.o.) y solución salina (1 ml/kg i.p.), grupo 2. S. scutellarioides (1g/kg p.o.) y L-NAME (40 mg/kg i.p.), grupo 3. S. scutellarioides (2 g/kg p.o.) y L-NAME (40 mg/kg i.p.), grupo 4. enalapril (25 mg/kg p.o.) y L-NAME (40 mg/kg i.p.), grupo 5. solución salina (5 ml/kg p.o.) y L-NAME (40 mg/kg i.p.). Los tratamientos se administraron diariamente durante 4 semanas. La medición de la tensión arterial (sistólica, media y diastólica) se realizó de forma no invasiva con un tensiómetro de cola y un sensor piezoeléctrico.
Resultados: La administración de S. scutellarioides 2 g/kg produjo una reducción estadísticamente significativa en la tensión arterial media (TAM) y tensión arterial diastólica (TAD) en comparación con el grupo que recibió L-NAME y solución salina. La reducción producida por S. scutellarioides en la TAM y TAD es comparable con el grupo que recibió enalapril 25 mg/kg. La disminución en la TAM y TAD se obtuvo durante la semana 1 (p<0.001), en la semana 2 (p<0.01) y en la semana 4 (p<0.05) de tratamiento. La administración de S. scutellarioides 1 g/kg no tuvo efecto en la tensión arterial.
Conclusiones: El estudio corrobora la aparente actividad antihipertensiva informada por practicantes de la medicina tradicional de S. scutellarioides. Se requieren más estudios para determinar el perfil farmacológico y la toxicidad de la planta.
Palabras clave: Hipertensión. Salvia scutellarioides. Mastranto. Etnofarmacología. L-NAME. S. palaefolia.
Evaluation of the antihypertensive effect of Salvia scutellarioides in a rat model of hypertension
SUMMARY
Introduction: An infusion of stems and leaves of the plant Salvia scutellarioides (common name: Mastranto) is used in the Colombian traditional medicine due to its antihypertensive and diuretic effects. Up to date, no experimental studies have been done to validate the reported effects.
Objective: To determine the effect of S. scutellarioides in blood pressure using a model of hypertensive rats.
Methods: A total of thirty male rats were randomly distributed in five homogeneous randomly distributed groups: group 1. Normal saline solution (5 ml/kg p.o.) and normal saline solution (1 ml/kg i.p.); group 2. S. scutellarioides (1 g/kg p.o.) and L-NAME (40 mg/kg i.p.); group 3. S. scutellarioides (2 g/kg p.o.) and L-NAME (40 mg/kg i.p.); group 4. enalapril (25 mg/kg p.o.) and L-NAME (40 mg/kg i.p.); group 5. Normal saline solution (5 ml/kg p.o.) and L-NAME (40 mg/kg i.p.). The treatments were administered daily during four weeks. Blood pressure measurements (systolic, median and diastolic) were performed in a non invasive form using a tail pressure meter with a piezo electric sensor; furthermore, renal and cardiac histopathology were performed to all animals.
Results: The administration of S. scutellarioides 2 g/kg produced a statistically significant reduction of median blood pressure (MBP) and diastolic blood pressure (DBP) in comparison with the group that received L-NAME and normal saline solution. The MBP and DBP reduction produced by S. scutellarioides was comparable to that of the group that received enalapril 25 mg/kg. Reductions in MBP and DBP were obtained during the first week (p<0.001), second week (p<0.01), and fourth week (p<0.05) of treatment. The administration of S. scutellarioides 1 g/kg had no effect on the blood pressure. Both doses of S. scutellarioides used did not prevent damage to target organs in this model of hypertension.
Conclusions: The results of this study do coincide with the apparent antihypertensive activity of S. scutellarioides reported in the traditional Colombian medicine. Further studies are required to determine the plant’s pharmacological and toxicological profiles.
Key words: Hypertension. Salvia scutellarioides. Mastranto. Ethnopharmacology. L-NAME. S. palaefolia.
La hipertensión arterial (HTA) afecta aproximadamente a 26.4% de la población adulta y entre 60% y 70% de las personas en la séptima década de la vida1,2. En Colombia, se estima que más de 10 millones de personas presentan HTA (24.7% de la población adulta)3. La HTA es uno de los principales factores de riesgo para el desarrollo de enfermedades cardiovasculares y renales. Múltiples estudios epidemiológicos han mostrado que las enfermedades cardiovasculares son la primera causa de mortalidad en la mayoría de los países del mundo, incluyendo a Colombia2,4.
La infusión de los tallos y las hojas de S. scutellarioides se utilizan ampliamente en la medicina tradicional colombiana por sus efectos antihipertensivos y diuréticos5,6. Pese al amplio uso de la S. scutellarioides en Colombia, no se ha evaluado hasta la fecha el efecto de esta especie en la tensión arterial. Los análisis fitoquímicos realizados de la S. scutellarioides han informado que las hojas y tallos de la planta presentan una gran variedad de moléculas como alcaloides, triterpenos, lignanos y flavonoides7. Varias moléculas con efecto vasodilatador se han descrito en plantas de la familia Lamiaceae, algunas de estas como el ácido metiripariocromeno A (AMA) aislado de la Orthosiphon aristatus se evalúan en fases experimentales preclínicas y clínicas8.
La especie S. scutellarioides (familia: Lamiaceae–nombre vulgar: mastranto-sinonimia: S. palaefolia) es nativa de Colombia, donde crece de forma endémica en las regiones pacífica y andina a alturas entre 1600 y 3500 metros sobre el nivel del mar5,6. El presente estudio evalúa el efecto de la administración de S. scutellarioides en un modelo de ratas hipertensas por administración crónica de L-NAME. (NG-nitro-L-arginina metil ester). El L-NAME es un inhibidor irreversible de la enzima óxido nítrico sintasa (NOS) encargada de la producción de óxido nítrico en el endotelio a partir de la L-arginina. La inhibición de la NOS disminuye la producción de óxido nítrico (NO) ocasiona vasoconstricción, aumento de la liberación de renina e hipertensión arterial9.
METODOLOGÍA
Obtención de la planta y almacenamiento. La S. scutellarioides se recolectó en el kilómetro 18 vía Buenaventura en un mercado local de plantas medicinales. La identificación de la planta la realizó el doctor Phillipe Silverstone (biólogo botánico, Profesor Titular de biología, Facultad de Ciencias, Universidad del Valle); en el herbario del Departamento de Biología de la Universidad del Valle se almacenaron muestras de hojas, tallos y raíces de la S. scutellarioides. El material recolectado se lavó y después se desecó en un horno de flujo laminar a 35º C durante 48 horas. El almacenamiento se hizo en envases cerrados a una temperatura de 0º C. Los procesos empleados para colectar y procesar la planta se realizaron de acuerdo con las recomendaciones del CYTED (Ciencia y Tecnología para el Desarrollo) para la recolección y procesamiento de plantas medicinales10.
Preparación del extracto. Las hojas y tallos secos se fraccionaron mecánicamente; para cada preparación del extracto se tomaron 10 g del material a los que se les practicó un proceso de extracción con arrastre de vapor en 500 ml de H20 destilada. El extracto acuoso (EA) obtenido se colocó en un rotoevaporador hasta obtener un volumen de 25 ml equivalente a un extracto acuoso (EA) al 40% de concentración.
Animales de experimentación. El modelo experimental se realizó en ratas machos Sprague-Dawley machos con peso de 200 a 250 g y edad 8-10 semanas. Los animales se mantuvieron en el Bioterio de la Universidad del Valle con las siguientes condiciones: ciclo luz-día de 12 horas, temperatura 22-26ºC, seis animales por cada jaula, agua y comida ad libitum.
Método de registro de la tensión arterial. La tensión arterial sistólica (TAS), media (TAM) y diastólica (TAD) se midieron con un equipo de toma de tensión arterial no invasiva de seis canales [IITC six channels NIBPTM] consistente en una cámara para seis ratas, a temperatura constante de 31ºC; un tensiómetro de cola con un transductor piezoeléctrico conectado a un amplificador de pulsos y un scanner para alternar la medición entre cada rata sin manipular al animal. Los datos del amplificador para cada rata se envían al computador por medio de un equipo de adquisición de datos [MP100 data acquisition system-BIOPACTM] y se analizan mediante el software Acknowledge 3.07® BIOPACTM. El software monitorea el pulso y la tensión arterial en canales diferentes, el principio de los pulsos indica la TAS y el punto de máxima amplitud de los pulsos indica la TAM. La TAD se calcula de la siguiente forma:
TAD= (3TAM – TAS) / 2
Los métodos no invasivos para el registro de la TA han mostrado una buena correlación con el uso de catéteres intra-arteriales en ratas11.
Modelo de hipertensión con L-NAME. El modelo de hipertensión mediante L-NAME se utiliza ampliamente para estudiar la fisiopatología y la farmacología de la hipertensión arterial. Se ha descrito que la administración de L-NAME produce un aumento de 20% a 40% de la tensión arterial sistólica y diastólica en ratas 9. Además, el L-NAME produce fibrosis cardíaca y nefropatía, características de daño de órgano blanco similares a la hipertensión humana. La hipertensión por L-NAME se debe sobre todo a la vasoconstricción pues disminuye la síntesis de NO y al aumento en la síntesis de renina12,13. Por estos mecanismos, se ha descrito que la administración de IECAs junto con el L-NAME previene el desarrollo de hipertensión arterial y el daño de órgano blanco en este modelo 14-16. La administración de L-NAME se hizo al mismo tiempo con la S. scutellarioides, de la forma como se ha descrito en los protocolos y estudios basados en este modelo. Se escogió la dosis de 40mg/kg/i.p. de L-NAME por ser la que cursa con el mayor grado de fibrosis cardíaca y permite, evaluar el efecto de la S. scutellarioides en la prevención del daño de órgano blanco por hipertensión arterial13,17. Se tomaron 30 ratas machos y se repartieron al azar en 5 grupos homogéneos para la administración diaria de los siguientes tratamientos:}
. Grupo 1. Solución salina 0.9% (0.5 ml/kg intragástrico)+ solución salina (1 ml/kg i.p.)
. Grupo 2. S. scutellarioides 1 g/kg (5 ml/kg EA al 20% intragástrico)+L-NAME (40 mg/kg i.p.)
. Grupo 3. S. scutellarioides 2 g/kg (5 ml/kg EA al 40% intragástrico)+L-NAME (40 mg/kg i.p.)
. Grupo 4. Enalapril 25 mg/kg (5 ml/kg)+L-NAME (40 mg/kg i.p.)
. Grupo 5. Solución salina 0.9% (0.5 ml/kg intragástrico) +L-NAME (40 mg/kg i.p.)
Se tomaron medidas de TA antes de iniciar la administración de los tratamientos (semana cero) y luego cada semana durante 28 días. Al finalizar las cuatro semanas de tratamiento, se anestesiaron los animales con pentobarbital (100 mg/kg) para perfusión con solución salina isotónica (±200 ml) y seguidamente con formol amortiguado (±200 ml). Después de la perfusión, se extrajeron el corazón y los riñones de todos los animales. Los corazones se disecaron y pesaron para obtener la relación PVI/PC (peso ventricular izquierdo/peso corporal), índice utilizado para cuantificar el grado de hipertrofia ventricular. Por último, todas las muestras de corazón y riñón se procesaron para teñirlas con hematoxilina-eosina.
Análisis estadístico. Los resultados de tensión arterial sistólica, media y diastólica se expresaron como la media del grupo y se procesaron con un análisis de varianza (ANOVA) de medidas repetidas. Las diferencias entre los grupos se analizaron con el ajuste de Bonferroni. Se aceptó a priori una p<0.05 como indicador de diferencias estadísticamente significativas. Los datos se analizaron, procesaron y graficaron con el uso de GraphPad® Prism versión 4.0 para Windows® XP.
RESULTADOS
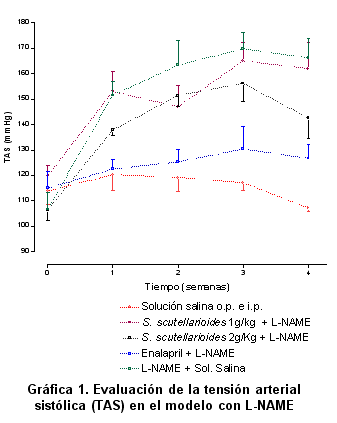
Antes de administrar los tratamientos (semana cero) no se observaron diferencias estadísticamente significativas en la TAS, TAM y TAD. La administración de S. scutellarioides (1 y 2 g/kg) no redujo significativamente la TAS si se compara con el grupo que recibió L-NAME+solución salina (Gráfica 1). Sin embargo, la dosis de 2 g/kg de S. scutellarioides produjo una disminución estadísticamente significativa en la TAM en las semanas 1 (p<0.01), 2 (p<0.01) y 4 (p<0.05) de experimentación frente al grupo L-NAME+solución salina (Gráfica 2). La TAD (Gráfica 3) también disminuyó con S. scutellarioides (2 g/kg) en las semanas 1 (p<0.001) y 2 (p<0.01). El grupo que recibió S. scutellarioides a dosis de 1 g/kg no presentó diferencias estadísticamente significativas con el grupo L-NAME+solución salina.
En la primera semana de tratamiento murieron dos ratas, una en cada uno de los grupos de S. scutellarioides (1 g/kg y 2 g/kg p.o.). La necropsia de los animales reveló que la causa de muerte fue broncoaspiración del extracto acuoso en ambos casos. No hubo otros casos de mortalidad después de esa primera semana.
El análisis microscópico de las histopatologías renales y cardíacas no mostró anormalidades para las ratas del grupo control (solución salina i.p. y p.o.) y el grupo tratado con L-NAME y enalapril. Por el contrario, se observó arterioloesclerosis, hipertrofia de cardiomiocitos y fibrosis cardíaca en el grupo que recibió solamente L-NAME y en los dos grupos tratados con L-NAME y S. scutellarioides (Gráfica 4). Los hallazgos histopatopatológicos del grupo de ratas hipertensas tratadas con enalapril fueron comparables al grupo control. En ninguno de los grupos experimentales se observó glomeruloesclerosis. El análisis estadístico de la relación PVI/PC no mostró diferencias estadísticamente significativas entre los grupos (Fotografía 1).
La Gráfica 1 muestra los valores semanales de TAS en ratas tratadas diariamente con solución salina al 0.9%, S. scutellarioides 1g/kg + L-NAME, S. scutellarioides 2 g/kg+L-NAME, enalapril 25 mg/kg+L-NAME y L-NAME+ solución salina durante 30 días. No se encontraron diferencias estadísticamente significativas entre los grupos tratados con S. scutellarioides con respecto al grupo control. Los datos se dan como el promedio ± error estándar de la media (n = 5-6.La Gráfica 2 muestra los valores semanales de TAM en ratas tratadas diariamente con solución salina al 0.9%, S. scutellarioides 1 g/kg + L-NAME, S. scutellarioides 2 g/kg + L-NAME, enalapril 25 mg/kg + L-NAME y L-NAME + solución salina durante 30 días. La administración de S. scutellarioides (2 g/kg) produjo una disminución estadísticamente significativa en la TAM en las semanas 1, 2 y 4; en comparación con el grupo que sólo recibió L-NAME. Los datos se presentan como el promedio ± error estándar de la media (n = 6).
La Gráfica 3 muestra los valores semanales de TAD en ratas tratadas diariamente con solución salina al 0.9%, S. scutellarioides 1 g/kg+L-NAME, S. scutellarioides 2 g/kg + L-NAME, enalapril 25 mg/kg + L-NAME y L-NAME + solución salina durante 30 días. La administración de S. scutellarioides (2 g/kg) produjo una disminución estadísticamente significativa en la TAD en las semanas 1 y 2; en comparación con el grupo que apenas recibió L-NAME. Los datos aparecen como el promedio ± error estándar de la media (n = 6).
La Gráfica 4 muestra la relación PVI/PC obtenida después del sacrificio de los animales en el modelo de hipertensión con L-NAME. No se encontraron diferencias estadísticamente significativas entre los grupos. Los datos figuran como el promedio ± error estándar de la media (n = 5-6).
DISCUSIÓN
Modelos animales de hipertensión. La hipertensión arterial es una enfermedad compleja y multifactorial acompañada de complicaciones cardíacas, renales y vasculares. Las características fisiopatológicas de la hipertensión de los modelos animales no se correlacionan totalmente con la hipertensión humana. Esto se debe a varias razones:
1. La etiología de los modelos animales de hipertensión arterial es secundaria, pues corresponde sólo a 5% de la población humana hipertensa.
2. Los modelos animales de hipertensión arterial producen de forma variable daño de órgano blanco; algunos modelos tienen mayor utilidad para el estudio de complicaciones renales o cardiovasculares.
3. Las complicaciones de la hipertensión arterial sólo se manifiestan en 15% de la población humana hipertensa. Por el contrario, en modelos animales de hipertensión la proporción de daño de órgano blanco es variable, pues se estima que entre 20% y 60% de los animales desarrollan complicaciones cardiovasculares y/o renales secundarias al aumento de la presión arterial (18).
El uso de ratas hipertensas espontáneas (SHR) es el más común hasta la fecha en estudios experimentales de hipertensión arterial. Sin embargo, es pertinente aclarar que el modelo SHR sólo se correlaciona con una pequeña proporción de la hipertensión humana (<1%) correspondiente a la mendeliana; además este modelo no desarrolla complicaciones vasculares, ateroesclerosis y accidente cerebrovascular19.
Modelo de hipertensión con L-NAME. El modelo de hipertensión por administración crónica de L-NAME es un modelo caracterizado por disfunción endotelial, vasoconstricción, activación del sistema renina-angiotensina-aldosterona y disminución de la tasa de filtración glomerular, características que también han sido descritas en la hipertensión primaria o esencial de los seres humanos. Uno de los distintivos del modelo de L-NAME es el mayor grado de fibrosis cardíaca y arterioloesclerosis en comparación con otros modelos de hipertensión. Además, este modelo también se caracteriza por desarrollo de hipertrofia cardíaca y daño renal, manifestaciones menos frecuentes en comparación con otros modelos como el de ratas Goldblatt (estenosis unilateral de la arteria renal) y el de ratas hipertensas tipo Dahl (cepa de ratas hipertensas al administrar dieta hipernatrémica)18.
La administración de S. scutellarioides 2 g/kg produjo una disminución de la TAM y TAD en las dos primeras semanas de experimentación, comparables con el descenso de la presión arterial en el grupo control y grupo de ratas hipertensas tratadas con enalapril. La administración de S. scutellarioides no produjo alteración de la TAS en ninguna de las dosis estudiadas. El efecto antihipertensivo del grupo de S. scutellarioides (2 g/kg) en la TAM y TAD disminuyó en las semanas tercera y cuarta de tratamiento.
La tolerancia al efecto antihipertensivo de la S. scutellarioides en el modelo con L-NAME se debe aclarar en futuros experimentos. Sin embargo, se pueden sugerir dos hipótesis que expliquen el desarrollo de tolerancia al efecto antihipertensivo de la planta:
1. El efecto farmacológico antihipertensivo de la planta se puede mediar por vasodilatación, que activa respuestas fisiológicas compensatorias como el sistema renina-angiotensina-aldosterona, aumento de las concentraciones de adrenalina y vasopresina. Estos mecanismos hormonales pueden compensar una reducción farmacológica de la presión arterial.
2. Múltiples mecanismos diferentes a la inhibición de la síntesis de NO se encuentran comprometidos en el desarrollo de hipertensión por L-NAME, los cuales podrían explicar la tolerancia al efecto antihipertensivo de la planta. Entre ellos se ha descrito que la administración crónica de L-NAME produce un aumento de la liberación de renina (20), aumento en la expresión de ARNm para ET-1 (21), hipersensibilidad microvascular para serotonina (22), activación del sistema nervioso autónomo simpático9, hiperreactividad del músculo liso a moléculas vasoactivas (23), hipertrofia vascular y sobre-expresión de la enzima convertidora de angiotensina (ECA) (24).
La relación PVI/PC no mostró diferencias significativas entre los grupos experimentales, resultados que son similares a los obtenidos por otros autores con este modelo13. El análisis histopatológico mostró hipertrofia de cardiomiocitos, arterioloesclerosis y focos de fibrosis cardíaca en el grupo de L-NAME y en ambos grupos que recibieron tratamiento con S. scutellarioides. La administración de enalapril concomitantemente con L-NAME previno el desarrollo de daño de órgano blanco, similar a lo descrito en publicaciones previas con la co-administración de IECAs y L-NAME16,25. A pesar de que la S. scutellarioides presentó un efecto antihipertensivo en las primeras dos semanas de tratamiento, esto no redujo las complicaciones cardiovasculares y renales en el modelo de hipertensión arterial con L-NAME. Sin embargo, se deben hacer futuros ensayos experimentales en otros modelos de hipertensión arterial para evaluar el efecto de esta planta en el desarrollo de lesiones en órgano blanco. El empleo de otros modelos de hipertensión se justifica porque algunos fármacos antihipertensivos (hidroclorotiazida, beta bloqueadores) no protegen contra el daño de órgano blanco en el modelo de L-NAME, pese a que su efectividad se ha visto en múltiples ensayos clínicos controlados26-28.
En Colombia, al igual que en otros países subdesarrollados, un porcentaje alto de la población recurre, en forma creciente y por diversas causas, a medicamentos herbolarios para el tratamiento de entidades crónicas como la hipertensión arterial. Es por tanto imperativo validar sus usos, conocer los efectos colaterales, toxicología, y los posibles mecanismos de acción. Los resultados obtenidos en este proyecto sumado al amplio uso en medicina tradicional de la S. scutellarioides justifican realizar estudios de toxicidad, ampliar a diferentes modelos animales de hipertensión arterial para determinar la seguridad y eficacia de su uso. Además, se requieren ensayos in vitro en órgano aislado y cultivos celulares para estudiar el perfil farmacológico de la S. scutellarioides; estos estudios se llevarán a cabo en conjunto con estudios bioquímicos y de biología molecular, para la obtención de los principios activos farmacológicos de la planta.
CONCLUSIONES
· El extracto acuoso de S. scutellarioides disminuye la TAD a una dosis de 2 g/kg durante las primeras dos semanas en el modelo de hipertensión arterial por L-NAME.
· El extracto acuoso de S. scutellarioides no tiene efectos significativos en la TAS del modelo empleado.
· Se requieren futuros estudios in vitro y otros modelos animales de hipertensión para aclarar los mecanismos subyacentes a estos resultados.
· La S. scutellarioides aunque aparentemente eficaz para reducir la TA, no previene el daño de órgano blanco en el modelo con L-NAME.
· Los resultados del estudio coinciden con la aparente actividad antihipertensiva informada por practicantes de la medicina tradicional de S. scutellarioides.
· Se requiere establecer definitivamente las características toxicológicas de la planta antes de iniciar los estudios clínicos limitados y controlados en humanos, para comprobar su efectividad como antihipertensivo y establecer los parámetros de uso, limitaciones y efectos colaterales.
AGRADECIMIENTOS
Los autores agradecen al doctor Edgar Duque sus aportes en el análisis de las muestras de histopatología. Este estudio fue financiado por COLCIENCIAS, proyecto código 11060413079.
REFERENCIAS
1. Staessen JA, Wang J, Bianchi G, Birkenhager WH. Essential hypertension. Lancet 2003; 36: 1629-1641.
2. Kearney PM, Whelton M, Reynolds K, Muntner P, Whelton PK, He J. Global burden of hypertension: analysis of worldwide data. Lancet 2005; 365: 217-223.
3. López PJ, Jaramillo JP. Papel de la dimetilarginina asimétrica (ADMA), un inhibidor endógeno del óxido nítrico, en la génesis de las enfermedades cardiovasculares. Cardiología al Día 2000; 3: 14-18.
4. López PJ. Las enfermedades cardiovasculares en los países subdesarrollados. En: Bioquímica del endotelio vascular: implicaciones fisiológicas y clínicas. 5ª ed. Bogotá, D.C.: Horizonte Impresores; 2001. p. 21-34.
5. Colmenares AJ, Ramírez AB. Salvia scutellarioides. En: Treinta plantas medicinales del Valle del Cauca. Fundamentos fitoquímicos y farmacológicos que sustentan sus usos. Cali: 2001. p. 49-50.
6. Bernal HY, Correa JE. Salvia palaefolia. En: Especies vegetales promisorias en los países del convenio Andrés Bello. Bogotá: SECAB; 1994. p. 1-156.
7. Ahmed AA, Castro B. Sesquiterpene lactones from Salvia palaefolia. Phytochemistry 1990; 29: 3581-3585.
8. Ohashi K, Bohgaki T, Shibuya H. Antihypertensive substance in the leaves of kumis kucing (Orthosiphon aristatus) in Java Island. Yakugaku Zasshi 2000; 120: 474-482.
9. Pechanova O, Dobesova Z, Cejka J, Kunes J, Zicha J. Vasoactive systems in L-NAME hypertension: the role of inducible nitric oxide synthase. J Hypertens 2004; 22: 167-173.
10. Sharapin N. Materias primas vegetales para la industria de productos fitoterapéuticos. In: Pinzón RS, (ed). Fundamentos de tecnología de productos fitoterapéuticos. Bogotá: CYTED; 2000. p. 17-26.
11. Widdop RE, Li XC. A simple versatile method for measuring tail cuff systolic blood pressure in conscious rats. Clin Sci (Lond) 1997; 93: 191-194.
12. Sventek P, Li JS, Grove K, Deschepper CF, Schiffrin EL. Vascular structure and expression of endothelin-1 gene in L-NAME-treated spontaneously hypertensive rats. Hypertension 1996; 27: 49-55.
13. Pechanova O, Bernatova I, Pelouch V, Babal P. L-NAME-induced protein remodeling and fibrosis in the rat heart. Physiol Res 1999; 48: 353-362.
14. Kung CF, Moreau P, Takase H, Luscher TF. L-NAME hypertension alters endothelial and smooth muscle function in rat aorta. Prevention by trandolapril and verapamil. Hypertension 1995; 26: 744-751.
15. Ono H, Ono Y, Frohlich ED. ACE inhibition prevents and reverses L-NAME-exacerbated nephrosclerosis in spontaneously hypertensive rats. Hypertension 1996; 27: 176-183.
16. Bernatova I, Pechanova O, Simko F. Effect of captopril in L-NAME-induced hypertension on the rat myocardium, aorta, brain and kidney. Exp Physiol 1999; 84: 1095-105.
17. Tribulova N, Okruhlicova L, Bernatova I, Pechanova O. Chronic disturbances in NO production results in histochemical and subcellular alterations of the rat heart. Physiol Res 2000; 49: 77-88.
18. Pinto YM, Paul M, Ganten D. Lessons from rat models of hypertension: from Goldblatt to genetic engineering. Cardiovasc Res 1998; 39: 77-88.
19. Pravenec M, Kren V. Genetic analysis of complex cardiovascular traits in the spontaneously hypertensive rat. Exp Physiol 2005; 90: 273-276.
20. Jover B, Mimran A. Nitric oxide inhibition and renal alterations. J Cardiovasc Pharmacol 2001; 38 (Suppl 2): 65-70.
21. Tharaux PL, Chatziantoniou C, Casellas D, Fouassier L, Ardaillou R, Dussaule JC. Vascular endothelin-1 gene expression and synthesis and effect on renal type I collagen synthesis and nephroangiosclerosis during nitric oxide synthase inhibition in rats. Circulation 1999 27; 99: 2185-2191.
22. Kadokami T, Egashira K, Kuwata K, Fukumoto Y, Kozai T, Yasutake H, et al. Altered serotonin receptor subtypes mediate coronary microvascular hyperreactivity in pigs with chronic inhibition of nitric oxide synthesis. Circulation 1996 15; 94: 182-189.
23. Henrion D, Dowell FJ, Levy BI, Michel JB. In vitro alteration of aortic vascular reactivity in hypertension induced by chronic NG-nitro-L-arginine methyl ester. Hypertension 1996; 28: 361-366.
24. Takemoto M, Egashira K, Usui M, Numaguchi K, Tomita H, Tsutsui H, et al. Important role of tissue angiotensin-converting enzyme activity in the pathogenesis of coronary vascular and myocardial structural changes induced by long-term blockade of nitric oxide synthesis in rats. J Clin Invest 1997; 99: 278-287.
25. Bernatova I, Pechanova O, Pelouch V, Simko F. Regression of chronic L-NAME-treatment-induced left ventricular hypertrophy: effect of captopril. J Mol Cell Cardiol 2000; 32: 177-185.
26. Takamitsu Y, Nakanishi T, Nishihara F, Hasuike Y, Izumi M, Inoue T, et al. A nitric oxide-generating beta-blocking agent prevents renal injury in the rat remnant kidney model. Comparative study of two beta-blocking drugs, nipradilol and propranolol. Nephron Physiol 2003; 93: 42-50.
27. De Oliveira CF, Nathan LP, Metze K, Moreno HJr., de L, I, Sucupira M, et al. Effect of Ca2+ channel blockers on arterial hypertension and heart ischaemic lesions induced by chronic blockade of nitric oxide in the rat. Eur J Pharmacol 1999 4; 373: 195-200.
28. Ono Y, Ono H, Frohlich ED. Hydrochlorothiazide exacerbates nitric oxide-blockade nephrosclerosis with glomerular hypertension in spontaneously hypertensive rats. J Hypertens 1996; 14: 823-828.