Estudio de alteraciones cromosómicas y su relación con el crecimiento in vitro en células de meningiomas
Carolina Isaza, M.D., M.Sc.1, Martha Isabel Escobar, M.Sc.1, Antonio Montoya, M.D.2, Jairo Sánchez, M.D.3
1. Profesora Titular, Departamento de Morfología, Escuela de Ciencias Básicas, Facultad de Salud, Centro de Estudios Cerebrales, Universidad del Valle, Cali, Colombia. e-mail: carolinaisa@uniweb.net.co e-mail: maiesbe@yahoo.com
2. Profesor Titular, Departamento de Neurocirugía, Escuela de Medicina, Hospital Universitario del Valle, Universidad del Valle, Seguro Social, Clínica Rafael Uribe Uribe, Cali, Colombia.
3. Neurocirujano, Seguro Social, Clínica Rafael Uribe Uribe, Cali, Colombia.
Recibido para publicación: octubre 11, 2004 Aprobado para publicación: enero 17, 2006.
RESUMEN
Objetivos: Demostrar la frecuencia de alteraciones cromosómicas y su relación con la velocidad de crecimiento in vitro en cultivos de células de meningiomas. Los datos obtenidos en estudios previos han enseñado que existe una asociación entre las alteraciones cromosómicas con el riesgo de recurrencia y el estadío del tumor.
Materiales y métodos: Se sometieron a cultivo muestras tomadas durante la cirugía de resecciones de meningiomas de cualquier localización, en enfermos del HUV, Clínica Rafael Uribe y clínicas particulares, previo consentimiento firmado de los pacientes o familiares. Se realizaron cultivos celulares, se determinó la velocidad de crecimiento y se obtuvo el cariotipo para definir las alteraciones cromosómicas en cada tumor.
Resultados: El 47% de los meningiomas que fue posible estudiar, presentan alteraciones cromosómicas diferentes o además de monosomía del cromosoma 22 que según publicaciones previas se asocian con progresión tumoral, y representan un riesgo de recurrencia mayor a 10%.
Conclusiones: Los estudios citogenéticos y la velocidad de crecimiento in vitro de las células tumorales, pueden ser un excelente complemento del resultado quirúrgico, del estudio patológico, que contribuirían a establecer el riesgo de recurrencia y así ayudar a definir el pronóstico para el paciente intervenido.
Palabras clave: Meningiomas; Cromosomas; Cultivo in vitro de células tumorales.
Chromosomal alterations of meningioma cells and its relation to growth in vitro
SUMMARY
Objectives: To demonstrate the frequency of chromosomic alterations and their relationship to the growth velocity of in vitro meningioma cells cultures. Data obtained in previous studies have shown that there is a kinship between chromosomic alterations, the risk of recurrence and tumor stage.
Materials and methods: Samples taken during meningioma resection surgery from any location were cultured. The samples were obtained from patients at the University Hospital, the Rafael Uribe Clinic and private clinics, previous informed consent either from patients or their relatives. Cell cultures were performed, speed of growth was measured, and the karyotype was obtained in order to define the chromosomic alterations present in each tumor.
Results: 47% of the meningiomas studied showed different chromosomic alterations or besides monosomy of the chromosome 22 that according to previous publications are associated to tumoral progression and represent a recurrence risk greater than 10%.
Conclusions: The cytogenetic studies and the in vitro cellular growth velocity of the tumoral cells could be excellent complements of the surgical result and the pathology study, contributing to establish the risk of recurrence, so helping to define the patient�s prognosis.
Key words: Meningioma; Chromosomes; In vitro tumoral cell culture.
En la población de Cali los meningiomas ocupan el segundo lugar entre las neoplasias del sistema nervioso central1. Esta entidad es más común en mujeres que en hombres, con una relación de 2:1, según el trabajo de Rohringer et al.2 Los menigiomas representan de 15% a 30% de los tumores intracraneales y son derivados de las células meningoteliales3,4. Su ubicación puede ser intracraneal o intraespinal. Por lo general se les considera como tumores benignos porque son circunscritos y separados del tejido nervioso; casi todos muestran un patrón histológico grado I WHO o típicos. Sin embargo, entre 15% y 25% presentan un índice mitótico aumentado y un mayor riesgo de recurrencia lo que los clasifica como meningiomas atípicos o grado II WHO, sólo 2% a 4% son francamente anaplásicos grado III WHO5.
Se ha informado que después de la resección total puede haber una recurrencia entre 7% y 32%, mientras que 50% pueden ser las cifras de las recidivas6. Otros estudios con seguimiento postquirúrgico a largo plazo también confirman esta índole, con recurrencias así: a 5 años, 15%; a 10 años, 22%; y a 15 años, 34%, según el grado de resección7.
Para dar un pronóstico quirúrgico del grado de resección se utiliza la clasificación de Simpson8, donde:
- Grado I: Extirpación completa de la lesión, incluso el hueso y la dura comprometida.
- Grado II: Resección tumoral completa acompañada únicamente de coagulación de la dura.
- Grado III: Extirpación tumoral completa, pero se dejan la dura y/o el hueso comprometido.
- Grado IV: Resección incompleta.
- Grado V: Descompresión.
El comportamiento clínico, quirúrgico, radiológico, y hasta los hallazgos histológicos no han sido suficientes y decisivos para determinar el pronóstico. Los tumores histológicamente clasificados como atípicos y anaplásicos tienen mayor riesgo de recurrencia; también se ha descrito de 15% a 25% de recurrencia en meningiomas benignos9. Actualmente se han integrado a estos estudios, el análisis de la actividad mitótica, el pleomorfismo celular, las micronecrosis y la densidad celular como indicadores de pronóstico. Todo lo anterior demuestra que la recurrencia tumoral parece no estar directamente relacionada con la velocidad de crecimiento del tumor. Desde el punto de vista clínico existe una respuesta muy variable, esta heterogeneidad sugiere una alta variabilidad biológica en este tipo de tumores.
En la búsqueda de una determinación más precisa del riesgo de recurrencia se han estudiado citogenéticamente y con biología molecular las células tumorales, y se encontró que es posible asociar las aberraciones cromosómicas y algunas mutaciones con la progresión tumoral10,11.
Diversos estudios han demostrado que existen variantes moleculares en una fracción relativamente grande de los meningiomas. La alteración genética más común corresponde a cambios del gen NF2 localizado en el cromosoma 2212-14, y a veces se han observado alteraciones en el gen TP53 que se ubica en el cromosoma 17. Aunque esta última es sobre todo rara en meningiomas y muy frecuente en astrocitomas15,16. Asimismo sucede con las alteraciones en el gen PTEN localizado en el cromosoma 10, el cual es común en los glioblastomas y se ha descubierto también en meningiomas anaplásicos17,18.
Todos estos genes se relacionan con el control del ciclo celular y tienen una función importante como genes supresores de tumor, de tal manera que cuando se pierden o por una mutación dejan de funcionar las células pierden uno de sus mecanismos de control favoreciendo la actividad mitótica y disminuyendo su capacidad de eliminar las células genéticamente dañadas, lo que permite la aparición de células tumorales. Entre más daños se acumulen de genes que participen en el control del ciclo celular más agresivas se tornan las células que participan en el desarrollo del tumor19,20. Por esto, con la citogenética al identificar aberraciones cromosómicas, se pueden determinar pérdidas de genes supresores de tumor y correlacionar estos hallazgos con la agresividad del tumor, la velocidad de crecimiento celular in vitro y los riesgos de recurrencia tumoral, como lo demostraron Ketter et al.10 al dividir los meningiomas en 4 grupos (de 0 a 3) de acuerdo con las alteraciones cromosómicas encontradas en las células tumorales y determinando las recurrencias durante 6 años de estudio21.
Con estos antecedentes en el presente trabajo, se propuso evaluar la correlación entre la velocidad de crecimiento in vitro de los meningiomas y las alteraciones cromosómicas y determinar su frecuencia en las células de los meningiomas estudiados.
MATERIALES Y MÉTODOS
Se obtuvieron durante 3 años muestras de las resecciones quirúrgicas de meningiomas de diferente localización que incluyen encéfalo y médula espinal, de pacientes del HUV, la Clínica Rafael Uribe y clínicas particulares de Cali, previo consentimiento informado. Se incluyeron todos los pacientes con diagnóstico clínico de meningioma con lesiones de cualquier tamaño operados por cirujanos que querían colaborar con el proyecto. Una parte de la muestra se envió a patología para estudio histopatológico de diagnóstico y la muestra para citogenética se obtuvo en el centro del tumor. Se incluyeron en el estudio todas las muestras remitidas al laboratorio con diagnóstico de meningioma, mediante un muestreo por conveniencia.
Se recibieron 44 especímenes, de pacientes en edades entre 2 y 85 años, con 79.5% mujeres. La muestra se transportó al Laboratorio de Citogenética del Departamento de Morfología, Facultad de Salud, Universidad del Valle, en un frasco estéril con solución salina al 0.9% y 10% de heparina, preferiblemente dentro de las primeras 12 horas después de cirugía.
Con el material recibido se hicieron 2 tipos de preparación para cultivo celular; el primero por separación celular mediante enzimas de digestión (tripsina EDTA) y el segundo mediante macerado manual con hoja de bisturí y siembra de explantos22.
Antes de sembrar los cultivos se hicieron pruebas de viabilidad celular con azul de tripan, y se encontró 75% de viabilidad celular cuando la muestra era traída en las primeras 24 horas después de la resección. De allí en adelante la viabilidad disminuye drásticamente y se hace muy difícil realizar el cultivo in vitro, por lo que se decidió sólo utilizar las muestras tomadas hasta 24 horas antes.
Los cultivos se inician al sembrar las células libres por digestión enzimática o los explantos en frascos de cultivo desechables y estériles, marca Falkon de 50 ml, con 5 ml de medio de cultivo H MEM o CHANG D. Se colocaron en incubadora de CO2 al 5% a 37ºC por 4 días sin mover. Al cuarto día se inició el seguimiento del cultivo para determinar la necesidad de cambiar el medio o alimentarlo. La velocidad de crecimiento se definió por los días que tomó el cultivo para hacer confluencia celular y crear monocapa. Cuando se obtuvieron suficientes células, con actividad mitótica se terminó el cultivo y se procedió a la cosecha.
Para detener el cultivo se agregaron 0.4 ml de colchicina a una concentración de 0.2 mg/25 ml por 40 minutos a 37ºC. Se retiró el medio de cultivo completamente a un tubo de centrífuga y se agregaron al cultivo 2 ml de tripsina EDTA a 37ºC por 5 minutos. Pasado este tiempo se recuperaron las células en el mismo tubo de centrífuga donde se había agregado el medio. Se centrifugó a 1.200 RPM por 10 minutos, se retiró el sobre nadante y se agregaron 8 ml de solución hipotónica de KCl al 0.075 M por 1 hora a 37ºC. Se centrifugó de nuevo, se retiró el sobrenadante y se inició la fijación de las células con solución fijadora de metanol: ácido acético en proporción de 3:1 durante 30 minutos la primera vez y otras 2 veces durante 10 minutos. Después de cada fijación se centrifugó, se descartó el sobrenadante y se agregó fijador limpio a temperatura ambiente.
Después de la tercera fijación se procedió a montar las láminas mediante goteo de la muestra. Se realizó tinción con bandas GTG y se hizo el estudio citogenético para determinar las alteraciones cromosómicas de cada tumor.
RESULTADOS
Del total de los 44 meningiomas cultivados se obtuvieron metafases para estudio citogenético en 32 (76%). En los tumores restantes no fue posible obtener el cariotipo por contaminación de la muestra o porque no hubo crecimiento celular in vitro, aunque se habían traído al laboratorio en las primeras 24 horas postquirúrgicas.
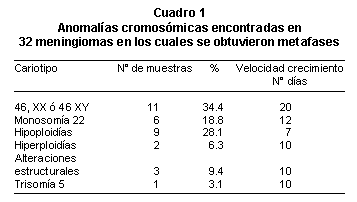
Del total de los 32 analizados citogenéticamente se encontró que 34% tienen un complemento cromosómico normal, mientras que 65.6% tienen alteraciones cromosómicas. Las anomalías más frecuentes corresponden a hipoploidías y monosomía del cromosoma 22 (Cuadro 1) (Figuras 1, 2, 3).
De acuerdo con la clasificación de Ketter et al.10, quienes dividieron los tumores según las alteraciones citogenéticas en 4 grupos para definir el riesgo de recurrencia, habría la siguiente distribución (Cuadro 2). Ellos no consideraron las alteraciones estructurales diferentes del cromosoma 1 ni las hiperploidías. Los resultados adicionalmente permiten observar en el Cuadro 1 que parece haber una correlación directamente proporcional entre la velocidad de crecimiento in vitro y las alteraciones cromosómicas9 (Figura 1).
DISCUSIÓN
Los meningiomas usualmente se han considerado benignos, y su grado de malignidad se relaciona con la capacidad de invadir tejido cerebral sano y el riesgo de recurrencia. Son tumores más frecuentes en mujeres que en hombres en una proporción de 2:1, en este estudio se encontró una mayor proporción de mujeres que lo informado antes con una razón de 3.8:1.
Histopatológicamente la WHO ha clasificado los meningiomas en 3 grados: grado I (tipo común), grado II (atípico o intermedio) y grado III (anaplásico).
A partir del 2001 con la publicación de Ketter et al.10 se establece una clara correlación entre las alteraciones citogenéticas y el riesgo de recurrencia de estos tumores pues se definieron 4 grupos que van de 0 a 3 (Cuadro 2). También observaron una fuerte analogía entre los hallazgos histológicos y los grupos citogenéticos.
Con seguimiento a 6 años, se considera que de acuerdo con el cariotipo, los tumores cuyo complemento cromosómico es normal o tiene monosomía del cromosoma 22, ofrecen un riesgo de recurrencia que oscila entre 2% y 7%, mientras que si sólo se usa la clasificación histopatológica los tumores grado I WHO tienen una recurrencia de 20.5% a los 5 años. La recurrencia de los tumores con hipoploidía es 10% y 30% cuando hay alteraciones del cromosoma 1.
Si se tiene en cuenta lo anterior 53% de los pacientes en este trabajo, tendrían un riesgo de recurrencia menor de 7%, mientras que 47% estarían por encima de una recurrencia de 10%. Este estudio sólo cuenta con 3 años de seguimiento de los pacientes por lo cual todavía no es posible sacar las recurrencias propias, sin embargo, de acuerdo con artículos previos se pueden sacar estas conclusiones.
Los resultados en Cali muestran correspondencia entre la velocidad de la proliferación celular y las alteraciones cromosómicas, particularmente para los tumores que se clasifican en los grados II y III y que comprometen sobre todo los cromosomas 22, 14, 5 y 1, lo que estaría de acuerdo con lo escrito por Ketter et al.10
El presente artículo, como otros, demuestra que el estudio citogenético de los meningiomas provee una información importante de los daños genéticos que tiene la célula y que se relaciona con su capacidad de división y progresión. Los estudios genéticos de los tumores, se orientan cada vez más a determinar que las recurrencias deben ser recidivas originadas en células tumorales que ya tienen alteraciones genéticas y continúan acumulando otras, que favorecen la progresión del tumor.
CONCLUSIÓN
Los estudios citogenéticos y el comportamiento in vitro de las células tumorales pueden ser un excelente complemento del resultado quirúrgico, del estudio patológico, para contribuir a establecer el riesgo de recurrencia y así ayudar a definir el pronóstico para el paciente intervenido. Este tipo de estudio es factible en el medio colombiano, con alta posibilidad de lograr un cultivo exitoso, pues se cuenta con el recurso tecnológico adecuado.
AGRADECIMIENTOS
Los autores agradecen a la Universidad del Valle y a Colciencias por el apoyo económico para el desarrollo de esta investigación. Al doctor Hernán Pimienta por su revisión crítica y sus aportes durante el trabajo, a Diana María Perilla, Alma Constanza Mosquera, Liliana Trejos, Beatriz Montoya, Rosario Rada y William Criollo, por su colaboración y apoyo en el trabajo de laboratorio. A Ana Milena Ocoró por su contribución en la recolección de las muestras.
REFERENCIAS
1. Registro Poblacional de Cáncer de Cali, Departamento de Patología, Escuela de Medicina, Facultad de Salud, Universidad del Valle, Cali, Colombia.
2. Rohringer M, Sutherland GR, Louw DF, Sima A. Incidence and clinico-pathological features of meningioma. J Neurosurg 1983; 58: 543-552.
3. Kepes JJ. Meningiomas. Biology, pathology, and differential diagnosis. New York: Masson; 1982. p. 27-28; 190-200.
4. Korshunov A, Shishkina L, Golanov A. Immunohistochemical analysis of P16INK4A, P18INK4C, P21CIP1, P27KIP1 and P73 expression in 271 meningiomas correlation with tumor grade and clinical outcome. Int J Cancer 2003; 104: 728-734.
5. Thomas J, Zvi R, Zvi H, et al. Comparative analysis of the NF2, TP53, PTEN, KRAS, NRAS and HRAS genes in sporadic and radiation-induced human meningiomas. Int J Cancer 2001; 94: 218-221.
6. Moller ML, Brandstrup O. No prediction of recurrence of meningiomas by PCNA and Ki-67 immunohistochemistry. J Neurooncol 1997; 34: 241-246.
7. Guthrie BL, Eberasold MJ, Scheithauer BW. Neoplasms of intracranial meninges.
In Youmans YR (ed.) Neurological
surgery .Philadelphia:
W.B. Saunders; 1990.
8. Simpson D. The recurrence of intracranial meningiomas after surgical treatment. J Neurol Neurosur Psychiatry 1957; 20: 22-39.
9. Bigner DD, McLendon RE, Bruner JM, et al. Pathology of tumors of the nervous system. 6th ed. London: Arnold; 1998. p. 67-139.
10. Ketter R, Henn W, Niedermayer I, et al. Predictive value of progression-associated chromosomal aberrations for prognosis of meningiomas: a retrospective study of 198 cases. J Neurosurg 2001; 95: 601-607.
11. Atkinson L, Schmiddek H. Genetic aspects of meningiomas. In: Meningiomas and their management. Philadelphia: W.B. Saunders; 1991. p. 42-47.
12. Ruttledge MH, Sarrazin J, Rangaratnam S, et al. Evidence for the complete inactivation on the NF2 gene in the majority of sporadic meningiomas. Nat Genet 1994; 6: 180-184.
13. Isaacs W, Bova S. Prostate cancer. En: Volgelstein B, Kinzler K (eds.). The genetic basis of human cancer. 2nd ed. New York: McGraw Hill; 2002. p. 719-729.
14. Levine AJ, Schmider HH. Molecular genetics of nervous system tumors. Chapter 1. New York: Wiley Liss; 1993. p. 22-23.
15. Wang JL, Zhang ZJ, Hartman M, et al. Detection of TP53 mutation in human meningiomas: a study using immunohistochemistry, PCR conformation polymorphism and DNA sequencing techniques on paraffin-embedded samples. Int J Cancer 1995; 22: 223-228.
16. Hill JR, Kuriyama N, Israel MA. Molecular genetics of brain tumors. Arch Neurol 1999; 56: 439-442.
17. Peters N, Wellenreuteher R, Rollbrocker B, et al. Analysis of the PTEN gene in human meningiomas. Neurpathol Appl Neurobiol 1998; 24: 3-8.
18. Darling JL, Warr TJ. Biology and genetics of malignant brain tumors. Curr Opin Neurol; 1998: 11: 619-625.
19. Mendelsohn J, Howley P, Israel M, et al. The molecular basis of cancer. 2nd ed. Philadelphia: W.B. Saunder Co; 2001. p. 3-47.
20. Haber D, Fearon E. The promise of cancer genetics. Lancet 1998; 351: 1-8.
21. Álvarez MG, Besa PC. Multidisciplinary approach to cancer. Surg Clin North Am 2000; 80: 24-37.
22. Doyle A, Griffiths JB. Cell and tissue culture for medical research. New York: John Wiley & Sons LTD; 2000. p.165-171; 306-317.