Suplementación oral de calcio en adolescentes embarazadas*
Julián A. Herrera, M.D.1, Myriam Arévalo-Herrera, Ph.D.2, Adriana Villegas, B.Sc.3, Sócrates Herrera, M.D.4, Maribel Villalba, M.D.5, Arnoldo Bromet, M.D.6
* Proyecto financiado por el Instituto Nacional para la Ciencia y la Tecnología (COLCIENCIAS) (Proyectos 1106-04-10275, 1106-04-12004) y la Gobernación del Valle (Convenio Secretaría de Salud del Valle y Universidad del Valle).
1. Profesor Titular y Emérito, Departamento de Medicina Familiar, Escuela de Medicina, Universidad del Valle, Cali, Colombia. e-mail: herreja@univalle.edu.co
2. Profesora Titular y Emérita, Instituto de Inmunología del Valle, Universidad del Valle, Cali, Colombia. e-mail: marevalo@inmuno.org
3. Bacterióloga, Laboratorio Asoclinic, Cali, Colombia.
4. Profesor Titular, Director Instituto de Inmunología del Valle, Universidad del Valle, Cali, Colombia. e-mail: sherrera@inmuno.org
5. Profesora Asociada, Directora Sección de Radiología, Departamento de Medicina Interna, Escuela de Medicina, Universidad del Valle, Cali, Colombia.
6. Profesor Asistente, Director Departamento de Medicina Familiar, Escuela de Medicina, Universidad del Valle, Cali, Colombia. e-mail: bromet@calipso.com.co
Recibido para publicación febrero 21, 2005 Aceptado para publicación marzo 31, 2006
RESUMEN
Objetivo: Determinar el efecto de la administración oral de calcio en adolescentes embarazadas de bajo nivel socioeconómico sobre las concentraciones de calcio ionizado plasmático y libre intracelular.
Métodos: En un ensayo clínico controlado doble-ciego aleatorizado se estudiaron 52 mujeres, 26 (50%) adolescentes embarazadas que recibieron 600 mg de calcio elemental y 26 (50%) adolescentes embarazadas que recibieron 600 mg de placebo entre las semanas 17 y 19 de embarazo. Los niveles pre-tratamiento y post-tratamiento de calcio ionizado plasmático y libre intracelular se evaluaron en ambos grupos de acuerdo con la intención de tratamiento.
Resultados: Se analizaron 48 adolescentes embarazadas que completaron el estudio (24 en el grupo de calcio y 24 en el grupo de placebo). Las características sociodemográficas de los grupos fueron comparables (p=0.92) al igual que la ingesta basal de calcio en su dieta (p=0.62). La suplementación oral de calcio por intención de tratamiento no modificó las concentraciones de calcio ionizado plasmático (1.19+0.04 mmol/l vs. 1.23+0.02mmol/l, p=0.56) ni las concentraciones del calcio ionizado libre intracelular (116.2 mmol/l vs. 89.7mmol/l, p= 0.91), se observó un resultado semejante en las embarazadas que recibieron placebo (1.20+0.05mmol/l vs. 1.19+0.03mmol/l p=0.86; 116.2mmol/l vs. 137.5 mmol/l, p=0.16, respectivamente).
Conclusiones: La administración oral de calcio en adolescentes embarazadas de bajo nivel socioeconómico no modificó ni las concentraciones plasmáticas ni las intracelulares del calcio ionizado lo que podría explicar en parte el poco efecto preventivo del uso del calcio como única medida de intervención para prevenir la preeclampsia.
Palabras clave: Calcio; Preeclampsia; Hipertensión arterial inducida por el embarazo; Calcio libre intracelular.
Calcium oral supplementation in adolescent pregnant women
SUMMARY
Objective: To determine the effect of oral administration of calcium on plasma and ionized free calcium concentration in healthy adolescent pregnant women.
Methods: In a double blind randomized controlled clinical trial were recruited 48 healthy adolescent pregnant women, 24 (50%) received 600 mg of elemental calcium and 24 (50%) received 600 mg of lactose placebo. At the inclusion time the plasma and intracellular free calcium concentrations were measured by standardized techniques. One month later the plasma and intracellular free calcium concentrations in both groups were measured.
Results: At the inclusion time and one month after treatment both groups were comparable for sociodemographic characteristics and the basal intake of calcium (p=0.92, p=0.62). Calcium supplementation did not modify the concentrations of plasma ionized calcium (1.19+0.04mmol/l vs. 1.23+0.02mmol/l, p=0.56) and the free intracellular calcium concentration (mmol/l vs. 89.7 mmol/l, p=0.91); similar effects were observed with the placebo treatment (1.20+0.05mmol/l vs. 1.19+0.03mmol/l p=0.86; 116.2mmol/l vs 137.5 mmol/l, p=0.16, respectively).
Conclusions: Oral administration of 600 mg of elemental calcium in adolescent pregnant women did not induce changes in the plasma and intracellular ionized free calcium concentrations and could explain in part the lack effect of this only supplementation in preeclampsia prevention.
Key words: Calcium; Preeclampsia; Pregnancy-induced hypertension; Prevention; Intracellular free calcium concentration.
La preeclampsia es la entidad más importante que contribuye a la morbilidad y mortalidad maternas, al parto prematuro, al retardo en el crecimiento intrauterino, y al bajo peso al nacer, especialmente en los países en vías de desarrollo. Si bien la causa de la enfermedad no es conocida hay cinco mecanismos que se han postulado para explicar su fisiopatología:
1. Vasoespasmo producido por un aumento en la sensibilidad del músculo vascular a sustancias vasopresoras.
2. Una producción anormal de complejos inmunes y un incremento de la actividad del sistema renina-angiotensina.
3. Desequilibrio entre prostaglandinas vasoactivas (tromboxano A2 y prostaciclina).
4. Vasoespasmo causado por disfunción endotelial1.
5. Alteración en la acción del óxido nítrico relacionado con una alta inactivación por radicales libres secundarios a procesos inflamatorios2.
La prostaciclina y la prostaglandina E2 producida en el endotelio vascular son potentes vasodilatadores e inhibidores de la agregación plaquetaria, mientras el tromboxano A2 que generan las plaquetas3 es un potente vasoconstrictor y facilitador de la agregación plaquetaria. Se ha observado que una disminución en los niveles de PG E2 se asocia con un incremento en la respuesta vascular a la angiotensina II en las mujeres embarazadas susceptibles de desarrollar hipertensión arterial inducida por el embarazo y preeclampsia4 probablemente por intermedio de la regulación de los niveles de calcio ionizado libre intracelular5-7. Se acepta que las pacientes con preeclampsia presentan unas altas concentraciones de calcio libre intracelular8,9.
Un ensayo clínico controlado para evaluar el efecto de la suplementación oral de calcio en la prevención de preeclampsia observó que esta suplementación no redujo la incidencia o severidad de la enfermedad10. Además, un reciente meta-análisis demostró un efecto protector en la suplementación de calcio tan sólo en pacientes embarazadas con una baja ingesta basal de calcio en su dieta (<900 mg/día)11. El objetivo de este estudio es investigar si la administración oral de calcio en adolescentes embarazadas de bajo nivel socioeconómico con una ingesta basal baja de calcio en su dieta tiene algún efecto sobre las concentraciones plasmáticas de calcio ionizado y sobre las concentraciones de calcio ionizado libre intracelular.
MATERIALES Y MÉTODOS
En el estudio se incluyeron primigrávidas adolescentes sanas en el Hospital Francisco de Paula Santander en Santander de Quilichao, Colombia, en el Centro de Salud de Meléndez, Cali, y en el Centro de Salud de Siloé en Cali, Colombia, entre agosto de 2002 y agosto de 2003. Los criterios de inclusión fueron estado primigestante, edad menor de 19 años, edad gestacional entre 17 y 19 semanas, no presentar enfermedad médica en el momento del ingreso, una ingesta basal de calcio <900 mg/día. La edad gestacional se determinó de acuerdo con la fecha de la última menstruación si ésta era confiable apoyada en períodos regulares entre 26 y 31 días. Además, la edad gestacional se confirmó con una ecografía que se hizo en el primer trimestre del embarazo.
La enfermera responsable de la consulta externa prenatal de las instituciones que participaron en el estudio, seleccionaba y citaba las pacientes que cumplían los criterios de inclusión para que el grupo de investigación las evaluara. Una vez verificados los criterios de inclusión, las embarazadas elegibles que aceptaron voluntariamente participar en el estudio, recibieron información acerca de los objetivos generales del estudio y se les pidió firmar los consentimientos informados escritos. El Comité de Ética de Investigación en seres humanos de la Facultad de Salud de la Universidad del Valle aprobó este estudio antes de su principio.
Los médicos diligenciaron cuestionarios que incluían características sociodemográficas y obstétricas. Una nutricionista hizo un inventario nutricional para evaluar la ingesta basal de todas las participantes, con un cuestionario validado12,13. Antes de iniciar el tratamiento, a cada participante se le tomaron 20 ml de sangre venosa periférica para evaluar las concentraciones plasmáticas de calcio ionizado y las concentraciones intracelulares de calcio ionizado libre. Los linfocitos periféricos se aislaron mediante Fycoll-hypaque (Pharmacia & Upjohn, Bridgewater, NY, USA) y se usaron para medir las concentraciones de calcio ionizado libre mediante un método descrito previamente14. Después de separar los linfocitos se lavaron las células en solución de sal balanceada (HBSS) que contenía suero fetal al 1% (FSC) y se diluyeron hasta una concentración de 107 cel/ml. Luego se incubaron estas células por 30 minutos a 37°C en una solución que tenía una concentración final de Fluo-3/AM (4 µg/ml) y FuraRed (10 µg/ml). Posteriormente los linfocitos se diluyeron en 4 ml de HBSS 1% FCS y se incubaron durante 10 min a 37°C; después se les lavó y se les diluyó de nuevo para mantenerlos en una habitación a temperatura ambiente por 15 minutos. Las pruebas se leyeron en un equipo FACSort (Becton Dickinson, Series B 0266, San José, CA) a 37°C. Todas las pruebas se repitieron un mes después de estar recibiendo el tratamiento.
En un ensayo clínico controlado que se hizo en Colombia y en países asiáticos, se vio que el uso de calcio y de ácido linoleico, suplementados en el embarazo redujeron las concentraciones intracelulares de calcio ionizado15 en una muestra de 24 pacientes por grupo, que sirvió de parámetro de referencia, pues el presente estudio fue hecho en la misma población, para descubrir las diferencias en las concentraciones intracelulares de calcio con su adición como único suplemento. Para calcular la muestra del presente estudio se asumió un error alfa de 0.1 y un error beta de 0.2 en las embarazadas adolescentes de bajo nivel socioeconómico con una ingesta basal baja de calcio (<900 mg). Se sabe que el mayor efecto protector de la suplementación del calcio en el embarazo para prevenir la preeclampsia es en gestantes con ingesta basal baja de calcio en la dieta. Esto hace pensar que en este grupo de personas se pueden producir los mayores cambios en las concentraciones intracelulares de calcio con su suplementación, que, al ser un criterio de inclusión, disminuye de modo significativo el tamaño de la muestra. Con todas las anteriores consideraciones, se calculó una muestra de 26 pacientes por cada grupo.
Para administrar el calcio y el placebo las mujeres embarazadas se asignaron al azar a dos grupos: grupo experimental (n=26) que recibió una dosis oral diaria de 600 mg (una cápsula dos veces al día), grupo control (n=26) que recibió placebo (600 mg de lactosa, una cápsula dos veces al día). No hubo desigualdades en peso, tamaño, sabor o color entre las cápsulas de tratamiento o de placebo que se dieron a todas las embarazadas del estudio. La dosis de calcio se calculó a partir de la diferencia entre las necesidades fisiológicas y la ingesta basal de la dieta de calcio en la población estudiada. Todas las participantes fueron instruidas para tomar las cápsulas a la misma hora. El cumplimiento de la ingesta se evaluó al contar las cápsulas sobrantes en el frasco entregado. Las adolescentes embarazadas continuaron su control prenatal en su respectiva institución.
Para la designación aleatoria de las embarazadas elegibles que aceptaron voluntariamente participar, se siguió el siguiente procedimiento: De acuerdo con el orden de ingreso al estudio se les asignó un código que fue secuencial. Este código lo conocía el investigador para saber el número de pacientes incluidas en el estudio hasta ese momento, pero no identificaba el grupo al que pertenecería la paciente. Luego ésta tomaba un sobre opaco cerrado que se encontraba ordenado según la asignación aleatoria establecida antes por el paquete estadístico, escogiendo la paciente el sobre de manera aleatoria, al abrirlo en su interior se encontraba una tarjeta cerrada que contenía el código de asignación, cuyo interpretación no era conocido ni por la paciente ni por el investigador. Las tarjetas de asignación aleatoria fueron preparadas y cerradas, igualmente los sobres opacos, por una persona externa al estudio de investigación. Los códigos de asignación aleatoria se prepararon con el paquete estadístico True Epistat version 5.0 (Epistat Services, Richardson, TX, USA). La asignación de las pacientes se hizo de manera centralizada en cada institución participante.
Una vez se terminó el ensayo clínico controlado, para averiguar el probable efecto que la gestación pudiera tener sobre la absorción y metabolismo del calcio, como posible variable de confusión, se realizó una evaluación adicional en 12 mujeres voluntarias que se encontraban en edades reproductivas (sin embarazo) y que recibieron la misma dosis de calcio elemental (600 mg/día) para evaluar igualmente las concentraciones plasmáticas e intracelulares de calcio ionizado. La inclusión de las voluntarias y su seguimiento se hizo en el Centro de Atención Ambulatoria La Selva, del Seguro Social, en Cali, Colombia.
Se efectuaron análisis univariado y bivariado. Las diferencias en las variables continuas se evaluaron con la prueba t (doble cola) con distribución normal y con la prueba de Kruskall-Wallis para variables que no tengan distribución normal; la pruebac2 o prueba exacta de Fischer (si el menor valor está por debajo de 5) se usó para analizar diferencias en variables categóricas. Se definió un valor p <0.05 como significante.
RESULTADOS
Entre agosto de 2002 y agosto de 2003, se evaluaron 214 primigestantes en los centros colaboradores del estudio; de ellas 58 (27.1%) cumplían los criterios de inclusión y 52 (89.5%) aceptaron participar y firmaron el consentimiento informado y se las asignó de manera aleatoria 26 (50%) al grupo de calcio y 26 (50%) al grupo placebo.
Se excluyeron del análisis final dos pacientes del grupo de calcio y dos del grupo placebo porque no asistieron a la evaluación de seguimiento y de control que se citó un mes de iniciado el tratamiento; esto se consideró como un retiro voluntario. Las exclusiones de las gestantes del grupo experimental (8.4%) y del grupo control (8.4%) no modificaron la interpretación de los resultados.
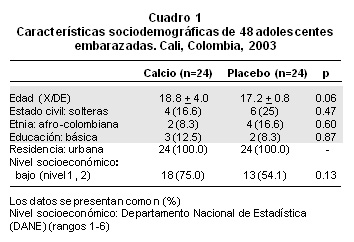
Los grupos fueron comparables respecto a las variables sociodemográficas (edad, raza, nivel socioeconómico, estado civil, nivel educativo, sitio de residencia) (Cuadro 1) y en la ingesta basal diaria de calcio (experimental: pre-terapia: 580 mg/día (rango 285-920), post-terapia 590 mg (rango 270-950) p=0.92; control: pre-terapia: 570 (278-892), post-terapia 664 mg (rango 382-912) p=0.62), al igual que los factores de riesgo obstétrico como la edad gestacional en el momento de la inclusión (17.7+0.5 semanas vs. 18.2+0.8 semanas, p=0.17), el índice de masa corporal (IMC) (21.9+2.5 vs. 21.2+3.8, p=0.17) y la anemia (14, 54.1% vs 15, 62.5%, p=0.76). La mediana basal de la ingesta de calcio de todas las mujeres incluidas en el ensayo clínico controlado fue 588 mg/día (rango: 270-890). Al evaluar los cambios antes y después en las concentraciones de calcio, no se observaron cambios significativos en las concentraciones plasmáticas de calcio ionizado (Cuadro 2) ni en las concentraciones de calcio ionizado libre intracelular en las embarazadas (Cuadro 3). Después de un mes de tratamiento no hubo diferencias en los niveles plasmáticos de creatinina (0.75 mg/dl+0.2 vs. 0.70 mg/dl+0.1, p=0.65) entre los dos grupos.
En las pacientes que terminaron el estudio se analizó la adherencia al tratamiento y se vio que fue similar en ambos grupos, según se evaluó por el cumplimiento en la ingesta de las cápsulas mediante el recuento de cápsulas sobrantes en la consulta de control (experimental: 82%, placebo: 91% p=0.60). No se informaron ni espontáneamente ni en el interrogatorio efectos colaterales atribuibles a las cápsulas.
Para evaluar la posible contribución del efecto del embarazo sobre las concentraciones de calcio en el ensayo clínico controlado, el estudio descriptivo que se hizo después con mujeres en edad reproductiva no embarazadas, a quienes se dio la misma dosis de suplemento oral de calcio que recibían las embarazadas en el ensayo clínico, tampoco hubo modificación en las concentraciones plasmáticas e intracelulares de calcio libre ionizado (Cuadro 3).
DISCUSIÓN
En el momento de la inclusión al estudio los grupos fueron comparables para las características sociodemográficas (Cuadro 1) y para la ingesta basal diaria de calcio. La baja tasa de abandono del estudio se justificó por la baja dosis de calcio recibida garantizando una buena tolerancia gastrointestinal y el corto período de seguimiento. La adherencia al tratamiento, de acuerdo con la intención, fue bastante aceptable si se tiene en cuenta que las mujeres en estudio eran adolescentes, y el cumplimiento del protocolo en las que terminaron el estudio fue por lo menos 82% sin diferencias significativas entre los grupos.
En un ensayo clínico controlado para evaluar el efecto del calcio a fin de prevenir la preeclampsia, que se efectuó en cinco universidades de Estados Unidos10, a las pacientes primigrávidas sanas se las eligió al azar para recibir suplemento oral de 2 g de calcio elemental (n=2.295) o placebo (n=2.294) y se observó que la suplementación de calcio no disminuyó la incidencia ni la severidad de la preeclampsia. El promedio de ingesta basal diaria fue 1,113+691 mg en el grupo experimental y 1,135+675 mg en el grupo placebo. El riesgo relativo para el desarrollo de preeclampsia no tuvo efecto protector.
Se ha visto que las pacientes con preeclampsia presentan deficiencias en las concentraciones de calcio extracelular con bajos niveles de calcio ionizado plasmático2,16,17. La intervención nutricional en pacientes embarazadas de alto riesgo en una población andina donde se administraron 2 g de calcio elemental, mantuvo altos niveles de calcio ionizado circulante22. El calcio ionizado extracelular es crucial para la síntesis de sustancias vasoactivas como la prostaciclina y el óxido nítrico en las células endoteliales18. En pacientes con hipertensión arterial hay una correlación inversa entre el calcio plaquetario y el calcio ionizado plasmático y apoya la hipótesis que los pacientes hipertensos poseen factores que permiten al calcio intracelular estar elevado lejos de los niveles del calcio extracelular19. En el presente estudio el calcio ionizado plasmático aumentó en el grupo experimental lo cual demuestra que el calcio se absorbió en forma adecuada, sin embargo no hubo diferencia estadísticamente significativa con respecto al grupo placebo (Cuadro 2) quizá debido a que en este estudio se utilizaban dosis bajas (600 mg de Ca2+ elemental), si se comparan con las usadas en estudios previos (2 g elemental)2,10,20-23.
Altas concentraciones de calcio libre intracelular se han visto en los linfocitos de pacientes con preeclampsia pero no en mujeres normotensas o en embarazadas con hipertensión arterial crónica8,24. La concentración basal de calcio libre intracelular puede aumentar si se abren los canales de la membrana celular, al movilizar los depósitos intracelulares o si se limita la salida de calcio al espacio extracelular9,25. Las dosis de calcio usadas en este estudio se calcularon sólo para completar las necesidades fisiológicas del embarazo. Esto podría explicar por qué no hubo diferencias significativas en las concentraciones de calcio ionizado plasmático (Cuadro 2). La suplementación con altas dosis de calcio (2 g) puede mantener altos niveles de calcio ionizado plasmático en mujeres embarazadas2; sin embargo, el efecto de esas altas dosis sobre las concentraciones de calcio libre intracelular en mujeres embarazadas con alto riesgo de preeclampsia no se conoce por completo. En este estudio la ingesta total de calcio (ingesta basal de la dieta más dosis suplementada) fue comparable con la ingesta basal de calcio del ensayo clínico de prevención de preeclampsia10 donde la incidencia de ésta fue similar en el grupo suplementado con calcio que la que recibió placebo.
Los resultados finales del ensayo clínico controlado de la OMS en África, Asia y Latinoamérica en 8,400 embarazadas con ingesta basal baja de calcio (<600 mg/día)26 no mostraron una reducción de preeclampsia al suplementar 1,500 mg de calcio elemental desde épocas tempranas en el embarazo; esto tiene coherencia y plausibilidad biológica con los resultados en este estudio.
De acuerdo con los hallazgos del presente trabajo, la administración oral temprana de 600 mg de calcio elemental, a diario, durante el embarazo, no modificó las concentraciones de calcio ionizado plasmático ni el calcio libre intracelular; además, los resultados en mujeres no embarazadas indican que el efecto de la gestación no altera las concentraciones de calcio intracelular con las dosis de calcio que se emplearon. Por tanto, los resultados de este estudio podrían ayudar a explicar en parte por qué el calcio que se administra de manera única tiene poco efecto para prevenir la preeclampsia, como se comprobó en el estudio americano10 y en el internacional multicéntrico de la OMS26.
AGRADECIMIENTOS
Los autores agradecen la colaboración del Hospital Regional Francisco de Paula Santander, Santander de Quilichao, Cauca, del Centro de Salud Meléndez, Cali, del Centro de Salud de Siloé, Cali, y del Laboratorio de Inmunología Asoclinic, Cali, Colombia por su ayuda para el desarrollo de este proyecto.
REFERENCIAS
1. Vizontai ZZ, Rigo J, Dezzi I. The role of vascular nitric oxide in the pathomechanism of preeclampsia. Orv Hetil 1995; 136: 2547-2551.
2. López-Jaramillo P. Calcium, nitric oxide, and preeclampsia. Sem Perinat 2000; 24: 33-36.
3. Dusting GJ, Moncada S, Vane JR. Prostacycline: Its biosynthesis, actions, and clinical potential. Adv Prostaglandins Thromboxane Leukot Res 1982; 10: 59-106.
4. Moncada S, Vane JR. Pharmacology and endogenous roles of prostaglandin, endoperoxides, thromboxane A2, and prostacyclin. Pharmacol Rev 1979; 30: 293-331.
5. Zemmel MB, Zemmel PC, Bemry S. Altered platelet calcium metabolism as an early predictor of increased peripheral vascular resistance and preeclampsia in urban black women. N Engl J Med 1990: 323: 434-438.
6. Haller H, Oeney T, Hanck T. Increased intracellular free calcium and sensitivity to angiotensin II in platelets of preeclamptic women. Am J Hypertens 1989; 2: 238-243.
7. Kilby MD, Broughton PF, Hepinstall SA. A cross-sectional study of platelet intracellular free calcium concentration throughout normal and hypertensive primigravid pregnancy. Br J Obstet Gynecol 1989; 96: 1242-1246.
8. Hojo M, Suthanthiran M, Helseth G, et al. Lymphocyte intracellular free calcium concentration is increased in preeclampsia. Am J Obstet Gynecol 1999; 180: 1209-1214.
9. Baker PN, Kilby MD, Broughton FP. The effect of angiotensin II on platelet intracellular free calcium concentration in human pregnancy. J Hypert 1992; 10: 55-60.
10. Levine RJ, Hauth JC, Curet LB, et al. Trial of calcium to prevent preeclampsia. N Engl J Med 1997; 337: 69-76.
11. Villar J, Belizan J. Same nutrient, different hypotheses: disparities in trials of calcium supplementation during pregnancy. Am J Clin Nutr 2000; 71 (5 Suppl): 1375-1379.
12. Cameron M, Staveren W, Loken E. Manual on methodology for food consumption studies. 24-hour recall. Oxford: University Press; 1988. p. 83-88.
13. Cameron M, Staveren W, Haraldsdottir J. Manual on methodology for food consumption studies. Food frequency. Oxford: University Press; 1988. p. 92-95.
14. Novak EJ, Rabinovich PS. Improved sensitivity in flow cytometric intracellular ionized calcium measurement using fluo 3/fura red fluorescence ratios. Cytometry 1994; 17: 135-141.
15. Herrera JA, Arévalo-Herrera M, Shahabuddin AKM, et al. Calcium and conjugated linoleic acid supplementation reduces pregnancy-induced hypertension incidence and decreases intracellular concentrations of ionized free calcium. Am J Hypert 2006; 19: 381-387.
16. Seeley EW, Wood RJ, Brown EM, et al. Lower serum ionized calcium and abnormal calciotropic hormone levels in preeclampsia. J Clin Endocrinol Metab 1992; 74: 1436-1440.
17. López-Jaramillo P, Yépez R, Narváez M, et al. Calcium metabolism in normal pregnancy and pregnancy-induced hipertension. J Bras Gynecol 1988; 98: 189-191.
18. López-Jaramillo P, González MC, Palmer RMJ, et al. The crucial role of physiological Ca2+ concentrations in the production of endothelial nitric oxide and the control of vascular tone. Br J Pharmacol 1990; 101: 489-493.
19. Osborne CG, McTyre RB, Dudek J, et al. Evidence for the relationship of calcium to blood pressure. Nutr Rev 1996; 54: 365-382.
20. López-Jaramillo P, Narváez M, Félix C, et al. Dietary calcium supplementation and prevention of pregnancy-induced hypertension. Lancet 1990; 335: 293-299.
21. López-Jaramillo P, Delgado F, Jácome P, et al. Calcium supplementation reduces the risk of preeclampsia in Ecuadorian teenagers. Obstet Gynecol 1997; 90: 162-167.
22. López-Jaramillo P, Narváez M, Weigel M, et al. Calcium supplementation reduces the risk of pregnancy-induced hypertension in an Andean population. Br J Obstet Gynaecol 1989; 96: 648-655.
23. Carroli G, Duley L, Belizán JM, et al. Calcium supplementation during pregnancy. A systematic review of randomized controlled trials. Br J Obstet Gynaecol 1994; 101: 753-758.
24. Steinert JR, Wyatt AW, Poston L, et al. Preeclampsia is associated with altered Ca2+ regulation and NO production in human fetal venous endothelial cells. FASEB J 2002; 167: 721-723.
25. Thway TM, Shlyskov SG, Day MC, et al. Antibodies from preeclamptic patients stimulate intracellular Ca2+ mobilization through angiotensin receptor activation. Circulation 2004; 110: 1612-1619.
26. Villar J, Abdel-Aleey H, Merialdi M, et al. World Health Organization randomized trial of calcium supplementation among low calcium intake in pregnant women. Am J Obstet Gynecol 2006; 194: 639-649.