Comparación de métodos diagnósticos en la infección por Helicobacter pylori en Quindío, Colombia
José Ignacio Moncayo, M.Sc. Microbiol.1, Jorge Javier Santacruz, M.Sc. Microbiol.1, Ada Lucy Álvarez, Bacteriol.2, Beatriz Franco, M.D.3, Manuel Alfonso López, M.D.3, Alberto Ángel, M.D.3, Martha Lucía Gallego, Biol.Mol.Biotec.3, Herman Serrano, Ph.D.4
1. Profesor Titular, Departamento de Ciencias Básicas, Área Microbiología, Facultad de Ciencias de la Salud, Universidad Tecnológica de Pereira, Risaralda, Colombia. e-mail: jimo@utp.edu.co santacruz@utp.edu.co
2. Laboratorio de Microbiología y Parasitología, Facultad de Ciencias de la Salud, Universidad Tecnológica de Pereira, Risaralda, Colombia. e-mail: adalucy@yahoo.es
3. Profesor Asociado, Departamento de Ciencias Clínicas, Facultad de Ciencias de la Salud, Universidad Tecnológica de Pereira, Risaralda, Colombia. e-mail: befranco2002@yahoo.com.mx lopezcorrea@telecom.com albeanho@hotmail.com mgallego@uniquindio.edu.co
4. Profesor Asociado, Programa de Medicina, Facultad Ciencias de la Salud, Universidad del Quindío, Armenia, Colombia. e-mail: albeanho@hotmail.com mgallego@uniquindio.edu.co
5. Profesor Asistente, Facultad de Ciencias Básicas, Universidad Tecnológica de Pereira, Risaralda, Colombia. e-mail: serrano@utp.edu.co
Recibido para publicación: mayo 31, 2005 Aceptado para publicación junio 15, 2006
RESUMEN
Introducción: El Helicobacter pylori es un bacilo gramnegativo que infecta la mucosa gástrica de más de la mitad de la población mundial; causa gastritis, enfermedad ulcero-péptica, y se asocia tanto con carcinoma gástrico como con linfoma gástrico (MALT).
Objetivo: Comparar el índice de desempeño de los métodos de diagnóstico de rutina y la PCR para establecer por definición de caso la prevalencia de infección por H. pylori en pacientes con enfermedad acido-péptica en Quindío.
Metodología: A 73 pacientes se les tomaron seis biopsias de cada uno, una antral para la PCR-ureC, tres para cultivo (antral, cuerpo y fondo gástricos), otra antral para prueba rápida de ureasa (PRU) y ésta junto con una del cuerpo para el examen histológico. Se determinó el índice de desempeño de cada uno de los métodos. Para el diagnóstico decisivo de la infección se consideró como definición de caso (H. pylori positivo) el cultivo positivo o la concordancia de por lo menos dos métodos de diagnósticos positivos (examen histológico, PRU y PCR).
Resultados: El examen histológico del antro fue positivo en 79.5% (58/73) y en cuerpo 82.2% (60/73); la combinación de los resultados de las dos biopsias del estudio histológico fue 94.5% (69/73). Los cultivos de las tres biopsias mostraron idéntico resultado en 75.4% (55/73); la combinación de los resultados del cultivo en las tres biopsias fue 86.3% (63/73). La PRU en biopsia antral fue positiva en 79.5% (58/73) y la PCR-ureC de biopsia antral fue 86.3% (63/73). De acuerdo con la definición de caso la prevalencia de la infección por H. pylori fue 97.3 % (71/73). Al comparar los resultados de cada método frente al obtenido por definición de caso, el examen histológico, el cultivo, la PCR y PRU presentaron 2, 8, 8, y 13 falsos negativos, respectivamente, pero no hubo falsos positivos. Los índices de desempeño (ID) para cada método fueron: Cultivo: ID, 78.1% y 88.7% de sensibilidad, resultado idéntico para las tres biopsias (antral, cuerpo y fondo); PRU: ID, 82.2% y sensibilidad 81.7%. Examen histológico: ID, 87.0% y sensibilidad 86.6%, en la biopsia antral e ID, 89.9% en cuerpo y sensibilidad 90.9%. Y la PCR-ureC con ID. 89.0% y sensibilidad 88.7%. Al combinar los resultados de los cultivos en las tres biopsias se aumentó su ID a 89.0% con sensibilidad de 88.7% y el estudio histológico de las dos biopsias también mostró un incremento a 97.3% con sensibilidad de 97.2%. El ID en la histología mostró diferencias significativas frente a los otros métodos.
Conclusión: Para el diagnóstico final de infección por H. pylori se puede utilizar el concepto de definición de caso, lo que permite establecer una prevalencia real de la infección que es superior a la detectada por los métodos individuales. Además, si no es posible emplear el concepto de definición de caso se recomienda el examen histológico por lo menos en dos biopsias (antral y cuerpo).
Palabras clave: Helicobacter pylori; PCR; Examen histológico; Prueba rápida de la ureasa; Gen ureC.
Comparison of methods in the diagnosis of Helicobacter pylori infection in Quindío, Colombia
SUMMARY
Introduction: Helicobacter pylori is a gramnegative bacterium that colonizes the gastric mucosa, and infects more than half of the worldwide population, causing gastritis and ulcer-peptic disease and being associated with gastric carcinoma and gastric lymphoma (MALT).
Objective: To compare the performance index of techniques of routine diagnosis and PCR in order to establish by case definition the prevalence of infection by H. pylori in patients with gastroduodenal disease in Quindío.
Methodology: In 73 patients were taken six biopsies. One antral for the PCR-ureC, three for culture (antral, body and fundus), other antral for rapid urease test (RUT). The previous were united to one of the body for histological examination. The performance index was established for each of the methods. For definitive diagnosis of the infection we used the case definition (positive H pylori) was used: A patient was classified as H. pylori positive with isolation of bacteria in culture or based on the agreement of at least two positive tests (histological examination, RUT and PCR).
Results: The histological examination was positive 79.5% (58/73) in antral biopsy and in body 82.2% (60/73) and the combination of both biopsies was 94.5% (69/73). Culture assessment in the three biopsies showed identical results, 75.4% (55/73) and by combination all biopsies were 86.3% (63/73). The RUT in antral biopsy was 79.5% (58/73) and for PCR-ureC of antral biopsy was 86.3% (63/73). The prevalence for H pylori infection was 97.3% (71/ 73) in accordance with the case definition. The comparison of the results of each method in front of the result by case definition, the histological examination, culture, PCR and RUT presented 2, 8, 8, and 13 false negative in their order and none presented false positives. Performance indexes (PI) for each method were: Culture, 78.1% with sensibility, 88.7%, and identical results in three biopsies. The RUT, had 82.2% and 81.7% of sensibility. The histological examination was 87.0% with 86.6% of sensibility in antral biopsy and 89.9% in body biopsy with sensibility of 90.9%. And PCR-ureC had 89.0% with sensibility, 88.7% The combination of the results for the three biopsies for culture increased their PI to 89.0% with sensibility of 88.7%. The combination of results of the two biopsies in the histological examination also showed PI increased of 97.3% with sensibility of 97.2% and showed significant differences in front of the other methods.
Conclusion: For the definitive diagnosis of H pylori infection it should use the case definition concept which allows establishing the real prevalence of the infection being higher than detected by the individual methods. Additionally, if it is not possible to utilize the case definition concept, is recommended the histological examination in two biopsies (antral and body).
Key words: Helicobacter pylori; PCR; Histological examination; Rapid urease test; Gene ureC.
El Helicobacter pylori es un bacilo gramnegativo, en forma de espiral o curvado, móvil con flagelos múltiples envainados en un polo de la célula; es un microorganismo microaerófilo que coloniza la mucosa gástrica del hombre1-3.
La infección por H. pylori es una de las más comunes en el mundo, la bacteria infecta a más de la mitad de la población mundial, causa gastritis y enfermedad ulcero-péptica y se asocia con carcinoma gástrico y linfoma gástrico tipo MALT4-6.
La prevalencia de infección por H. pylori varía según edad, localización geográfica y estatus socioeconómico de los individuos7. En muchas personas la infección por H. pylori se tolera bien por períodos prolongados con poca o ninguna sintomatología. El riesgo de desarrollar enfermedad ulcero-péptica en personas infectadas por H. pylori se estima mayor a 10%8. La prevalencia de la infección es alta en países en vía de desarrollo si se compara con los países desarrollados. Entre adultos jóvenes en los países en vía de desarrollo está por encima de 80%8,9. En Colombia, un estudio en menores del Departamento de Nariño mostró 55% de prevalencia de la infección a los dos años y 80% a los 8 años de edad10. Bravo et al.11, encontraron 96% de seroprevalencia en un grupo de 18 a 24 años. Moncayo et al.12, informaron 86% de prevalencia en pacientes con enfermedad ulcero-péptica en el Departamento de Risaralda.
Para el diagnóstico de la infección hay varios métodos que se pueden emplear a fin de descubrir la presencia de H. pylori. Los métodos invasivos como el cultivo, la prueba rápida de ureasa (PRU) y el examen histológico que requieren endoscopia y biopsia y los no invasivos que no necesitan endoscopia, como la prueba del aliento (urea breath test: UBT), la demostración de antígenos de H. pylori en materia fecal (H. pylori stool antigen test, HpSA test); y las pruebas serológicas que se basan en el descubrimiento específico de anticuerpos anti-H. pylori13,14.
El método bacteriológico de referencia para identificar H. pylori es el cultivo, la sensibilidad está entre 70% y 95% al menos cuando se trata de material gástrico obtenido mediante biopsia. Sin embargo requiere de medios de cultivos especiales, condiciones de incubación microaerófila e incubación de 5 a 7 días y no es apropiado para el estudio de muestras en los que haya otros agentes patógenos en cantidad considerable como sucede con la materia fecal o la saliva. La tasa de resultados negativos del cultivo se puede minimizar con la toma de dos biopsias antrales o con una tercera del cuerpo o fondo del estómago15-19.
La prueba de ureasa, que se utiliza para demostrar la presencia de la actividad enzimática derivada del metabolismo bacteriano tiene una sensibilidad de 90% a 95% en biopsia, 90%-95% en aire exhalado y 90%-96% en orina5,20. Cualquier actividad enzimática de la ureasa en biopsias de la mucosa gástrica se considera positiva para H. pylori. Varias pruebas rápidas de ureasa están disponibles comercialmente (CLO Test, Pyloritek, Hp-fast). Estas pruebas tienen sensibilidad y especificidad excelentes. Sin embargo, su sensibilidad se puede reducir bajo ciertas circunstancias y un resultado negativo no necesariamente significa ausencia de la infección. La prueba puede dar resultados falsos negativos en individuos con sangrado reciente o activo del tracto gastrointestinal superior21 y en enfermos que antes hayan tomado inhibidores de la bomba de protones, antagonistas del receptor-H2, antibióticos o compuestos que contengan bismuto22.
Otro método de rutina es el estudio histológico a través del cual se puede demostrar en forma directa la presencia del germen en una muestra de mucosa gástrica, lo que también permite evaluar la gastritis subyacente. En la práctica común, la coloración hematoxilina-eosina da buenos resultados. Existen otras coloraciones especializadas como las de Warthin-Starry, Genta, Giemsa, azul de toluidina modificada que son útiles cuando la bacteria no se descubre por hematoxilina-eosina pero hay evidencia de inflamación23-25. La sensibilidad del examen histológico se reduce por el consumo de medicamentos antisecretorios en forma similar a la prueba de ureasa en la biopsia21,22.
En la actualidad se dispone de varias técnicas moleculares para descubrir H. pylori que ofrecen excelentes posibilidades en el diagnóstico. En los últimos años, se han aplicado métodos basados en la reacción en cadena de la polimerasa (PCR) para la detección de H. pylori en muestras de biopsia y jugo gástrico, saliva, placa dental y heces26-31.
Aunque existen varios métodos de diagnóstico, la sensibilidad y especificidad de cada uno de ellos puede variar por diferentes factores como se mencionó antes; si se tiene en cuenta que la sensibilidad de una prueba se puede definir como la capacidad de dar un resultado positivo en todos los pacientes infectados con la bacteria, mientras que la especificidad es la habilidad para dar negativo en todos los no infectados. Estas definiciones puntualizan la necesidad de tener un método de referencia que sea capaz de determinar todos aquellos individuos en verdad infectados. Infortunadamente, los métodos que se emplean en el diagnóstico de la infección por H. pylori no cumplen estos criterios. Una solución sería usar el producto de una combinación de dos o más métodos que se consideren como confiables y compararlos con los resultados de los métodos individuales, con este criterio, un verdadero positivo puede ser un caso donde dos o más métodos son positivos y un resultado verdadero negativo donde todos los métodos son negativos31,32. Así, pues, en la presente investigación se definió un caso H. pylori positivo por el aislamiento de la bacteria en cultivo o con base en la concordancia de por lo menos dos métodos de diagnóstico positivos (PRU, examen histológico y PCR-ureC). Este parámetro permite identificar con mayor certeza los verdaderos positivos y los verdaderos negativos y establecer por definición de caso la prevalencia de infección por H. pylori en pacientes con enfermedad ácido péptica en Quindío. Adicionalmente, se compararon los índices de desempeño de cada uno de los métodos seguidos para diagnosticar la infección.
MATERIALES Y MÉTODOS
De acuerdo con el censo de población para el Departamento del Quindío, se calculó una muestra de tamaño n=73 con 5% de frecuencia esperada, 10% de error permisible y 95% de nivel de confianza. Se incluyeron todos los individuos de cualquier edad y sexo que al examen endoscópico presentaran enfermedad ácido-péptica y asistieran a consulta en la unidad de gastroenterología del Hospital San Juan de Dios de Armenia en el período comprendido entre abril y septiembre del año 2003.
Los criterios de inclusión fueron: no haber ingerido antibióticos o inhibidores de la bomba de protones o bismuto durante los quince (15) días o las seis6 semanas antes de la endoscopia, respectivamente y que residiesen en el Departamento del Quindío. Todos aceptaron voluntariamente por escrito participar en el estudio de acuerdo con las normas establecidas por el Comité de Bioética de la Facultad de Ciencias de la Salud de la Universidad Tecnológica de Pereira.
Definición de caso. Un paciente se clasificó como H. pylori positivo por aislamiento de la bacteria en cultivo o con base en la concordancia de por lo menos dos métodos de diagnóstico positivos (PRU, examen histológico y PCR-ureC). Este criterio permite identificar con mayor certeza los verdaderos positivos y los verdaderos negativos31,32.
Análisis estadístico. A partir de los datos obtenidos en las cuatro pruebas, se calcularon intervalos de confianza con las proporciones en 95% de confiabilidad, y se realizaron las pruebas de hipótesis bilaterales para las igualdades de las proporciones en las cuatro pruebas. A fin de evaluar el desempeño de cada método, se determinó en cada caso si el resultado de la prueba coincidía con la definición de caso, y con esta base se calculó el índice de desempeño (ID) dividiendo el número total de aciertos (positivos y negativos) de la prueba por el número de casos. Por último, se hizo una prueba de hipótesis de igualdad de proporciones para comparar los desempeños de las distintas pruebas. Además, se calcularon la sensibilidad y la especificidad de cada método de acuerdo con la definición de caso.
Endoscopia gastroduodenal. A cada participante se le tomaron 6 biopsias, y para descubrir en ellas H. pylori se distribuyeron así: en una biopsia antral el Laboratorio de Microbiología de la UTP practicó la prueba rápida de ureasa (PRU). Esta biopsia junto con una biopsia del cuerpo se utilizó en el examen histológico. Para el cultivo se emplearon tres biopsias (antro, cuerpo y fondo). La sexta biopsia (antral) se sometió a la prueba de la PCR.
Cultivo. Las biopsias se transportaron en forma refrigerada (0°C, Nalgene Labtop Cooler) en caldo tioglicolato con glicerol al 20%. Retiradas las biopsias del medio de transporte, se maceraron en solución salina estéril con un homogeneizador manual (Deltaware Pellet Pestle) y se sembraron en la superficie de agar tripticasa soya (BBL) suplementado con sangre de oveja al 7%, Isovitalex (BBL) y los antimicrobianos vancomicina, anfotericina, bacitracina, polimixina B y trimetoprim19.
La incubación se realizó bajo condiciones microaerofílicas así: O2, 5%; CO2, 10%; y N2, 85%; a 37ºC por 5 a 7 días (Water Jacketed Incubator, Nuaire). Las colonias sospechosas de ser H. pylori, se confirmaron con coloración de Gram por observación microscópica de bacilos gramnegativos curvados, y pruebas positivas de oxidasa (Bactident Oxidase, Merck), catalasa (Bactident Katalase, Merck) y ureasa (solución de urea al 10%), según técnicas de rutina estándar. Los microorganismos aislados se subcultivaron en agar tripticasa soya, libre de antibióticos y se preservaron a -70ºC en glicerol al 20% en caldo BHI (Merck).
Prueba rápida de ureasa (PRU). A partir de una biopsia antral, se hizo la PRU. El Laboratorio de Microbiología de la UTP, fabricó el reactivo así: se preparó una solución amortiguadora de fosfatos a pH 6.8 (Na2HPO4 y NaH2PO4.1H2O) con urea al 10% y rojo de fenol al 0.1% como indicador de pH y se consideró positiva por el viraje del reactivo de anaranjado a fucsia después de 5, 10, 20, 60 minutos de lectura.
Examen histológico (EH). Se utilizó la coloración de hematoxilina-eosina (H-E) y azul de toluidina modificada. Para el caso de la coloración de azul de toluidina modificada descrita por Vartanian et al.25, no se utilizó alcian amarillo para contraste como lo describen esos autores, sino que se usó solamente el Blau-O de Merk para microscopía, diluido al 1% en agua desionizada. La placa desparafinada se sumergió en esta solución durante un1 minuto, luego se lavó con agua corriente, se deshidrató y se montó con citorresina. La cuchilla del micrótomo fue desechable de perfil bajo para evitar contaminación entre las biopsias procesadas. Al paciente se le consideró H. pylori positivo cuando por la observación microscópica se identificó la bacteria en cualquiera de las biopsias procesadas. Las placas las estudiaron dos patólogos en forma independiente.
Reacción en cadena de la polimerasa para el gen ureC (PCR-ureC). Para extraer el ADN de la biopsia se utilizó el protocolo descrito por Valentine33. Brevemente, se homogeneiza la biopsia y se agrega un amortiguador de extracción de tejidos (Tris-HCl 50 mM, pH7.2; EDTA 1 mM con SDS al 1% y 100 mg de proteinasa K/ml). Se incuba a 55°C por 2 horas. La extracción del ADN se realizó por la técnica de fenol-cloroformo-alcohol isoamílico. El ADN se resuspende en 100 ml de amortiguador TE 1x estéril y se almacenó a -20°C para posterior análisis.
La PCR se llevó a cabo en un volumen de 25 ml en termocicladores GeneAmp PCR System 9700 y 2400, Perkin Elmer. Se utilizó una pareja de iniciadores para amplificar el gen ureC: 5’-AAG CTT TTA GGG GTG TTA GGG GTT T-3’ y 5’ -AAG CTT ACT TTC TAA CAC TAA CGC -3’, amplifica para 294 pb34. La mezcla de reacción contenía: 10 mM Tris HCl (pH 9.0), 50 mM KCl, 2.5 mM MgCl2, 0.01 de gelatina; deoxinucleósido trifosfato 200 mM c/u, glicerol al 7% (v/v). Taq polimerasa (Sigma) 1.25 U, iniciadores 10 pmoles c/u y 10 ml de ADN de biopsia.
El programa de amplificación para PCR-ureC fue el siguiente: Desnaturalización inicial 94° C por 5 minutos, seguido de 35 ciclos de desnaturalización a 94°C por 1 minuto, acoplamiento a 60°C por 1 minuto y extensión a 72°C por 1 minuto, y una extensión final a 72°C por 4 minutos. Las cepas de referencia de H. pylori 8822 y 60190, donadas gentilmente por el doctor Martin Blaser de la Universidad de Vanderville, Nashville, Estados Unidos, se utilizaron como control positivo de ureC. Cantidades de 15 ml de cada mezcla obtenida por PCR, se sometieron a electroforesis en gel de agarosa al 2% (Sigma) y se tiñeron con bromuro de etidio. Un paciente fue considerado como H. pylori positivo cuando la PCR-ureC amplificó para 294 pb.
RESULTADOS
Resultados por edad y género. De los 73 pacientes estudiados, 19 (26%) eran hombres y 54 (74%) mujeres, con edades entre 13 y 84 años; casi todos los pacientes (30.1%) se ubicaron en un rango de edad entre 31 y 40 años.
Resultados según patología gastroduodenal y H. pylori positivo. El estudio endoscópico reveló que 70 pacientes presentaban algún tipo de gastritis (95.9%), de los cuales sólo 40 tenían gastritis y los otros 30 presentaban gastritis asociada con otra enfermedad gastroduodenal. De los 70 pacientes con gastritis 68 fueron H. pylori positivos para una correlación de 97.1% entre la entidad más frecuente, la gastritis y H. pylori. De los 3 pacientes restantes (4.1%), dos tenían úlcera duodenal y uno esofagitis con hernia hiatal y fueron H. pylori positivos.
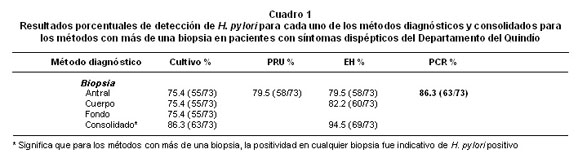
Resultados según el porcentaje de positivos que detectó cada uno de los métodos. El Cuadro 1 muestra los resultados de detección de H. pylori por cada uno de los métodos en los 73 pacientes del estudio.
Los resultados obtenidos para cada uno de los métodos se discriminan de la siguiente forma:
· Para el caso del examen histológico se utilizaron dos biopsias (antral y corpus) y la visualización microscópica de la bacteria en cualquiera de las dos biopsias en los cortes histológicos coloreados con azul de toluidina modificada, fue indicativo de la presencia de H. pylori. La combinación de los resultados de las dos biopsias mostró que 94.5% de los pacientes tenían H. pylori.
· En el cultivo se utilizaron tres biopsias (antro, cuerpo y fondo) y el aislamiento de la bacteria en cualquiera de las tres, fue indicativo de la presencia de H. pylori. La combinación de los resultados de las tres biopsias estableció que 86.3% de los pacientes tenían la bacteria.
· Los resultados para la PRU en biopsia antral establecieron que 79.5% de los pacientes tenían H. pylori.
· Los resultados en la PCR-ureC de biopsia antral estableció que 86.3% de los pacientes tenían la bacteria. En la Figura 1 se muestra el patrón electroforético.
Resultados de acuerdo con la definición de caso. Según la definición de caso un paciente se clasificó como H. pylori positivo con base en el aislamiento de la bacteria en cultivo o con base en la concordancia de por lo menos dos métodos de diagnóstico positivos (EH, PRU y la PCR) 31,32. De acuerdo con la definición anterior la prevalencia de la infección en la población estudiada fue 97.3% (71/73).
Por definición de caso, en el EH, el cultivo, la PCR y la PRU hubo 2, 8, 8, y 13 falsos negativos, respectivamente; en ningún método diagnóstico se encontraron falsos positivos, para una especificidad de 100% en los cuatro sistemas.
Desempeño de los métodos en cada una de las biopsias procesadas. El Cuadro 2 muestra los ID y la sensibilidad de los cuatro métodos según el origen de la biopsia. El ID en el método EH en las dos biopsias (antral y cuerpo) no mostró diferencias significativas entre ellos (z=-0.47), biopsia antral (87%) y biopsia del cuerpo (89.9%). El ID en el método del cultivo en las tres biopsias (antral, cuerpo y fondo) fue idéntico para 78.1% sin diferencias estadísticamente significativas entre ellos. El ID en la PCR en biopsia antral fue 89%. El ID en la PRU en biopsia antral fue 82.2%.
Al realizar un análisis comparativo del ID entre los métodos únicos y exclusivos para biopsia antral, no se observaron diferencias estadísticas significativas entre ellos. En el cálculo del ID se tuvo en cuenta la combinación consolidada de los resultados en EH y cultivo donde se utilizó más de una biopsia y de su comparación con los otros métodos se obtuvieron los datos que se muestran en el Cuadro 3. Los consolidados del cultivo frente a los ID del cultivo en antro, cuerpo y fondo, mostraron diferencias significativas. El mismo análisis entre consolidado del EH versus antro o cuerpo indicó diferencias significativas únicamente en el antro (z=-2.05).
Al comparar los ID de los consolidados entre el cultivo y el EH se observaron diferencias significativas (z=-1.97). El ID consolidado del cultivo frente a la PRU (z=1.17) y PCR (z=0) no produjo diferencias significativas, pero el EH si las mostró frente a la PRU (z=-2.99) y PCR (z=1.97). En resumen el ID consolidado del EH fue el único método que señaló diferencias estadísticamente significativas ante los otros métodos.
DISCUSIÓN
La infección por H. pylori tiene una distribución mundial. La prevalencia es más alta en países en vía de desarrollo que en los industrializados. En aquéllos, 4 de 5 personas están infectadas hacia los 20 años de edad. En los Estados Unidos, la infección es rara en niños menores y la probabilidad de infectarse guarda relación con la edad y el origen étnico. Hoy la prevalencia en Estados Unidos está alrededor de 30%. La raza negra y los hispanos están infectados en mayor proporción que los blancos. Esta diferencia no es de origen racial sino socioeconómico y educacional, especialmente del estatus socioeconómico durante la niñez 8,9.
En Colombia, en un estudio en menores del Departamento de Nariño la infección mostró una prevalencia de 55% a los dos años de edad y de 80% a los 8 años10. La seroprevalencia vista por Bravo et al.11 en un grupo de 18 a 24 años fue 96%. Moncayo et al.12 encontraron una prevalencia de 86% en pacientes con enfermedad úlcero-péptica en el Departamento de Risaralda. La prevalencia para el Departamento del Quindío fue 97.3% en los pacientes con enfermedad ácido péptica. Si se tiene en cuenta que el Hospital San Juan de Dios de Armenia es regional y público y atiende a personas de bajos recursos económicos, se explicaría la alta prevalencia de la infección que varía según la edad, la localización geográfica y el estatus socioeconómico de los individuos 7,22,35.
La demostración de la infección para H. pylori en cultivo, muestra un amplio rango de sensibilidad. El espectro de los datos publicados es muy variable. Algunos informan sensibilidad baja, otros sensibilidad mayor de 90%, lo cual depende de los diversos factores que influyen la obtención de cultivos positivos para H. pylori4,16,26. Es probable que a estos factores se deba la presencia de falsos positivos en este método diagnóstico. En el presente estudio el ID del método en biopsia antral, corpus y fondo fue idéntico y está dentro del rango que informan otros estudios14,15,17-19. Yousfi et al.16 no vieron diferencias estadísticamente significativas en biopsia antral versus biopsia del corpus, aun en pacientes donde falló la terapia antimicrobiana. De acuerdo con los resultados para este estudio los pacientes tenían una «pan-infección» debido a la amplia distribución de H. pylori en la mucosa gástrica demostrada por la positividad en las tres biopsias de distintas regiones del estómago. En el presente estudio tampoco se encontraron diferencias estadísticamente significativas en el ID si la biopsia era de origen antral, de cuerpo o de fondo. Pero en el cultivo si aumentó cuando se combinaron (consolidado) los resultados de las tres biopsias.
Cuando clínica indica la endoscopia está, el método de diagnóstico de primera escogencia es la PRU en biopsia antral22. La detección de la actividad de la ureasa en la biopsia es rápida y barata. Sin embargo, hay datos variables en cuanto a sensibilidad y especificidad de la PRU y depende de varios factores, como el tipo de prueba disponible (comercial o «casera»), el tiempo de lectura, concentraciones de los componentes de la prueba, cantidad y viabilidad de las bacterias presentes en la biopsia y la concentración total de producción de la ureasa36.
La mayor parte de las PRUs comercialmente disponibles indican sensibilidad y especificidad muy buenas entre 79% y 100% y de 92% a 100%, respectivamente; pero estos parámetros pueden cambiar bajo ciertas circunstancias como en el caso de enfermos con sangrado del sistema gástrico superior, si el contenido gástrico es contaminado con sangre o cuando hayan recibido medicamentos inhibitorios de la bomba de protones, antagonistas del receptor-H2, antibióticos, o compuestos con bismuto 9,21,22,37.
Los resultados con la PRU hecha en el Laboratorio de Microbiología de la UTP mostraron una sensibilidad de 81.7% y una especificidad de 100% de acuerdo con la definición de caso. Sin embargo, con respecto al tiempo de lectura, fue superior al estipulado en la prueba comercial de Pyloritek con lectura a 60 minutos. El hecho que no tenga una alta sensibilidad en un tiempo de lectura de 60 minutos, no la descarta como prueba útil en demostrar la infección, aquí, únicamente se tiene en cuenta el «tiempo» que dispone el gastroenterólogo en la consulta. Lo anterior, se demostró para la prueba comercial CLOtest (Delta West Ltd., Bentley, Australia) fabricada por Marshall, que fue la primera prueba comercial disponible para detectar H. pylori en biopsia, el tiempo de lectura se realiza hasta las 24 horas y ha sido la más ampliamente estudiada, otras dos pruebas comercialmente disponibles son Hpfast en gel similar al CLOtest pero con distinto indicador de pH y Pyloritek en tirilla impregnada con úrea con indicador con la ventaja potencial de lectura a 60 minutos. Se han hecho estudios comparativos de la sensibilidad y especificidad de estas tres pruebas; en conjunto las sensibilidades fueron equivalentes 88% a 93% y las especificidades fueron excelentes, 99% a 100%. Cuando se realizó el comparativo a 60 minutos (punto de corte del Pyloritek), las sensibilidades del CLOtest y Hpfast fueron significativamente más bajas (66% a 71%) muy similar a los resultados obtenidos en el estudio38,39. En las tres pruebas comerciales, el Pyloritek es la de elección, si se necesita un resultado rápido (en una hora); pero si los resultados rápidos no son necesarios, las tres pruebas proveen exactitud equivalente donde se pueden incluir las pruebas «caseras» fabricadas en el laboratorio de Pereira; y si se considera lo anterior, la escogencia de la prueba se podría basar en costos, disponibilidad de la prueba, preferencia del gastroenterólogo, tiempo disponible de lectura en la consulta. Un importante criterio para tener en cuenta consiste en que el mayor tiempo de incubación llevaría a mejorar la sensibilidad de la prueba en la biopsia, pero no afecta la especificidad de detección de H. pylori38,39.
La sensibilidad y la especificidad del método histológico, también se ve afectado por los factores descritos antes para el cultivo y la PRU. Adicionalmente, la experiencia del patólogo en la observación del microorganismo es muy importante. El estudio mostró que el examen histológico con la coloración de azul de toluidina modificada 25 fue el método que informó mayor número de casos con dos biopsias (antral y del cuerpo). El EH se basa en el hallazgo microscópico de la bacteria en el corte histológico; su observación en una o ambas biopsias, indica su presencia. Con este criterio el método detectó la bacteria en 94.5% de los pacientes. En esta técnica no hubo diferencias estadísticas significativas en el ID si la biopsia era de origen antral o de cuerpo. Pero el ID en el EH sí aumentó cuando se combinaron los resultados de las dos biopsias. Lo anterior indica que el EH como técnica individual es un excelente método para descubrir la infección cuando se utilizan dos biopsias; los resultados de esta técnica la avalan como el mejor método individual para su diagnóstico. Más aún, al calcular la sensibilidad del método con base en el consolidado de las dos biopsias la sensibilidad fue 97.2%, superior a las sensibilidades individuales de antro (86.5%) y de cuerpo (90.9%).
Los rangos de sensibilidad y especificidad informados para las PCRs son altos y puede detectar entre 10 y 100 bacilos29,40, la especificidad de la PCR-ureC a partir de ADN genómico de cultivos de H. pylori mostró 100% de especificidad en un estudio previo realizado por el grupo12. La PCR en la investigación con los iniciadores específicos para el gen ureC que comunicaron Labigne et al.34 tuvo una sensibilidad de 88.7% y una especificidad de 100%, resultados que están dentro de los rangos de otros autores12,29,31,34,40. La sensibilidad de la PCR se ve afectada cuando se practica directamente en ADN extraído de biopsia. Es probable que esta sea la razón de los falsos negativos que también podrían deberse a errores en la visualización electroforética de los productos amplificados y la calidad del ADN extraído según el protocolo de Valentine33. La experiencia en Pereira indicó que durante la observación de las bandas en la electroforesis, muchas veces hubo bandas positivas inmersas en el ADN genómico humano degradado, en ocasiones difíciles de observar, y es posible que algunas bandas débiles se enmascaren con la gran cantidad de ADN genómico humano presente en la muestra, (por ejemplo véase el barrido de ADN de los carriles 3 y 6 de la Figura 1).
Al hacer el análisis de los resultados individuales de cada método según la definición de caso, es importante destacar que no hubo falsos positivos. El EH informó el mayor número de casos positivos y el menor de falsos negativos. Si se analiza el ID del EH al combinar los resultados de las dos biopsias, hay diferencias estadísticamente significativas frente a los otros métodos, y se podría considerar como una buena opción para el diagnóstico de la infección, donde no sea posible realizar cultivo o PCR. Infortunadamente, una simple técnica, no puede cumplir con todos los parámetros requeridos para tener el diagnóstico definitivo de la infección por H. pylori32. La solución es usar la combinación de resultados de dos o más técnicas que sean confiables y comparables con los resultados de técnic (as estándar. Un resultado verdadero positivo se puede definir como un caso donde el cultivo es positivo o cuando dos o más técnicas son positivas.
CONCLUSIONES Y SUGERENCIAS
La prevalencia de la infección es alta en países en vía de desarrollo si se compara con los países desarrollados, por ello no fue sorprendente encontrar una cifra alta para el grupo en estudio; además, la presencia de la bacteria se relacionaba en un porcentaje elevado con la entidad más común que sufrían los pacientes, la gastritis.
Aunque el cultivo es con frecuencia la regla de oro estándar para el diagnóstico definitivo de muchas enfermedades infecciosas, los resultados en este estudio no lo avalan como un método único de rutina en el diagnóstico de la infección, el éxito del crecimiento del microorganismo depende de múltiples factores, como experiencia del investigador, manipulación de la muestra, medios de cultivo, condiciones de incubación, etc.
Si se tiene en cuenta que la PRU es la prueba de rutina que más se sigue en las unidades de endoscopia para descubrir H. pylori, los resultados mostraron que cuando se emplea como único indicio de presencia de esta bacteria, es posible que haya falsos negativos. Lo anterior, hace sugerir que cuando se usen pruebas elaboradas en forma «casera» (hecho que es muy común en las unidades de endoscopia donde utilizan un «CLO-test» que no es el original sino elaborado por algunos laboratorios locales o nacionales) primero es necesario evaluar su sensibilidad y especificidad, y más específicamente en el tiempo de lectura.
Los resultados del método histológico en dos biopsias produjo un mayor número de casos y se podría utilizar como único sistema diagnóstico de rutina; este método es de bajo costo, de uso fácil y la coloración con azul de toluidina es una técnica rápida, barata y los reactivos son estables. El EH se convirtió en el mejor método como prueba diagnóstica individual.
La PCR tuvo un ID similar a los otros tres métodos cuando se comparan en biopsia antral. Sin embargo, si su ID se compara con el del EH cuando en éste se combinan los resultados de las dos biopsias, presenta un ID menor.
Los cuatro métodos de diagnóstico tienen desempeños bastante similares. Por tanto, en la práctica, no hay evidencia para refutar la validez de ninguno, pero sí se puede afirmar que hay una ventaja para el método histológico con respecto a los demás, y una desventaja para la prueba de ureasa. Por ello, no se descalifica ningún método, pero sí se recomienda el histológico, por un estrecho margen.
Finalmente, se puede decir que para el diagnóstico definitivo de la infección por H. pylori se debe utilizar el concepto de definición de caso lo que permite establecer la prevalencia real de la infección siendo ésta superior a la detectada por los métodos individuales. Adicionalmente, si no es posible emplear el concepto de definición de caso, se recomienda el EH en dos biopsias (antral y cuerpo).
AGRADECIMIENTOS
El grupo investigador expresa los más sinceros agradecimientos a la Universidad Tecnólogica de Pereira, por su generosa colaboración en el financiamiento y apoyo durante el desarrollo de la investigación.
REFERENCIAS
1. Dooley C, Cohen H. Helicobacter pylori infection: Background and historical considerations of H. pylori. Gastroenterol Clin North Am 1993; 22: 1-4.
2. Warren JR, Marshall BJ. Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration. Lancet 1984; 1: 1310-1314.
3. Stewart G, Worsley B. Helicobacter pylori infection: Microbiology of Helicobacter pylori. Gastroenterol Clin North Am 1993; 22: 5-19.
4. Brown K, Peura D. Helicobacter pylori infection: Diagnosis of Helicobacter pylori infection. Gastroenterol Clin North Am 1993; 22: 105-113.
5. Dunn BE. Helicobacter pylori infection: pathogenic mechanisms of Helicobacter pylori. Gastroenterol Clin North Am 1993; 22: 43-57.
6. Figura N. Helicobacter pylori factors involved in the development of gastroduodenal mucosal damage and ulceration. J Clin Gastroenterol 1997; 25: (Suppl 1): 149-163.
7. Covacci A, Telford JL, Del Giudice G Parsonnet J, Rappuoli R. Helicobacter pylori virulence and genetic geography. Science 1999; 284: 1328-1337.
8. Graham DY, Rakel R, Fendrick A, Go M, Marshall B, Peura D, Scherger J. Scope and consequences of peptic ulcer disease. How important is asymptomatic Helicobacter pylori infection? Postgrad Med 1999; 105: 100-110.
9. Suerbaum S, Michetti P. Helicobacter pylori infection. N Engl J Med 2002; 347: 1175-1186.
10. Goodman KJ, Correa P, Tengana A, Ramírez H, Delan J, Guerrero PO, et al. Helicobacter pylori infection in the Colombian Andes: a population-based study of transmission pathways. Am J Epidemiol 1996; 144: 290-299.
12. Moncayo JI, Santacruz JJ, Montes ML, Franco B, López M, Meissel E, et al. Utilización de la reacción en cadena de la polimerasa (PCR) para el diagnóstico de la infección por H. pylori en pacientes con enfermedad úlcero-péptica. Rev Med Ris 2002; 8: 4-10.
13. Vakil N, Vaira D. Non-invasive tests for the diagnosis of H. pylori infection. Rev Gastroenterol Disord 2004; 4: 1-6.
14. Coudron P, Stratton C. Factors affecting growth and susceptibility testing of H. pylori in liquid media. J Clin Microbiol 1995; 33: 1028-1030.
15. Scherer C, Müller K-D, Rath P-M, Ansorg R. Influence of culture conditions on the fatty acid profiles of laboratory-adapted and freshly isolated strains of Helicobacter pylori. J Clin Microbiol 2003; 41: 1114-1117.
16. Yousfi M, Reddy R, Osato M, Graham D. Is antrum or corpus the best site for culture of Helicobacter pylori? Helicobacter 1996; 1: 88-91.
17. Roosendaal R, Kuipers EJ, Pena AS, Graaff J. Recovery of Helicobacter pylori from gastric biopsy specimens is not dependent on the transport medium used. J Clin Microbiol 1995; 33: 2798-2800.
18. Albertson N, Wenngren I, Sjostrom JE. Growth and survival of Helicobacter pylori in defined medium and susceptibility to Brij 78. J Clin Microbiol 1998; 6: 1232-1235.
19. Fresnadillo MJ, Rodríguez M, Blasquez A, García E, García J, Trujillano I, et al. Comparative evaluation of selective and nonselective media for primary isolation of Helicobacter pylori from gastric biopsies. Helicobacter 1997; 2: 36-39.
20. Mobley H, Island M, Hausinger R. Molecular biology of microbial ureases. Microbiol Rev 1995; 59: 451-480.
21. Lai KC, Hui WM, Lam SK. Bleeding ulcers have high false negative rates for antral H. pylori when tested with urease test. Gastroenterology 1996; 110: A167.
22. Howen C, Hunt R. Practice guidelines: Guidelines for the management of Helicobacter pylori infection. Am J Gastroenterol 1998; 93: 2330-2338.
23. Correa P. Chronic gastritis: Clinico-pathological classification. Am J Gastroenterol 1988; 83: 504-509.
24. Dixon M, Genta R, Yardley J, Correa P. Classification and grading of gastritis. The updated Sydney system. International workshop on the histopathology of gastritis, Houston 1994. Am J Surg Pathol 1996; 20: 1161-1181.
25. Vartanian R, Leung J, Davis J, Young M, Kim B, Owen D. A novel alcian yellow-toluidine blue (Leung) stain for Helicobacter species: comparison with standard stains, a cost-effectiveness analysis and supplemental utilities. Mod Pathol 1998; 11: 72-77.
26. Van Zwet A, Thijs A, Frierson H, Powel S. Sensitivity of culture compared with that of polymerase chain reaction for detection of Helicobacter pylori from antral biopsy samples. J Clin Microbiol 1993; 31: 1918-1920.
27. Wesblom T, Phadnis S, Yang P, Czinn S. Diagnosis of Helicobacter pylori infection by means of a polymerase chain reaction assay for gastric juice aspirates. Clin Infect Dis 1993; 16: 367-371.
28. Furuta T, Kaneko E, Suzuki M, Arai H, Futami H. Quantitative study of Helicobacter pylori in gastric mucus by competitive PCR using synthetic DNA fragments. J Clin Microbiol 1996; 34: 2421-2425.
29. Van Zwet A, Thijs A, Frierson H, Powel S. Use of PCR with feces for detection of Helicobacter pylori infections in patients. J Clin Microbiol 1994; 32: 1346-1348.
30. Gramley W, Asghar A, Frierson H, Powel S. Detection of Helicobacter pylori DNA in fecal samples from infected individuals. J Clin Microbiol 1999; 37: 2236-2240.
31. Lage A, Godfroid E, Fauconnier A, Burette A, Butzler J-P, Bollen A, et al. Diagnosis of Helicobacter pylori infection by PCR: Comparison with other invasive techniques and detection of cagA gene in gastric biopsy specimens. J Clin Microbiol 1995; 33: 2752-2756.
32. Mégraud F. Advantages and disadvantages of current diagnosis tests for detection of Helicobacter pylori. Scand J Gastroenterol 1996; 31 (Suppl): 57-62.
33. Valentine JL. PCR detection of Helicobacter pylori. En: Persing DH, Smith TF, Tenover FC, White TS. Diagnostic molecular microbiology-principles and applications. Washington DC: American Society for Microbiology; 1993. p. 282-287.
34. Labigne A, Cussac V, Courcoux P. Shuttle cloning and nucleotide sequences of Helicobacter pylori genes responsibles for urease activity. J Bacteriol 1991; 173: 1920-1931.
35. Blaser MJ, Atherton JC. Helicobacter pylori persistence: biology and disease. J Clin Invest 2004; 113: 321-333.
36. Van Doorn L, Henskens Y, Nouhan N, Verschuuren A, Vreede R, Herbink P, et al. The efficacy of laboratory diagnosis of Helicobacter
pylori infections in gastric biopsy specimens is related to bacterial density
and vacA, cagA and iceA genotypes.
J Clin Microbiol 2000; 38: 13-17.
37. Graham DY, Rakel R, Fendrick A, Go M, Marshall B, Peura D, et al. Recognizing peptic ulcer disease: Keys to clinical and laboratory diagnosis. Symposium. Diagnosis of peptic ulcer disease. Postgrad Med 1999; 105: 113-133.
38. Dunn BE, Cohen H, Blaser M. Helicobacter pylori. Clin Microbiol Rev 1997; 10: 720-741.
39. Laine LD, Maritoku W, Estrada R, Cohen H. Prospective comparison of commercially available rapid urease tests for the diagnosis of Helicobacter pylori. Gastrointest Endosc 1996; 44: 523-526.
40. Clayton C, Kleanthous H, Coates P, Morgan D, Tabaqchali S. Sensitive detection of Helicobacter pylori by using polymerase chain reaction. J Clin Microbiol 1992; 30: 192-200.