Estudio de la actividad antisecretora de ácido gástrico del Cannabis sativa en un modelo animal1
Germán Gabriel Castillo2, Harry Mauricio Pachajoa2, Sandra Eliana Villota2, Edwin Zurita2, Mauricio Palacios, M.D., M.Sc.3, Oscar Gutiérrez, M.D., M.Sc.4
1. Primer puesto en el XIX Congreso Científico Internacional de la Federación Latinoamericana de Sociedades Científicas de Medicina (FELSOCEM). Octubre 2004, Antofagasta, Chile.
2. Médico Interno, Escuela de Medicina, Facultad de Salud, Universidad del Valle, Cali, Colombia.
3. Profesor Asistente, Departamento de Farmacología, Escuela de Ciencias Básicas, Facultad de Salud, Universidad del Valle, Cali, Colombia. e-mail: maopalacios@uniweb.net.co
4. Profesor Asistente, Jefe Sección de Farmacología, Escuela de Ciencias Básicas, Facultad de Salud, Universidad del Valle, Cali, Colombia. e-mail: ogutie@telesat.com.co
Recibido para publicación octubre 6, 2005 Aceptado para publicación septiembre 8, 2006
RESUMEN
Introducción: Hay pocos estudios que describan el efecto de los cannabinoides en el sistema gástrico, pues en sólo uno se encontró referencia a alteraciones del pH gástrico.
Objetivo: Determinar el efecto antisecretor de la especie Cannabis sativa.
Metodología: Se utilizaron 45 ratas Sprague Dawley que se sometieron a un ayuno de 24 horas, al cabo del cual se les ligó el píloro durante 2 ó 4 horas según el grupo experimental. Luego, se anestesiaron, se extirparon los estómagos y se analizó el contenido gástrico en términos de volumen y pH.
Resultados: Se encontró que el extracto de Cannabis aumentó el pH gástrico con respecto al grupo control (p <0.05), sin hallar diferencias significativas entre el fármaco de referencia (ranitidina) y el extracto de Cannabis (p >0.05). El volumen medido no mostró diferencias entre los grupos.
Conclusiones: Estos resultados, sugieren que el extracto de Cannabis sativa disminuye la secreción de ácido en el estómago.
Palabras clave: Cannabis; Jugo gástrico; Cannabinoides; Tetrahidrocanabinol.
Study of the gastric acid anti-secretory activity of Cannabis sativa in an animal model
SUMMARY
Introduction: There are few studies that describe the effects of cannabinoids in the gastric system, although in only one, there was the description of a gastric pH alteration.
Objective: To determine the anti-secretory effect of the species Cannabis sativa.
Methodology: In this study forty five Sprague Dawley rats were used, they were submitted to a 24 hours fasting period, after which the pylorus was ligated for 2-4 hours, according to the experimental group. Thereafter, the rats were anesthetized, their stomachs extirpated and the gastric content analyzed for volume and pH.
Results: The Cannabis extract raised the gastric pH when compared to the control group (p <0.05), with no significant differences found between the reference drug (ranitidine) and the Cannabis extract (p >0.05). There were no differences in the measured volumes.
Conclusions: These results suggest that the Cannabis sativa extract diminishes the gastric acid output.
Keywords: Cannabis; Gastric juice; Cannabinoids; Tetrahydrocannabinol.
La especie Cannabis sativa, más conocida como marihuana, es una de las plantas que más controversia genera por sus propiedades farmacológicas, toxicológicas y alucinógenas. Desde la antigüedad, se ha utilizado con fines industriales, culturales, medicinales o psicoactivos y durante el siglo XX se estudió intensamente por sus propiedades como alucinógeno, y sus efectos negativos en la salud humana1,2; sus propiedades curativas se reflejan en varios tratados médicos de épocas remotas; sin embargo, la investigación sobre sus principios activos y su aplicación terapéutica es más o menos reciente. Es de las sustancias más conocidas en la comunidad por su uso como fármaco alucinógeno y por sus efectos perjudiciales tanto agudos como crónicos. Entre los efectos agudos están las alteraciones de la conciencia y la respuesta psicomotora, lo que aumenta el riesgo de accidentes de tráfico3,4. Entre los crónicos, afecta selectivamente el aprendizaje y la memoria tanto en adultos como en hijos de madres consumidoras, causa lesiones en el sistema respiratorio y altera la respuesta de algunas células inmunitarias3,6.
Aunque la planta de Cannabis contiene por lo menos 60 cannabinoides distintos entre los más de 400 compuestos químicos identificados7, el principal componente psicoactivo es el D9-tetrahidrocanabinol (D9-THC) y, en menor cantidad y menos potente, el D8-tetrahidrocanabinol (D8-THC). Los metabolitos del THC tienen un elevado período de eliminación debido a la alta liposolubilidad de estos compuestos y a su elevado volumen de distribución8.
Los posibles usos terapéuticos incluyen analgesia, disminución de la presión intraocular, efecto antiemético en vómitos inducidos por quimioterapia antineoplásica, propiedades relajantes musculares en esclerosis múltiple, traumatismos medulares y alteraciones del movimiento. Además, algunos informes recientes indican otros posibles usos de estas sustancias como neuroprotectores (en modelos animales de enfermedades neurodegenerativas e isquemia cerebral), antiasmáticos y anticonvulsivos9-15.
En estudios con agonistas sintéticos de receptores CB se encontraron efectos antineoplásicos tanto in vivo como in vitro16. En el aparato gastrointestinal se vio que los cannabinoides disminuyen la evacuación gástrica, el peristaltismo intestinal, se conoce su compromiso en la fisiopatología del íleo paralítico en un modelo en ratas17-20 y existen informes de un posible efecto sobre la acidez gástrica en pacientes consumidores21; sin embargo, su acción en la secreción de ácido gástrico no se ha estudiado.
Con el presente estudio se evaluó el efecto del extracto de Cannabis sativa, administrado por vía oral, en la secreción gástrica (volumen y acidez) en ratas.
MATERIALES Y MÉTODOS
Preparación del extracto. Una muestra de 30 g de Cannabis sativa se disolvió en 450 ml de etanol (95%) para la extracción por el método soxhlet enriqueciendo así el extracto con los principios aislados. Después, se concentró el extracto en un rotoevaporador y se obtuvo una concentración final de 1.3 g/ml. La solución resultante se refrigeró a -10º C en la oscuridad mientras no se utilizaba.
Animales de experimentación. Se emplearon 45 ratas de la especie Rattus novergicus, cepa Sprague-Dawley, machos y hembras de 6 semanas de edad, con un peso entre 200 y 300 g, donadas por el bioterio de la Sección de Farmacología, que se sometieron a condiciones similares de temperatura (entre 24° y 25ºC); ciclos de luz-oscuridad de 12 horas. Se alimentaron con agua y Ladrina® de Purina® a libre demanda.
Fármaco de referencia. Ranitidina (Ranitidina Gen-Far® lote 0701) ampollas de 50 mg/2 ml para uso IV o IM. La elección de un bloqueador de los receptores H2, en lugar de un inhibidor de bomba de protones, se debe a que el efecto del primero es inmediato, mientras que el omeprazol no consigue un efecto máximo (meseta farmacodinámica) antes de 72 horas, debido a la asincronía en el funcionamiento de estas bombas en cada célula y entre las poblaciones celulares de diferentes regiones del estómago22,23.
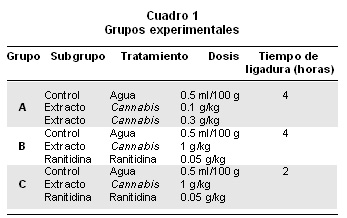
Procedimiento. Las 45 ratas se pidieron en 3 grupos A, B y C, cada uno con 15 animales. En cada grupo se separaron subgrupos de 5 ratas como se observa en el Cuadro 1.
Diseño experimental. Previo ayuno de 24 horas, se anestesiaron los animales con una dosis de 0.1 ml/kg de peso de una mezcla de ketamina y xilazina (a razón de 80/20, respectivamente) vía intraperitoneal; se fijaron en decúbito dorsal a una placa de corte y se hizo una incisión longitudinal de 2 cm de longitud en la región epigástrica. Se localizó el estómago y se buscó el esfínter pilórico, que se distingue por el cambio de coloración entre la mucosa gástrica y la mucosa duodenal. Luego se ligó el píloro con seda 4-0 y se inyectó por vía intraduodenal, extracto de Cannabis sativa, ranitidina o agua según el grupo experimental. Se suturaron los animales y se dejaron con el píloro ligado por 2 ó 4 horas según el grupo de experimentación; al final del período se sacrificaron con sobredosis de pentobarbital IP para después extirpar los estómagos, y pinzar el esófago a fin de evitar la pérdida de la muestra. Sobre una placa de hielo, los estómagos se lavaron con agua destilada y se secaron con papel filtro Nº20 Shcleircher & Schull®. Luego se seccionó el estómago a lo largo de la curvatura menor, se lavó la mucosa con 2 ml de agua destilada y se recogió el jugo gástrico en tubos de ensayo que se sometieron a centrifugación a 1500 rpm durante 30 minutos. Acto seguido, se retiraron 200 µl de sobrenadante que se refrigeró a -10ºC para una futura determinación de la actividad péptica. El resto de jugo gástrico se utilizó para determinar el volumen y la acidez por medio de pHmetro digital (Orión®, modelo 420A).
Los datos de volumen y pH obtenidos en cada caso se analizaron mediante análisis de varianza (ANOVA) de una vía, y posteriormente se aplicó la prueba de comparación múltiple de Newman-Keuls entre todos los grupos. Se tomó a priori una p<0.05 como indicador de significancia estadística. La tabulación de los datos, el análisis estadístico y las gráficas se elaboraron con el programa GraphPad Prism® versión 3.02 de 2000 para Windows 98®.
El Comité de Evaluación de Ética en Animales de Experimentación de la Facultad de Salud de la Universidad del Valle aprobó la metodología de este trabajo según el Acta Nº 18, julio 16 de 2002, de acuerdo con los requerimientos de la Ley 84 de 1989 (Resolución 008430 de 1993) del Ministerio de Salud de Colombia.
RESULTADOS
En el grupo experimental de 4 horas (Gráfica 1), al cual se le administró Cannabis a dosis de 0.1 g/kg y 0.3 g/kg se observó una elevación del pH gástrico comparado con el grupo control (p<0.001). Con la dosis de 1 g/kg (Gráficas 2 y 3) se evidenció un aumento significativo del pH con respecto al grupo control (p<0.05). El efecto sobre el pH se mantuvo a través del tiempo (4 horas) de manera similar a la ranitidina (Gráficas 2 y 3). La determinación del volumen de contenido gástrico no mostró diferencias significativas entre los grupos experimentales (p>0.05).
DISCUSIÓN
Los resultados obtenidos evidencian que la Cannabis sativa genera un efecto sobre alguno de los mecanismos comprometidos en la secreción de ácido gástrico, y favorece así un medio menos ácido que podría ser de gran utilidad en la práctica clínica para contrarrestar aquellas entidades en las cuales la alta secreción de ácido genera serias lesiones en la mucosa gástrica.
Debido a que en este experimento se utilizó un extracto etanólico crudo de Cannabis sativa, se debe dejar claro que éste lleva muchos metabolitos diferentes y no se puede señalar con exactitud si los efectos encontrados son debido a cuál(es) metabolitos. La literatura científica señala al 9 delta-THC como el responsable de los principales efectos del Cannabis sativa, pero la planta posee aproximadamente otros 60 compuestos clasificados como cannabinoides, que son capaces de interactuar con el receptor y producir determinados efectos; por tanto es conveniente expresar que el extracto con todos sus metabolitos tuvo un efecto sobre la secreción gástrica y no uno de ellos en particular.
En este estudio sólo se utilizó como vía de administración la intraduodenal, pero se amerita que se estudien otras vías, para determinar si los resultados varían o se conservan iguales, porque como se expresa en la literatura, la farmacocinética del Cannabis sufre cambios notorios entre la vía respiratoria y la enteral: la absorción en la primera es alrededor de 60% del THC inhalado, mientras que en la segunda es 20%.
El presente estudio demuestra un efecto que podría complementar la discusión sobre el controvertido uso de cannabinoides en enfermos que reciben quimioterapia y/o radioterapia porque ofrece un argumento más, asociado con los otros efectos por los cuales se justificaría la indicación: disminución de las náuseas, aumento del apetito y del peristaltismo intestinal, que contrarrestan los efectos de intolerancia gastrointestinal en este grupo de pacientes.
CONCLUSIONES
La administración del extracto de Cannabis sativa produce una elevación en el pH gástrico similar a la obtenida con ranitidina sin producir variaciones en el volumen de secreción gástrica.
Se hace necesario emprender estudios complementarios para determinar si este efecto se debe a la presencia de receptores cannabinoides en el estómago o a otro mecanismo de acción.
REFERENCIAS
1. Howlett AC, Breivogel CS, Childers SR, Deadwyler SA, Hampson RE, Porrino LJ. Cannabinoid physiology and pharmacology: 30 years of progress. Neuropharmacology 2004; 47 (Suppl 1): 345-358.
2. Grotenhermen F. Pharmacokinetics and pharmacodynamics of cannabinoids. Clin Pharmacokinet 2003; 42: 327-360.
3. Ashton CH. Pharmacology and effects of Cannabis: a brief review. Br J Psychiatry 2001; 178: 101-106.
4. Carlini EA. The good and the bad effects of (-) trans-delta-9-tetrahydrocannabinol (Delta9-THC) on humans. Toxicon 2004; 44: 461-467.
5. Do Y, McKallip RJ, Nagarkatti M, Nagarkatti PS. Activation through cannabinoid receptors 1 and 2 on dendritic cells triggers NF-kappaB-dependent apoptosis: novel role for endogenous and exogenous cannabinoids in immunoregulation. J Immunol 2004; 173: 2373-2382.
6. Hall W, Christie M, Currow D. Cannabinoids and cancer: causation, remediation, and palliation. Lancet Oncol 2005; 6: 35-42.
7. Dewey WL. Cannabinoid pharmacology. Pharmacol Rev 1986; 38: 151-178.
8. Kraft B, Kress HG. Cannabinoids and the immune system. Of men, mice and cells. Schmerz 2004; 18: 203-210.
9. Calignano A, La Rana G, Giuffrida A, Piomelli D. Control of pain initiation by endogenous cannabinoids. Nature 1998; 394: 277-281.
10. Klein TW, Lane B, Newton CA, Friedman H. The cannabinoid system and cytokine network. Proc Soc Exp Biol Med 2000; 225: 1-8.
11. Izzo AA, Mascolo N, Pinto L, Capasso R, Capasso F. The role of cannabinoid receptors in intestinal motility, defaecation and diarrhoea in rats. Eur J Pharmacol 1999; 384: 37-42.
12. Herkenham M. Cannabinoid receptor localization in brain: Relationship to motor and reward systems. Ann NY Acad Sci 1992; 654: 19-32.
13. Noyes R Jr, Brunk, SF, Avery DA, Canter AC. The analgesic properties of delta-9-tetrahydrocannabinol and codeine. Clin Pharmacol 1975; 18: 84-89.
14. Agurell S, Halldin M, Lindgren JE, Ohlsson A, Widman M, Gillespie H, et al. Phamacokinetics and metabolism of tetrahydrocannabinol and other cannabionoids with emphasis on man. Pharmacol Rev 1986; 38: 21-43.
15. Christie MJ, Vaughan CW. Neurobiology cannabinoids act backwards. Nature 2001; 410: 527-530.
16. Galve-Roperh I, Sánchez C, Cortés ML, del Pulgar TG, Izquierdo M, Guzmán M. Anti-tumoral action of cannabinoids: involvement of sustained ceramide accumulation and extracellular signal-regulated kinase activation. Nat Med 2000; 6: 313-319.
17. Pertwee RG. Cannabinoids and the gastrointestinal tract. Gut J 2001; 48: 859-867.
18. Izzo AA. Cannabinoids and intestinal motility: Welcome to CB2 receptors. Br J Pharmacol 2004; 142: 1201-1202.
19. Mathison R, Ho W, Pittman QJ, Davison JS, Sharkey KA. Effects of cannabinoid receptor-2 activation on accelerated gastrointestinal transit in lipopolysaccharide-treated rats. Br J Pharmacol 2004; 142: 1247-1254.
20. Di Carlo G, Izzo AA. Cannabinoids for gastrointestinal diseases: potential therapeutic applications. Expert Opin Investig Drugs 2003; 12: 39-49.
21. Nalin DR, Levine MM, Rhead J, Bergquist E, Rennels M, Hughes T, et al. Cannabis, hypochlorhydria, and cholera. Lancet 1978; 2: 859-862.
22. Dekel R, Morse C, Fass R. The role of proton pump inhibitors in gastro-esophageal reflux disease. Drugs 2004; 64: 277-295.
23. Huang JQ, Hunt RH. Pharmacological and pharmacodynamic essentials of H(2)-receptor antagonists and proton pump inhibitors for the practising physician. Best Pract Res Clin Gastroenterol 2001; 15: 355-370.