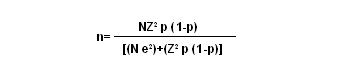
Seguridad hepática y hemática de la amodiaquina en el tratamiento de la malaria no complicada por Plasmodium falciparum1
Juan Gabriel Piñeros, M.D.2 Mary Luz López, Bact., M.Sc.2 Jaime Carmona-Fonseca, M.D., M.Sc.3 Silvia Blair, M.D., M.Sc.3
1. Trabajo financiado por la Dirección Seccional de Salud de Antioquia y la Universidad de Antioquia, Medellín, Colombia.
2. Investigador, Grupo Malaria, Universidad de Antioquia, Medellín, Colombia.
3. Profesor Titular, Facultad de Medicina, Grupo Malaria, Universidad de Antioquia, Medellín, Colombia. e-mail: jaimecarmonaf@hotmail.com sblair@quimbaya.udea.edu.co
Recibido para publicación febrero 7, 2006 Aceptado para publicación septiembre 8, 2006
RESUMEN
Introducción: Actualmente existe un número limitado de antimaláricos eficaces, entre ellos amodiaquina; sin embargo, su uso se ha restringido por informes previos de toxicidad hepática y hemática a dosis superiores a 1,500 mg administradas como profiláctico para malaria. No obstante, en dosis terapéuticas antimaláricas los efectos adversos son de intensidad leve o moderada, e incluyen náuseas, vómito y prurito.
Objetivo: Evaluar la toxicidad hepática y hemática de la amodiaquina en dosis y tiempo establecidos para tratar la malaria por Plasmodium falciparum no complicada.
Metodología: Diseño longitudinal con determinación no ciega del efecto. Se captaron 57 pacientes, seguidos por 10 días (evaluación clínico-parasitológica).
Resultados: Antes del tratamiento, las variables hemáticas y hepáticas mostraron alteración leve y se normalizaron postratamiento, que fue 100% eficaz. Los días 5 y 10 del tratamiento todas las variables estaban normales, lo que sugiere ausencia de efectos tóxicos imputables al medicamento. Los efectos adversos fueron pocos, leves y desaparecieron completamente el día 10.
Conclusiones: Usada en la dosis (25 mg/kg peso) y el tiempo (3 días) definidos para el tratamiento de la malaria por P. falciparum sin complicaciones, la amodiaquina no mostró efectos adversos ni toxicidad hepática ni hemática.
Palabras claves: Amodiaquina; Hepatotoxicidad; Hematotoxicidad; Malaria; Plasmodium falciparum.
Liver and haematological safety of amodiaquine treatment in non-complicated falciparum malaria
SUMMARY
Background: At present there are few effective antimalarial drugs, amodiaquine is one of them; however, its use has been restricted by previous information about hematic and hepatic toxicity when it is administered as prophylactic at doses greater than 1,500 mg. But at therapeutic doses, the side effects are either slight or of moderate intensity and include nausea, vomit and pruritus.
Objective: To evaluate the hepatic and hematic toxicity of amodiaquine administered at doses and time recommended for treatment of uncomplicated Plasmodium falciparum malaria.
Methods: Longitudinal design with no blind determination of the effect. A total of 57 patients were included and followed up for 10 days (clinical-parasitological evaluation).
Results: Hematic and hepatic variables showed slight alteration previous treatment and were normal postreatment. Therapeutic efficacy of amodiaquine was 100%. All variables were normal at days 5 and 10, suggesting absence of toxic effects imputable to amodiaquine. The side effects were few, slight and disappeared completely at day 10.
Conclusions: Amodiaquine administered at doses (25 mg/kg weight) and time (3 days) established for treatment of uncomplicated Plasmodium falciparum malaria is safe, it did not show neither hematic nor hepatic toxicity.
Keywords: Amodiaquine; Hepatotoxicity; Hematotoxicity; Malaria; Plasmodium falciparum.
En el mundo, la malaria es una enfermedad de gran importancia por su elevada frecuencia y gravedad y por problemas como falla terapéutica y resistencia parasitaria de Plasmodium falciparum a los medicamentos.
Para el tratamiento del paludismo falciparum no complicado hay varias alternativas y en Colombia, desde 1998, se usa amodiaquina (AQ) más sulfadoxina-pirimetamina (S-P)1. Hay informes sobre las toxicidades hepática y hemática de la AQ cuando se emplea en profilaxis, que implica tomarla durante semanas o meses, en dosis totales altas2-9, pero son casi inexistentes las noticias sobre la toxicidad de la AQ derivada de su empleo para el tratamiento malárico. La alteración hepática es clínica e histológicamente indistinguible de la causada por hepatitis viral4,5. El riesgo de hepatotoxicidad es 1 caso en 15,500 (=0.00006452)8; las frecuencias de neutropenia (recuento entre 500 y 1,500 neutrófilos/µl) y agranulocitosis (recuento inferior a 500 células/µl) se han estimado en 1 entre 2,100 (=0.0004762)3,8, que aumentan la morbimortalidad3,5. Las dosis profilácticas totales variaron entre 1.2 g y 11.4 g y se dieron durante 1 a 60 semanas, según los informes. Estos efectos adversos llevaron a la Organización Mundial de la Salud (OMS) a contraindicar el uso profiláctico antimalárico de la AQ7,8.
Por otra parte, hay varias hipótesis para explicar la toxicidad causada por AQ. En el hígado, se relaciona con la formación de quinona-imina (quinonimina), un metabolito que reacciona irreversiblemente con proteínas microsomales hepáticas10; también se habla de aumento en la peroxidación lipídica de células hepáticas11. Para explicar la agranulocitosis se propone la expresión, en la superficie de neutrófilos, de antígenos relacionados con la droga, que son reconocidos por anticuerpos IgG específicos contra AQ, que afectan las células maduras, lo que sugiere una reacción de hipersensibilidad tipo II; también se postula una alteración en la mielopoyesis con disminución de precursores mieloides12.
El deterioro de la función hepática se demuestra con el aumento por encima de lo normal de la alaninoaminotransferasa (ALT), la bilirrubina total (BT) y la gamaglutamil transferasa (GGT)4,5. Los tiempos de trombina (TP) y protrombina (TPT) son también indicadores de falla hepática. Para atribuir a la AQ la hepatotoxicidad hay que descartar la presencia de hepatitis A y B, leptospirosis y fiebre entérica, entre otras causas. La toxicidad sanguínea se evalúa mediante hemoleucograma, donde se encuentran neutropenia y agranulocitosis.
Los anteriores y estos otros hechos, enunciados sin ningún orden específico o jerárquico, motivaron esta investigación:
Este informe da cuenta de un estudio cuyo objetivo fue evaluar la hepatotoxicidad y la hematotoxicidad de la AQ cuando se da en dosis y tiempo terapéuticos antimaláricos (dosis total: 25 mg/kg, que se divide en tres días) a pacientes con malaria no complicada por P. falciparum.
MATERIALES Y MÉTODOS
Tipo de estudio: Diseño descriptivo, prospectivo y longitudinal. Se evaluaron durante 10 días la clase y la frecuencia de efectos adversos surgidos durante el tratamiento con AQ.
Definición del efecto y del factor de riesgo: El factor de riesgo es el tratamiento con AQ y el efecto correspondió a la aparición de cambios hepáticos, hemáticos o de otra índole, leídos mediante variables clínicas y de laboratorio como valores por fuera de los límites normales fisiológicos. Se definió un efecto adverso (EA) como la aparición durante el seguimiento de cualquier síntoma o signo, no referido con anterioridad por el paciente o por el médico, o el empeoramiento de los descritos antes.
Tamaño de la muestra: El tamaño de la muestra se calculó mediante la fórmula:
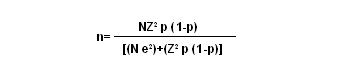
donde:
n: tamaño de la muestra;
N: población de enfermos con malaria falciparum en Turbo, en el año 2001; son 3,031 personas, de acuerdo con los datos de la Dirección Seccional de Salud de Antioquia;
Z: unidades estandarizadas para un determinado intervalo de confianza, que en este caso fue 95%, es decir, 1.96 unidades Z;
e: error de muestreo, definido en 0.02%;
p: probabilidad del efecto por observar, es decir la hepatotoxicidad y la hematotoxicidad. Se tomó la probabilidad del efecto más escaso (hepatotoxicidad=0.00006452);
1-p: es el complemento de p.
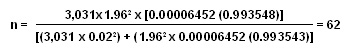
El tamaño de la muestra fue de 62 pacientes, valor mayor en 20 al obtenido con el protocolo 1998 de la OMS para definir el tamaño del grupo en la evaluación de la eficacia y los EA de un tratamiento antimalárico.
Población de referencia: Pacientes con malaria por P. falciparum, no complicada, que consultan al puesto de diagnóstico de malaria del Hospital Local de Turbo, de cualquier sexo, con edad superior a los 10 años, residentes en zona urbana (cabecera municipal) o rural (periferia).
Criterios de inclusión: Malaria sólo por P. falciparum, sin complicaciones; parasitemia menor de 50,000 anillos/µl el día de ingreso; edad superior a 10 años, residencia en el área de estudio (cabecera municipal o periferia) y posibilidad de asistir al seguimiento durante 10 días; firmar el consentimiento informado; no tener embarazo ni amenorrea mayor a 40 días; ni tener enfermedades crónicas o graves, en particular no tener infección concomitante como hepatitis A o B, leptospirosis o fiebre entérica (estos cuatro diagnósticos fueron hechos después del ingreso al estudio y si resultaron «positivos» el paciente se excluyó); no informar consumo de licor con frecuencia semanal mayor de 200 ml ni ingesta diaria superior a 4 g de acetaminofén; no haber recibido tratamiento antimalárico en las últimas 72 horas; no presentar antecedente de hipersensibilidad a los antimaláricos; ausencia de signos de peligro o de malaria grave; según criterios de OMS no presentar falla terapéutica al tratamiento durante los 10 días de seguimiento.
Criterios de exclusión: Complicación del cuadro malárico según definición de OMS, enfermedad concomitante, accidente o efecto adverso real o potencialmente asociado con el tratamiento. Además, incumplir con el tratamiento antimalárico o consumir otros antimaláricos o antibióticos.
Aspectos éticos: A los pacientes se les informó del estudio, sus objetivos y procedimientos; quienes cumplieron con los criterios de ingreso y aceptaron su participación o la de su hijo firmaron un consentimiento informado con el respaldo del comité de ética del Centro de Investigaciones Médicas de la Facultad de Medicina de la Universidad de Antioquia.
Seguimientos:
Clínico y de laboratorio: A cada paciente se le siguió por diez días. El día 0 (pretratamiento) un médico realizó un examen físico completo para descartar la presencia de signos de peligro de malaria complicada según los define y los usa la OMS, enfermedad hepática o infección concomitante activa. Se tomaron 12 ml de sangre para exámenes de laboratorio, que se procesaron de inmediato, excepto GGT, hepatitis A y B, Leptospira y parafebriles, que se almacenaron a 4ºC durante un máximo de 5 días en el caso de la GGT y de 1.5 meses las otras. Los días 1, 2, 3, 5 y 10 hubo evaluación médica, los días 5 y 10 se sangraron para hemoleucograma y pruebas de función hepática postratamiento.
Parasitológico: Los días 0 (pretratamiento), 1, 2, 3, 5 y 10 se hizo evaluación parasitológica (gota gruesa con coloración de Field). El diagnóstico se hizo en 200 campos microscópicos y aumento de 1,000 veces (microscopio de luz en 100x); la parasitemia se calculó con base en 200 leucocitos, se usó un estándar de 8,000 leucocitos/µl y se expresó en parásitos/µl. La gota gruesa se diagnosticó como negativa cuando no se observó ningún parásito en 200 campos microscópicos.
Técnicas de laboratorio: Las mediciones se hicieron en tres laboratorios ajenos a los investigadores, quienes suministraron los respectivos valores de referencia (normales).
a) Hemoleucograma: equipo automatizado (Cell pack auto net 8118K);
b) Pruebas de función hepática: con fotocolorímetro RA-50 se hicieron TP (Sera-pack), TPT (Sera-pack), BT (Organon Tecnika) y BD (Organon Tecnika); por fotocolorimetría cinética se hicieron ALT (Biosystems; fotocolorímetro RA-50) y GGT (Human). Mediante seroaglutinación (Cenogenics; prueba de Widal) se evaluaron los antígenos H y O de Salmonella typhi, antígeno H de S. paratyphi y antígeno A de S. paratyphi B y antígeno O de Proteus OX-19. Los títulos hasta 1:80 se consideraron negativos para fiebre entérica, cuyo diagnóstico se establece con títulos de 1:160 ó más13. Con la técnica de ELISA se analizaron IgM para hepatitis A (IgM-HA) (Alfa HAV IgM-EIA), antígeno de superficie de hepatitis B (AgS-HB) (Alfa AgS HB-EIA). Se usó la prueba de IFI para IgM anti-Leptospira (Biomerieux), prueba para género, en la que un título mayor de 1:40 se considera positivo para ese agente.
Tratamiento: Las tabletas de AQ tenían 150 mg base (lote 00L22/0439E) y las suministró la Dirección Seccional de Salud de Antioquia (DSSA). Los investigadores las dieron a cada paciente, junto con 150-200 ml de agua: 10 mg/kg de peso, seguidos de 7.5 mg/kg a las 24 y 48 horas. Al mismo tiempo, a cada paciente se le vigiló durante 30 minutos y, en caso de presentar vómito se repitió la dosis una vez. La reaparición del vómito fue motivo de exclusión y remisión al hospital de la localidad.
El último día de seguimiento clínico y parasitológico (día 10) se administró a todos los pacientes una dosis única de primaquina, como gametocitocida: 0.75 mg/kg de peso a los niños y 45 mg dosis total en adultos.
Análisis estadístico: Para el análisis de los datos se usaron los programas Epi-Info 6.04 y SPSS 7.1. Siempre se consideró una probabilidad estadísticamente significativa cuando su valor fue menor de 5% (p<0.05). El análisis consistió en:
Comparar los valores de una variable en los días 0 y 5, o en los días 5 y 10 (prueba de Wilcoxon para muestras dependientes).
RESULTADOS
Se captaron 57 pacientes con malaria por P. falciparum no complicada con una parasitemia baja (6,871±8,205 anillos/µl), que incluyen varios con prueba de Widal con títulos entre 1:20 y 1:80, valores que son negativos para fiebre entérica13. En general, es población residente en zona rural (81%), mestiza (74%), masculina (61%), adulta joven (34±20 años como promedio y desviación estándar) y con 5.9±4.6 días de evolución de la enfermedad actual; 42% relató antecedentes de malaria en el año anterior.
Estados hepático y hemático antes del tratamiento
a. Análisis cualitativo: Porcentaje de paciente dentro y fuera del rango normal. En términos cualitativos (Cuadro 1), el porcentaje de pacientes con valores fuera del intervalo normal varió en forma amplia según la variable, desde ninguno con neutropenia hasta 73% con trombocitopenia. Todos los enfermos presentaron anormalidad en las variables hepáticas. Se encontraron por encima del límite superior normal los valores del TP (11%) y el TPT (37%), la bilirrubina total (51%) y directa (61%), y las enzimas GGT (16%) y ALT (26%).
Función hepática: En 67% (38/57) de los pacientes hubo aumento de alguna bilirrubina (BT, BD) y 15 de estos 38 (39%) mostraron, además, elevada una enzima (ALT, GGT); dos de los 15 pacientes (13%) presentaron además alza del TP, con parasitemia menor de 36,000 anillos/µl. En estos 15 pacientes, el promedio de leucocitos fue de 5,700 células/µl, el de neutrófilos de 4,107 células/µl, 20% mostraron leucopenia y 7% leucocitosis, se encontró neutrofilia en 7% pero en ninguno neutropenia.
Función hemática: Ninguno de los pacientes presentó normalidad en todas las variables hematológicas. En 30% de los enfermos había anemia (32% los hombres y 27% las mujeres), que no tuvo correlación lineal con la parasitemia (rho=0.10). En 4% se encontró leucopenia y otro 4% con leucocitosis, mientras 9% tenían neutrofilia (ninguno con neutropenia). Como antes se anotó, 73% mostraban trombocitopenia (<150,000 plaquetas/µl), que en 5% fue intensa (<50,000 plaquetas/µl) pero en ninguno fue menor de 20,000 plaquetas/µl. El coeficiente de correlación lineal «rho» fue menor de -0.28 para las variables plaquetas y parásitos.
b. Análisis cuantitativo: Comparación de promedios/medianas. En términos cuantitativos, antes del tratamiento las variables hepáticas y hemáticas estuvieron en general dentro del intervalo fisiológico, con excepción de las plaquetas (bajas), la BD (elevada), la BT (elevada) (Cuadro 2). La hepatomegalia (>1 cm debajo del reborde costal derecho) se encontró en 73%; no se observó ningún paciente ictérico ni con hemorragias.
Es muy importante resaltar que mientras en términos de porcentaje de pacientes con valores anormales tanto las variables hepáticas como hemáticas estuvieron en general afectadas, en términos cuantitativos el compromiso fue muy leve, pues los promedios se mantuvieron en el intervalo fisiológico.
Evolución temporal postratamiento de los valores hepáticos y hemáticos. La totalidad de los pacientes respondió de manera adecuada al tratamiento, con eliminación total de los síntomas y signos maláricos y de la parasitemia a más tardar a las 72 horas después de haber iniciado la terapia. En los 10 días de control no ocurrió ninguna falla del tratamiento.
a. Análisis cualitativo: Porcentaje de pacientes dentro y fuera del rango normal. En general, las variables hepáticas y hemáticas se encontraron normales en casi todos los pacientes en el control del día 5 (Cuadro 1). Son sobre todo notorios los cambios en la frecuencia de las bilirrubinas entre los días 0 y 5, donde de 51% de pacientes con valores elevados de BT se pasó a 5% y de 61% con BD elevada se cayó a 23%. Con esto se asociaron las reducciones en ambas enzimas: de 26% de enfermos con ALT elevada se cayó a 21% y de 16% a 9% en la GGT.
En términos cuantitativos (Cuadro 2), los cambios temporales también fueron notorios, a pesar de que, como ya se dijo, antes del tratamiento con AQ los promedios estaban dentro de los intervalos de normales, excepto los de las bilirrubinas y las plaquetas. A las 48 horas de finalizar el tratamiento con AQ la totalidad de las variables presentaron promedios situados en lo fisiológico. Las variaciones significativas entre los días 0 y 5 fueron las de BT, BD, GGT, hemoglobina, hematócrito, leucocitos y plaquetas, mientras las correspondientes a los días 5 vs. 10 fueron las de BT, GGT, hemoglobina, hematócrito y plaquetas.
b. Análisis cuantitativo: Comparación de promedios/medianas de los días 5 y 10. Entre los días 5 y 10, las variables se conservaron en la normalidad fisiológica, pero con diferencias estadísticamente significativas entre esos dos controles, así: la BT subió y la GGT bajó; las plaquetas se elevaron a valores normales; la reducción progresiva de la GGT y el aumento de plaquetas indican mejoría en los estados hepático y hemático.
La normalidad de todas las variables en los días 5 y 10 muestra la eficacia del tratamiento con AQ de la malaria falciparum, por lo menos si se juzga a corto plazo (10 días) y sugiere fuertemente la ausencia de efectos tóxicos hemáticos y hemáticos imputables al tratamiento. También debe anotarse que ningún paciente mostró ictericia durante la etapa de ingestión del medicamento ni después; las frecuencias de hepatomegalia y esplenomegalia disminuyeron, en comparación con el día cero. De igual manera, no se observaron cuadros febriles en ningún momento después del día 3.
Efectos adversos. Durante el tratamiento y hasta finalizar el control, los pacientes presentaron poca frecuencia de efectos adversos (EA), de intensidad leve y transitoria (ausentes el día 10). A las 24 horas de iniciado el tratamiento los EA fueron mareo, epigastralgia y «sabor amargo en la boca» (12%, 9% y 4%, en su orden). El día 2 se presentaron cinco EA diferentes: los tres anteriores (12%, 5%, 4%), más visión borrosa y tinitus (2% cada uno). En el día 3 se encontró mareo (4%), tinitus, rinorrea y temblor (2% cada uno). El día 5 del seguimiento se hallaron mareo (4%), epigastralgia, parestesias y disuria (2% cada una). El día 10 se encontraron disuria y constipación (2% cada una).
DISCUSIÓN
Como se debe recordar, este trabajo tuvo por objetivo evaluar la toxicidad hepática y hemática de la AQ cuando se usa para tratar la malaria falciparum no complicada y para ello se aplicó un diseño longitudinal, prospectivo, con determinación no ciega del efecto; se evaluaron 57 pacientes, seguidos por 10 días con evaluación clínico-parasitológica. El tamaño de la muestra, aunque es relativamente pequeño, se calculó según las recomendaciones del protocolo 1998 de la OMS para estudios de evaluación de la respuesta terapéutica, donde se trabaja con grupos de 42 sujetos. No obstante, es recomendable evaluar un mayor número de personas, en diversos lugares endémicos de paludismo, de diferentes sexo y edad, de tal manera que se tenga un conocimiento más amplio y sólido del problema.
Aparte de los costos económicos y de asegurar que los pacientes cumplan con las citas, una dificultad grande que se tuvo en este trabajo consistió en que los pacientes aceptaran donar las muestras de sangre para los exámenes de laboratorio. Esta dificultad se acentuó a medida que transcurría el tiempo de seguimiento. Mediante la explicación prolongada y repetida de la importancia del estudio se logró superar el problema, sumado ello a la visita personal que el médico y el profesional de laboratorio hicieron al paciente en su domicilio.
Con base en los hallazgos, su interpretación y el análisis de las limitaciones, consideramos que este informe permite resolver la esencia del problema de investigación.
Al incorporarse al estudio los pacientes presentaban un grado de compromiso hepático leve, sin alteración de los valores fisiológicos, salvo por el aumento de BT y BD, consecuencia de las alteraciones hepáticas que aparecen hasta en 37% de los infectados con P. falciparum14. En el día 5, la BT y la BD eran normales, debido a la mejoría del paludismo por el tratamiento específico y a la ausencia de toxicidad de la AQ. Esto concuerda con lo informado para un grupo de niños con malaria falciparum no complicada tratados con AQ o cloroquina15, quienes presentaron las pruebas de función hepática dentro de los límites normales los días 0 y 7.
Debe resaltarse que en el primer control postratamiento (día 5), casi la totalidad de los enfermos estaba en los intervalos normales de las pruebas realizadas, lo que sugiere fuertemente que el tratamiento no tiene efectos tóxicos de importancia clínica.
Durante el seguimiento, la ALT y la GGT presentaron disminución entre los días 5 y 10, posiblemente por la actividad antiinflamatoria de la AQ. En los casos de malaria falciparum no complicada se informa la aparición de un cuadro anémico (disminución de hemoglobina, eritrocitos y hematócrito) 48 horas después del comienzo de la fiebre y que permanece hasta por 2 semanas después de eliminar la parasitemia16. Entre los mecanismos fisiopatológicos propuestos para explicarlo se encuentran la destrucción aumentada de eritrocitos y una eritropoyesis inadecuada9,17. Este cuadro puede ser la explicación del comportamiento de estas variables en los pacientes y concuerda con lo encontrado por otros autores15 en niños que se trataron con cloroquina, AQ o sulfadoxina-pirimetamina.
El medicamento no causó leucopenia ni neutropenia, lo que concuerda con otros informes8,15, inclusive en dosis de 35 mg/kg15, aunque algunos las informan16. Los leucocitos y neutrófilos únicamente mostraron un leve aumento, que se puede deber a la respuesta inflamatoria malárica. In vitro se ha encontrado respuesta inmune humoral inducida por las 4-aminoquinolinas18, que explicaría la neutropenia observada en pacientes que reciben estos medicamentos durante tiempos prolongados3,12. El no haber observado leucopenia ni neutropenia en este estudio con un tratamiento de tres días con AQ, puede indicar que no existe un tiempo suficiente para producir anticuerpos IgG antineutrófilos y ocasionar toxicidad hemática cuando este fármaco se usa como antimalárico; lo referido concuerda con un informe que indica que la actividad de estos anticuerpos se perdió cuando se suspendió el medicamento19.
La trombocitopenia pretratamiento concuerda con un hallazgo previo en Turbo, donde 71% de los pacientes con malaria por P. vivax o P. falciparum no complicada presentan esta característica20. Esta trombocitopenia posiblemente se debe a destrucción y consumo de plaquetas en la periferia21. En los pacientes del estudio, los valores de plaquetas se normalizaron el día 5, lo que demuestra una recuperación a partir de precursores en médula ósea y es congruente con lo observado en otros trabajos, donde el retorno a la normalidad sucedió entre 5 y 14 días21.
Los efectos adversos encontrados en este trabajo fueron leves y concuerdan con lo informado7,8. Según nuestra experiencia y los datos de la Oficina de Epidemiología de la Dirección Seccional de Salud de Antioquia (DSSA) (mayo de 2005), los informes sobre reacciones adversas posiblemente asociadas con AQ, durante los 20 años de su empleo como antimalárico, son muy pocos y siempre de poca gravedad (comunicación del jefe de epidemiología DSSA). En los últimos cinco años, el tratamiento con AQ o con AQ+S-P para la malaria no complicada por P. falciparum se ha evaluado en muchos países africanos y siempre se hubo muy buena tolerancia y muy pocos, leves y pasajeros efectos adversos22.
En conclusión, en este estudio, que evaluó enfermos residentes en una zona endémica de paludismo, se encontró que el uso de la AQ para el tratamiento de la malaria por P. falciparum no complicada, en dosis total de 25 mg/kg en tres días, es eficaz y seguro, lo cual coincide con el informe de Olliaro y su grupo en 19968. También concuerdan estos datos, con los hallazgos de la investigación previa de Carmona et al.1 que evaluó la respuesta terapéutica a AQ+S-P en pacientes con malaria por P. falciparum no complicada, donde la eficacia terapéutica fue de 98% (con 28 días de seguimiento) y la frecuencia de efectos adversos fue 1%, que siempre fueron leves.
Todo lo anterior permite sugerir que es correcto continuar con el uso de la AQ en Colombia (combinada con S-P) y que se debería evaluar su utilidad en los países amazónicos, como se está haciendo en los africanos, donde los resultados demuestran la eficacia y utilidad de este medicamento, sobre todo combinado con sulfadoxina-pirimetamina. También es pertinente llamar la atención sobre la conveniencia de diseñar y poner en operación un sistema de vigilancia epidemiológica de la toxicidad de los medicamentos antimaláricos, al tiempo que, por ejemplo, se puede analizar su eficacia; como otros han señalado23, el conocimiento de estos problemas es incipiente en Colombia y en muchos otros lugares de endemia palúdica. Esta investigación ha permitido medir la clase y frecuencia de efectos adversos de la AQ en un grupo relativamente pequeño de enfermos; es claro que efectos con ocurrencia muy escasa, pero que pueden ser graves, no se pueden captar en un grupo pequeño como el actual, aunque se haya seleccionado de manera adecuada.
Al Personal del hospital «Francisco Valderrama» de Turbo, del Laboratorio Clínico «Unilab» (Apartadó) y del Instituto Colombiano de Medicina Tropical (Medellín); a los técnicos del Programa de Control de la Malaria en Turbo por su invaluable ayuda y a los pacientes por su participación en este estudio.
REFERENCIAS
1. Carmona-Fonseca J, Tobón A, Álvarez G, Blair S. El tratamiento amodiaquina-sulfadoxina-pirimetamina tiene eficacia del 98% para la malaria falciparum no complicada (Antioquia, Colombia; 2003). Iatreia 2005; 18: 5-26.
2. González L, Blair S, Carmona-Fonseca J. Hepatotoxicidad causada porla amodiaquina. Acta Med Colomb 2000; 25: 333-336.
3. Hatton CS, Peto TE, Bunch C, Pasvol G, Russell SJ, Singer CR, et al. Frequency of severe neutropenia associated with amodiaquine prophylaxis against malaria. Lancet 1986; 1: 411-414.
4. Larrey D, Castot A, Pessayre D, Merigot P, Machayekhy JP, Feldmann G, et al. Amodiaquine-induced hepatitis. A report of seven cases. Ann Intern Med 1986; 104: 801-803.
5. Neftel KA, Woodtly W, Schmid M, Frick PG, Fehr J. Amodiaquine induced agranulocytosis and liver damage. Br Med J 1986; 292: 721-723.
6. Taylor WR, White NJ. Antimalarial drug toxicity: a review. Drug Saf 2004; 27: 25-61.
7. Olliaro P, Mussano P. Amodiaquine for treating malaria. Cochrane Database Syst Rev 2000;2: CD000016. Review. Update in: Cochrane Database Syst Rev 2003; (2): CD000016.
8. Olliaro P, Nevill C, LeBras J, Ringwald P, Mussano P, Garner P, et al. Systematic review of amodiaquine treatment in uncomplicated malaria. Lancet 1996; 348: 1196-1201.
9. White NJ, Ho M. The pathophysiology of malaria. In: Baker JR, Muller R, (eds). Advvances in Parasitology 1992; 31: 84-175.
10. Maggs JL, Tingle MD, Kitteringham NR, Park BK. Mechanisms of formation of protein-arylating intermediates from amodiaquine, a myelotoxin and hepatotoxin in man. Biochem Pharmac 1988; 37: 303-311.
11. Farombi EO, Adoro S, Uhunmwangho S. Antimalarial drugs exacerbate rat liver microsomal lipid peroxidation in the presence of oxidants. Biosci Rep 2001; 21: 353-359.
12. Naisbitt DJ, Ruscoe JE, Williams D, O’Neill PM, Pirmohamed M, Park BK. Disposition of amodiaquine and related antimalarial agents in human neutrophils: implications for drug design. J Pharmacol Exp Ther 1997; 280: 884-893.
13. Kulkarni ML, Rego SJ. Value of single Widal test in the diagnosis of typhoid fever. Indian Pediatr 1994; 31: 1373-1377.
14. Harris VK, Richard VS, Mathai E, Sitaram U, Kumar KV, Cherian AM, et al. A study on clinical profile of falciparum malaria in a tertiary care hospital in south India. Indian J Malariol 2001; 38: 19-24.
15. Sowunmi A, Ayede AI, Falade AG, Ndikum VN, Sowunmi CO, Adedeji AA, et al. Randomized comparison of chloroquine and amodiaquine in the treatment of acute, uncomplicated, Plasmodium falciparum malaria in children. Ann Trop Med Parasitol 2001; 95: 549-558.
16. Menéndez C, Fleming AF, Alonso PL. Malaria-related anaemia. Parasitol Today 2000; 16: 469-476.
17. Llanos C, Flórez MH, Arévalo-Herrera M, Herrera S. Mecanismos de generación de anemia en malaria. Colomb Med 2004; 35: 205-214.
18. Targett GAT. Malaria: drug use and immune responses. Parasitology 1992; 105 (Suppl): 61-70.
19. Rouveix B, Coulombel L, Aymard P, Chau F, Abel L. Amodiaquine induced immune agranulocytosis. Br J Haematol 1989; 71: 7-11.
20. Ríos-Orrego A, Álvarez-Castillo T, Carmona-Fonseca J, Blair-Trujillo S. Evolución temporal de las plaquetas y los anticuerpos antiplaquetarios en pacientes de área endémica con malaria no complicada. An Med Intern (Madrid) 2005; 22: 561-568.
21. Karanikas G, Zedwitz-Liebenstein K, Eidherr H, Schuetz M, Sauerman R, Dudczak R, et al. Platelet kinetics and scintigraphic imaging in thrombocytopenic malaria patients. Thromb Haemost 2004; 91: 553-557.
22. World Health Organization. Roll Back Malaria, UNICEF. World Malaria Report 2005. Geneve: WHO; 2005. WHO/HTM/MAL/2005.1102.
23. Segura O, Maldonado CE. Las reacciones adversas a medicamentos: una aproximación desde el punto de vista económico. Biomedica 2003; 23: 401-407.