Ausencia de correlación entre las cifras tensionales, el daño de órgano blanco y la presencia de retinopatía en el modelo animal de hipertensión con L-NAME: ¿Son necesarios nuevos modelos animales en hipertensión arterial?*
Jorge Hernán Ramírez, M.D., M.Sc.1, Mauricio Palacios, M.D., M.Sc.2, Hugo Ocampo, M.D.3, Claudia Zuluaga, M.D.3, Oscar Gutiérrez, M.D., M.Sc.2
* Estudio financiado por COLCIENCIAS, proyecto código 11060413079.
1. Profesor Auxiliar, Departamento de Ciencias Fisiológicas, Escuela de Ciencias Básicas, Facultad de Salud, Universidad del Valle, Cali, Colombia. e-mail: jorgehramirez31@yahoo.com
2. Profesor Asistente, Departamento de Ciencias Fisiológicas, Escuela de Ciencias Básicas, Facultad de Salud, Universidad del Valle, Cali, Colombia. e-mail: ogutie@telesat.com.co maopalacios@yahoo.com
3. Profesor Auxiliar, Sección de Oftalmología, Departamento de Cirugía, Escuela de Medicina, Facultad de Salud, Universidad del Valle, Cali, Colombia. e-mail: hhocampo@telesalud.com.co czuluaga@imbanaco.com.co
Recibido para publicación abril 28, 2006 Aceptado para publicación septiembre 8, 2006
RESUMEN
La comunidad científica nacional e internacional utiliza ampliamente modelos animales de hipertensión para el estudio de posibles fármacos antihipertensivos. Sin embargo, algunas de las complicaciones de la hipertensión arterial no se expresan por completo en los modelos animales. En este artículo se presenta la falta de correlación de las cifras tensionales con la retinopatía, en el modelo de ratas hipertensas por L-NAME. Además, plantea interrogantes con respecto al desarrollo de nuevos modelos animales de hipertensión, mejor correlacionados con la hipertensión humana y que permitan predecir con mayor certeza los efectos de un medicamento antihipertensivo en los seres humanos.
Palabras clave: Retinopatía; L-NAME; Óxido nítrico; Hipertensión.
Lack of association between blood pressure, target organ damage and retinopathy in the L-NAME rat hypertension model: Are new animal models of hypertension required?
SUMMARY
Animal models of hypertension are widely used by the national and international scientific community to study potential antihypertensive drugs. Nevertheless, some of the hypertension complications are not completely expressed in animal models. In this article the lack of blood pressure and retinopathy correlation in the L-NAME hypertensive rat model is presented. Furthermore, questions related to the development of new animal hypertension model, with a better correlation to human hypertension that would allow a more certain prediction regarding the effects of an antihypertensive drug are posed.
Keywords: Retinopathy; L-NAME; Nitric oxide; Hypertension.
Los modelos animales de una enfermedad humana se utilizan ampliamente para diseñar y evaluar nuevos medicamentos. La disponibilidad de los modelos animales experimentales ha hecho posibles muchos de los avances en la farmacología, así como ha facilitado la comprensión de la fisiopatología de numerosas enfermedades como hipertensión arterial1, diabetes2 y cáncer3. Sin embargo, un modelo animal puede presentar diferencias significativas en la fisiopatología, complicaciones y en la farmacología de una enfermedad humana. Es claro que entre mayor sea el grado de similitud entre un modelo experimental animal con una enfermedad humana, mayor será la posibilidad de comprender su fisiopatología y de desarrollar fármacos eficaces. Ejemplos de lo anterior son enfermedades como el Alzheimer y la cistitis intersticial, donde la carencia de fármacos terapéuticamente eficaces se debe en gran medida a la falta de modelos animales para ambas enfermedades4,5.
La comunidad científica para comprender la fisiopatología y el desarrollo de medicamentos antihipertensivos, emplea muchos los modelos de ratas hipertensas. A fin de dar una idea del uso de estos animales a nivel mundial, una búsqueda en las bases de datos de MEDLINE (marzo 2006) con las palabras claves SHR (ratas espontáneas hipertensas), L-NAME (L-nitroargininametilester) y 2K1C (ratas hipertensas por estenosis de arteria renal) entregó más de 12,000 resultados. Sin embargo, se debe tener en cuenta que la hipertensión arterial es una enfermedad compleja y multifactorial propia de los seres humanos con varias características fisiopatológicas que difieren de los modelos animales. Esto se debe a varias razones, como la etiología secundaria en todos los modelos animales de hipertensión arterial, la forma variable en que ocasionan daño de órgano blanco y la ausencia de complicaciones comunes en la hipertensión humana como la ateroesclerosis. Además, una extensa búsqueda en varias bases de datos (SciELO, MEDLINE y LILACS) mostró que no existen publicaciones en modelos animales de hipertensión que evalúen la presencia de retinopatía hipertensiva como criterio para daño de órgano blanco, pese a que esta complicación afecta entre 50% y 80% de las personas hipertensas y se correlaciona positivamente con otros marcadores de daño de órgano blanco como la microalbuminuria, grosor íntima media (IMT) e hipertrofia ventricular izquierda6,7.
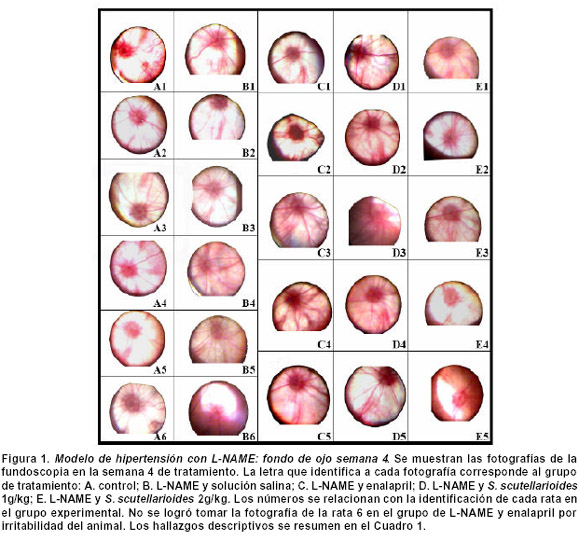
Hace poco este mismo grupo de investigación publicó los efectos de la Salvia scutellarioides en un modelo de hipertensión por L-NAME (40 mg/kg/día i.p.)8. Durante el proyecto, se observó la retina a la cuarta semana de la administración del L-NAME (un día previo al sacrificio de los animales) con un video-oftalmoscopio indirecto Omega 2C (Heine®) con un lente de 20 dioptrías (Heine®). Las fotografías de la retina se enmascararon para que las evaluaran dos oftalmólogos experimentados. En cada fotografía se definieron como parámetros de retinopatía la congestión del disco, la tortuosidad y la relación arteriovenosa (relación AV).
Al desenmascarar los resultados, se encontró que muy pocas ratas hipertensas mostraban hallazgos compatibles con retinopatía hipertensiva. Además, no se observó ninguna correlación entre las alteraciones de la retina con los grupos de ratas que presentaron las mayores cifras tensionales durante los 30 días del experimento (Figura 1 y Cuadro 1).
Los resultados de la fundoscopia en el modelo de hipertensión con L-NAME no fueron concluyentes para retinopatía hipertensiva y no se correlacionan con los hallazgos de daño vascular en las histopatologías renales y cardíacas de las mismas ratas8. Para explicar la ausencia de hallazgos de retinopatía hipertensiva hay que tener en cuenta que no se encuentran publicaciones que evalúen el desarrollo de retinopatía experimental con L-NAME, por lo que se desconoce si este modelo cursa con alteraciones macroscópicas en el fondo de ojo. Además, la ausencia de resultados concluyentes en la fundoscopia que se hizo en la semana cuatro, no excluye la posibilidad del desarrollo de retinopatía en fases posteriores del modelo. Sin embargo, estudios recientes con L-NAME en conejos sugieren que el óxido nítrico no cumple un papel esencial en el flujo sanguíneo a la retina, lo que podría explicar la ausencia de retinopatía en este modelo9,10. Se requiere estudiar el fondo de ojo en otros modelos animales de hipertensión arterial, para determinar si la ausencia de retinopatía es una característica común de todos los modelos animales de hipertensión o si es exclusiva del modelo L-NAME.
La ausencia de complicaciones vasculares visibles en todos los modelos animales de hipertensión y la poca correlación entre las cifras tensionales con los hallazgos descritos de retinopatía, sustenta la necesidad de modelos experimentales con lesión de órgano blanco que corresponda con el desarrollo de la hipertensión, y semejen mejor las características de la hipertensión arterial en los seres humanos. El desarrollo de medicamentos antihipertensivos innovadores depende en gran medida de la disponibilidad de nuevos modelos animales que simulen mejor las características fisiopatológicas y las complicaciones de la hipertensión arterial. Los recientes avances en genómica y proteómica pueden ayudar a comprender mejor la naturaleza multifactorial de las enfermedades y facilitar la creación de nuevos modelos experimentales, mejor correlacionados con las enfermedades humanas, e indispensables para el desarrollo de nuevos medicamentos eficaces e innovadores11. Sin embargo, hasta no tener la disponibilidad de nuevos métodos para evaluar los medicamentos antihipertensivos, el uso de modelos con ratas hipertensas continúa siendo el más confiable, costo-efectivo y aproximado con la hipertensión humana.
REFERENCIAS
1. Sun ZJ, Zhang ZE. Historic perspectives and recent advances in major animal models of hypertension. Acta Pharmacol Sin 2005; 26: 295-301.
2. Renard C, Van Obberghen E. Role of diabetes in atherosclerotic pathogenesis. What have we learned from animal models? Diabetes Metab 2006; 32: 15-29.
3. Hansen K, Khanna C. Spontaneous and genetically engineered animal models; use in preclinical cancer drug development. Eur J Cancer 2004; 40: 858-880.
4. Reddy PH, McWeeney S. Mapping cellular transcriptosomes in autopsied Alzheimer’s disease subjects and relevant animal models. Neurobiol Aging 2006; 27: 1060-1077.
5. McMurray G, Casey JH, Naylor AM. Animal models in urological disease and sexual dysfunction. Br J Pharmacol 2006; 147 (Suppl 2): 62-79.
6. Cuspidi C, Meani S, Valerio C, Fusi V, Cantina E, Sala C, et al. Prevalence and correlates of advanced retinopathy in a large selected hypertensive population. The Evaluation of Target Organ Damage in Hypertension (ETODH) study. Blood Press 2005; 14: 25-31.
7. Cuspidi C, Salerno M, Salerno DE, Meani S, Valerio C, Esposito A, et al. High prevalence of retinal vascular changes in never-treated essential hypertensives: an inter- and intra-observer reproducibility study with non-mydriatic retinography. Blood Press 2004; 13: 25-30.
8. Ramírez JH, Palacios M, Gutiérrez JO. Estudio del efecto antihipertensivo de la Salvia scutellarioides en un modelo de ratas hipertensas. Colomb Med 2006; 37: 53-60.
9. Takayama J, Tomidokoro A, Ishii K, Tamaki Y, Fukaya Y, Hosokawa T, et al. Time course of the change in optic nerve head circulation after an acute increase in intraocular pressure. Invest Ophthalmol Vis Sci 2003; 44: 3977-3985.
10. Takayama J, Tomidokoro A, Tamaki Y, Araie M. Time course of changes in optic nerve head circulation after acute reduction in intraocular pressure. Invest Ophthalmol Vis Sci 2005; 46: 1409-1419.
11. Zerkowski HR, Grussenmeyer T, Matt P, Grapow M, Engelhardt S, Lefkovits I. Proteomics strategies in cardiovascular research. J Proteome Res 2004; 3: 200-208.