Establecimiento y caracterización de una línea celular derivada de un glioblastoma multiforme
Verónica Rincón, B.Sc., M.Sc.1, Carmen Lucía Roa, M.D.2, Gloria Osorio, Biol., Ph.D.3, Gerardo Aristizábal, M.D.4, Jaime E. Castellanos, O.D., M.Sc., Ph.D.5
1. Instructora Asociada, Instituto de Virología, Universidad El Bosque, Bogotá, Colombia. e-mail: veroka_27@yahoo.es
2. Profesora Asistente, Facultad de Medicina, Universidad El Bosque, Bogotá, Colombia. e-mail: clroa@hotmail.com
3. Profesora Asociada, Instituto de Genética Humana, Universidad Javeriana, Bogotá, Colombia. e-mail: gosorio@javeriana.edu.co
4. Profesor Titular, Facultad de Medicina, Universidad El Bosque, Bogotá, Colombia. e-mail: garisti@unbosque.edu.co
5. Profesor Asistente, Instituto de Virología, Universidad El Bosque. Facultad de Odontología, Universidad Nacional de Colombia, Bogotá, Colombia. e-mail: castellanosjaime@unbosque.edu.co
Recibido para publicación diciembre 7, 2005 Aceptado para publicación enero 4, 2007
RESUMEN
Introducción: Las líneas celulares y los cultivos primarios son una excelente herramienta para el estudio de la biología, desarrollo y respuesta a la terapia en tumores cerebrales.
Objetivo: Establecer y caracterizar una línea celular derivada de un glioblastoma multiforme como un modelo de estudio in vitro para la extrapolación y aplicación futura en terapia génica.
Material y métodos: Se obtuvo una muestra de un paciente con diagnóstico clínico e histopatológico de glioblastoma multiforme, se caracterizó mediante inmunohistoquímica en cortes de tejido y por inmunocitoquímica sobre células cultivadas a partir del tumor desde el inicio del cultivo y durante los seis primeros pases, con dos tipos de marcadores específicos para glía: GFAP (glial fibrillary acidic protein) y S-100 (proteína de unión a calcio). Además, se evaluó la expresión de p53 y Bcl-2, como moduladores de apoptosis. Por último se hizo la caracterización citogenética.
Resultados: Histopatológicamente, se confirmó el diagnóstico de glioblastoma multiforme. En los cultivos primarios se encontraron características citomorfológicas propias de un glioblastoma: células fibroblastoides planas, células con escaso citoplasma con 3 ó más procesos y por último bipolares o unipolares. Se encontró una expresión diferencial con los cuatro marcadores, con un patrón de marcaciones a nivel citoplasmático y nuclear a través de los pases estudiados. La línea celular se caracterizó por ser en su mayoría aneuploide con un número modal cromosómico entre 43 y 45, con un gran número de poliploidías (55-102 <4n>, XXYY) y endo-reduplicaciones (end 45, X, -Y).
Conclusión: Se estableció una línea celular derivada de un glioblastoma multiforme con un fenotipo estable, con un notable mantenimiento del perfil glial y citogenético.
Palabras clave: Línea celular; Glioblastoma multiforme; Inmunocitoquímica; Inmunohistoquímica; Bcl-2, p53.
Initiation and characterization of a glioblastoma multiforme derived cell line
SUMMARY
Introduction: Cell lines and primary cultures are a useful tool for studying basic biology, development and therapy responses in cancer and nervous system tumors.
Aim: To establish and characterize a human glioblastoma multiforme (GBM) derived cell line as an in vitro biological model to study nervous system cancer chemotherapy and gene therapy.
Materials and methods: A resected tumor piece was obtained from a patient with clinical and histopathological diagnosis of GBM. It was processed to obtain viable cells to culture and histological sections, which were immunostained to glial fibrillary acid protein (GFAP) and S-100 protein (calcium binding protein) and to evaluate expression of apoptosis related proteins p53 and Bcl-2. Finally a cytogenetic evaluation was carried out.
Results: Histopathological examination confirmed classic findings of GBM. Typical cytomorphological features of GBM were found in cells of the primary cultures: bipolar or unipolar cells, flat fibroblastoid cells, process-bearing cells with scant cytoplasm and 3 or more processes. It was found a differential expression of the four markers, which had a nuclear and cytoplasmatic staining pattern throughout studied subcultures. Cell line exhibited a high level of aneuploidy with modal chromosomal number between 43-45, with presence of poliploidy (55-102 <4n>, XXYY) and endoreduplication (end 45, X, -Y).
Conclusion: It was established a GBM derived cell line with a stable phenotype, maintaining morphological cell and cytogenetic characteristics.
Keywords: Cell Line; Human glioblastoma multiforme;Immunocytochemistry; Immunochemistry; Bcl-2, p53.
Los tumores gliales constituyen el grupo más común de tumores intracraneanos y de éstos, el glioblastoma multiforme (GBM, grado IV de la OMS) sobresale por su malignidad, su rápida evolución y resistencia a las medidas terapéuticas convencionales: irradiación y quimioterapia después de la cirugía1-5. Este tumor se caracteriza por hipercelularidad glial, núcleos atípicos (pleomorfismo nuclear, multinucleación, cromatina nuclear gruesa), actividad mitótica visible y proliferación vascular prominente con hiperplasia endotelial, frecuentemente tan intensa que causa obstrucción vascular y por ende abundantes áreas de necrosis tisular que actúan a su vez como estímulo hipóxico inductor de angiogénesis1-3.
Los conceptos generales de la biología de los gliomas incluyen la hipótesis que los defectos en la vía que regulan la susceptibilidad a la apoptosis están comprometidas en el desarrollo y progresión de su malignidad, así como en la resistencia intrínseca a la quimioterapia adyuvante2-8.
Durante la apoptosis, los cambios morfológicos observados en la célula, son la manifestación de reacciones bioquímicas intercelulares. La maquinaria enzimática responsable de estos cambios la constituyen principalmente las caspasas. Se han descrito dos vías que conducen a su activación, la vía extrínseca que se inicia en la membrana celular y es mediada por ligandos que se unen a sus receptores y la vía intrínseca que se inicia en la mitocondria y es mediada por estrés celular o por lesión en el ADN8,9. A los mecanismos intrínsecos de la apoptosis los controlan las proteínas y genes de la familia Bcl-2. Los productos de esta familia de genes pueden actuar como promotores (p21BAX, Bcl-xS, etc) o inhibidores (Bcl-2, Bcl-xL) de apoptosis8-12.
La expresión de proteínas de la familia Bcl-2 en gliomas malignos se analizó in vivo; mediante análisis inmunohistoquímico se encontró una expresión en 70% de los tumores cerebrales analizados6,7. A su vez, se informó una alta expresión de Bcl-2, Bcl-x y Bax en gliomas, sobre todo en glioblastomas recurrentes8-12. La expresión de esta familia de genes se puede regular de modo diferencial en asociación con la progresión del tumor y la diferenciación10. Además, se encontró la expresión de proteínas anti y pro-apoptóticas de la familia Bcl-2 en líneas celulares de glioma humano9-13.
Las anormalidades más comunes a nivel genético en cánceres humanos son las mutaciones en p53, que es un activador transcripcional de corta vida que puede inducir apoptosis14-16. Se ha informado la expresión de p53 en astrocitomas (difusos y anaplásicos) y en glioblastomas multiformes9. Las mutaciones en p53 se presentan en más de 30% de los gliomas, como un hecho temprano, para sugerir que las anormalidades de p53 están comprometidas con el desarrollo de los gliomas. Es interesante resaltar que la incidencia de las mutaciones de p53 en líneas celulares de gliomas es similar a la que se informa para tumores cerebrales primarios, e indica que estas líneas son herramientas útiles para investigar el papel antineoplásico del gen p53 de forma silvestre en los gliomas9,16,17. Es común la pérdida de heterocigocidad del cromosoma 10 en el GBM y podría muy posiblemente causar la disfunción de un gen supresor de tumor adicional14.
Las líneas celulares y los cultivos primarios se emplean en diferentes estudios de oncogénesis pues aportan un modelo importante para estudiar las características y funciones del tumor del que proceden. Una línea celular muestra características muy bien definidas, son más sencillas de manejar que los cultivos primarios, crecen continuamente y se puede obtener un mayor número de células, aunque pierden muchas de sus propiedades respecto a la muestra original del tumor y presenta cambios progresivos en el número de cromosomas18,19. Como el fenotipo estable de la línea celular surge de un cultivo primario a través del tiempo, se hace necesario caracterizar las células en dos aspectos fundamentales:
Los cultivos primarios de tumores cerebrales de estirpe neuroepitelial y mesenquimal son un magnífico banco de pruebas para el estudio de las características citocinéticas y oncogénicas, así como para comprobar in vitro la quimio o radiosensibilidad de las mismas características18.
El propósito de este estudio fue establecer una línea celular derivada de un GBM como un método de estudio in vitro para la extrapolación y aplicación futura en estudios de terapia génica para glioblastoma. Para la caracterización por inmunocitoquímica e inmunohistoquímica se utilizaron dos tipos de marcadores específicos para glía, previamente caracterizados: GFAP (glial fibrillary acidic protein)20-22 y S-10023. Y a su vez se evaluó la expresión de p53 y Bcl-2, como moduladores de apoptosis. Por último se hizo la caracterización citogenética.
MATERIALES Y MÉTODOS
Recolección de la muestra. Se tomó una muestra representativa del tumor en condiciones de total asepsia en el propio quirófano de neurocirugía, previo consentimiento informado de un paciente de 66 años con diagnóstico clínico y radiológico de GBM. La muestra se dividió en dos porciones, la primera se utilizó para el establecimiento del cultivo primario y se colocó en DMEM suplementado con antibiótico (penicilina 100 U/ml y estreptomicina 100 mg/ml) y anfotericina (0.25 mg/ml) y la segunda se transportó en paraformaldehído (PFA) al 4% para el análisis por inmunohistoquímica.
Cultivo primario obtenido a partir de un GBM. La muestra se cortó en pequeños fragmentos, que se incubaron a 37°C por 30 minutos en medio completo (DMEM, suero fetal bovino al 10% (SFB), antibiótico y anfotericina) con colagenasa (2 mg/ml, Gibco BRL) y dispasa (5 mg/ml, Gibco BRL). Se realizó una disociación mecánica con pipeta Pasteur y se centrifugó a 1000 rpm por 7 minutos. Se sembraron la suspensión celular y los explantes celulares en frascos de cultivo de 25 cm2 en medio completo. Se incubó a 37°C con 5% de CO2 y se hizo el cambio de medio cada 48 horas.
Se realizaron pases sucesivos cuando el cultivo primario alcanzó una confluencia mayor de 70% mediante disociación de la monocapa celular con tripsina al 0.25 %. La viabilidad celular se midió por el método de exclusión con azul tripán y recuento en cámara de Neubauer. En el microscopio de contraste de fase se efectuó el seguimiento diario del crecimiento de las células en cultivo con un registro fotográfico en los diferentes días de cultivo y a través de los pases sucesivos.
Criopreservación de la línea celular. Desde el establecimiento y durante los diversos pases se criopreservó la línea celular en DMEM al 40% suplementado con SFB al 50% y DMSO 10% y se almacenó en nitrógeno líquido a -196°C.
Anticuerpos utilizados. Se utilizaron los siguientes anticuerpos para el análisis inmunoquímico: un anticuerpo policlonal de conejo contra GFAP, en dilución 1/250 (DAKO Z0334), anticuerpo anti-S-100, en dilución de 1/500 (DAKO, ZO31), un anticuerpo monoclonal para p53, que reconoce los aminoácidos 211 a 220 tanto de la proteína silvestre como de la mutada, en una dilución de 1/25 (Chemicon, CBL404) y por último un anticuerpo policlonal anti-Bcl-2 humano, en dilución de 1/500 (Beckton Dickinson, Ref 554160).
Inmunohistoquímica. Se hicieron cortes sucesivos de 10 mm a partir de bloques parafinados. Se coloreó con hematoxilina eosina para el análisis histopatológico. Las láminas se incubaron en un horno a 60°C por 30 minutos, se desparafinaron con xilol y se rehidrataron con concentraciones descendentes de alcohol etílico. Se hizo un paso de recuperación antigénica con amortiguador de citrato para cubrir totalmente las láminas y luego se llevaron al autoclave donde se las dejó hasta 15 libras de presión por 10 minutos. Después se inactivó la peroxidasa endógena por 30 minutos con H2O2 al 3% preparada en PBS. Las células inmuno-reactivas se descubrieron con los anticuerpos primarios descritos antes preparados en PBS con 5% suero de caballo durante 30 minutos a 37°C en cámara húmeda. Luego se incubó con un anticuerpo secundario (anti-IgG de conejo biotinilado o un anti-IgG anti-ratón biotinilado, a una concentración 1/200 Vector Labs). Se agregó estreptavidina acoplada a peroxidasa (1 mg/ml, Vector Labs) por 20 minutos a temperatura ambiente. Se reveló con una mezcla 1:1 de H2O2 al 0.02% y diaminobenzidina (3 mg) en Tris-HCl (pH 7.2). Se agregó sulfato de cobre por 5 minutos, se tiñeron con hematoxilina, se deshidrataron y se montaron en Poly-mount con cubreobjetos. La metodología se llevó a cabo de acuerdo con protocolos estándar ya informados29.
Además, se siguió el mismo proceso en distintos cortes de tejido de un melanoma humano (DAKO, T1241) que se emplearon como controles positivos con los diferentes anticuerpos para la técnica inmunohistoquímica.
Inmunocitoquímica. Aproximadamente 5,000 células a partir del cultivo primario se sembraron en cajas de 24 pozos (Corning 25870) sobre cubreobjetos redondos pre-tratados con poli-L-lisina (10 mg/ml) durante el primero, segundo, tercero y sexto pases. Al quinto día de cultivo las células se fijaron con PFA al 4% por 30 minutos y, se protegió la monocapa con gelatina al 0.5% por 10 minutos a 0°C para evitar su desprendimiento. Luego se permeabilizó con tritón X-100 por 30 minutos y se inactivó la peroxidasa endógena con H2O2 al 0.5% en metanol al 50% por 45 minutos. Las células inmuno-reactivas fueron detectadas mediante los anticuerpos primarios descritos antes, preparados en PBS con 5% suero de caballo durante 30 minutos a 37°C en cámara húmeda. Luego se incubaron con un anticuerpo secundario (anti-IgG de conejo biotinilado o un anticuerpo anti-IgG anti-ratón biotinilado, a una concentración 1/200 Vector Labs). Después se agregó estreptavidina acoplada a peroxidasa (1 mg/ml, Vector Labs) por 30 minutos a temperatura ambiente y se reveló con una mezcla 1:1 de H2O2 al 0.02% y diaminobenzidina 0.1% en Tris-HCl (pH 7.2). Las células se contracolorearon con haemalum de Mayer, se deshidrataron y montaron en Poly-mount. En la metodología se siguieron las técnicas estándar ya informadas29. En un microscopio triocular con 40 X se contaron distintos campos hasta completar 100 células, entre células inmuno-reactivas y no inmuno-reactivas. Se efectuó el recuento celular en 3 réplicas para cada tiempo analizado (n=3).
Inmunofluorescencia indirecta. El método en la primera parte fue el mismo que se empleó para inmunocitoquímica. Se colocó un anticuerpo contra GFAP (DAKO) en cámara húmeda por 1 hora a 37°C. Después de lavar con PBS, se incubó por 30 minutos a temperatura ambiente con el anticuerpo secundario anti-IgG de conejo biotinilado (Vector Labs). Luego se agregó estreptavidina conjugada a CY3 (1/400, Sigma) por 30 minutos a temperatura ambiente. Las láminas se montaron con glicerol amortiguado 9:1 y se observaron en un microscopio de epifluorescencia.
Obtención de preparados cromosómicos a partir de cultivo primario de GBM. La monocapa celular se disoció con tripsina al 0.25% preparada en PBS. Se sembró 1 ml de suspensión celular en una lámina portaobjetos, y se dejó en adhesión por 50 minutos y luego se completo el volumen con 14 ml de medio completo, y se incubó por 48 horas. Se adicionó colchicina (100 mg/ml) por 3 horas a 37º C, se agregaron 15 ml de solución hipotónica (KCl 0.052 M a 37ºC) por 10 minutos y luego 2 ml de fijador Carnoy (3: 1 metanol y ácido acético) gota a gota por las paredes de la caja por 10 minutos. Se pasó la lámina portaobjeto a una caja de Petri con 15 ml de fijador frío por 50 minutos, se sacó cuidadosamente y se secaron las láminas a temperatura ambiente. Estas se incubaron en 2X SSC a 60°C durante 30 min, se lavaron con abundante agua de chorro y se dejaron secar a temperatura del medio. Se agregó una solución de tripsina (1/125) en agua destilada, se colocaron en solución por 1 a 5 segundos agitando con suavidad. Luego se sacaron, se lavaron con abundante agua de chorro, se secaron a temperatura ambiente, se colorearon con Giemsa durante 10 min. Por último, se observaron y se fotografiaron a 1,000 X de aumento.
RESULTADOS
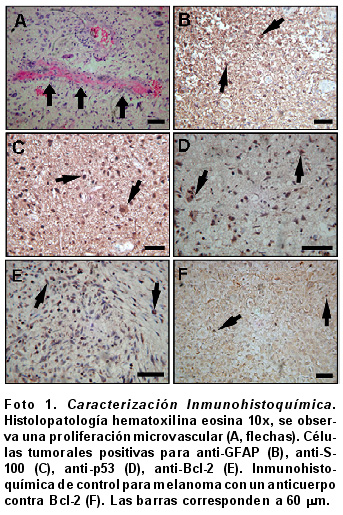
Caracterización inmunohistoquímica de tejidos de GBM. Histopatológicamente, se encontró una marcada proliferación microvascular (Foto 1A) y focos de necrosis. A su vez, se observaron fragmentos de una lesión tumoral constituida por células pleomórficas, algunas gigantes, con marcas atípicas, núcleos angulados, hipercromáticos, inmersas en una matriz fibrilar, figuras mitóticas y necrosis fibrinoide de las paredes vasculares. Todos los marcadores presentaron inmuno-reactividad principalmente en el citoplasma, pero se observó marcación nuclear para p53 y Bcl-2. En la Foto 1 se muestran los diferentes marcadores estudiados, para GFAP (1B) se presentó inmuno-reactividad en el citoplasma, S-100 (1C) mostró marca nuclear y citoplasmática, p53 (1D) fue positivo en los núcleos de las células tumorales y para Bcl-2 (1E) la marcación fue citoplasmática. A su vez, se utilizaron como controles positivos cortes de tejido de melanoma humano donde se observó inmuno-reactividad; para cada uno de los marcadores estudiados, se muestra solamente la marcación específica obtenida para Bcl-2, como ejemplo (1F).
Cultivos primarios de células de GBM. En los cultivos primarios se encontraron características citomorfológicas propias de un GBM, con células gigantes multinucleadas, células sincitiales fusiformes pequeñas que varían en su extensión, con tendencia a fusionarse entre sus prolongaciones (Foto 2A). Se logró establecer el cultivo en los primeros 22 días cuando se hizo la descripción detallada para los diversos tipos celulares. Al cuarto día del aislamiento celular, se observaron distintos tipos celulares diferenciales (2A, muestra uno de los explantes en el lado inferior de la microfotografía en contraste de fase), se aprecia un fenotipo estable que emergió del cultivo a través del tiempo como se puede apreciar a los 10 días de cultivo (2C) y que se hace más notorio a los 22 días (2D). Se encontró migración de las células, pues se disponían inicialmente en forma radial con células bipolares y unipolares de gran tamaño, para luego transformarse con rapidez en elementos fibroblastoides (flechas, Foto 2B). Una vez el cultivo alcanzó una confluencia de 70% se realizó el primer subcultivo, durante los primeros seis pases se hizo la caracterización celular, donde ya se observaba un fenotipo estable con un predominio de células unipolares y bipolares; es de anotar que en pases posteriores (pase 30) la caracterización morfológica indicó un comportamiento idéntico.
Caracterización inmunocitoquímica de las células de cultivos de GBM. Los análisis inmunocitoquímicos con los marcadores gliales (GFAP y S-100) demostraron un gran número de células positivas, se observó una marcación citoplasmática uniforme e irregularmente observada en el núcleo. El patrón de coloración fue filamentoso o compacto y homogéneo en los tres diferentes tipos celulares identificados: células fibroblastoides planas, grandes, con gran cantidad de citoplasma respecto del núcleo (cabeza de flecha, Foto 3C), el segundo tipo correspondió a células con escaso citoplasma con 3 ó más procesos (flechas oscuras, Foto 3A) y por último células bipolares o unipolares (flechas claras, Foto 3E-3G).

El patrón de las marcas a través de cada uno de los pases con los cuatro marcadores fue muy heterogéneo, en la mayoría de los casos fue citoplasmático (GFAP y S-100), aunque eventualmente se observó expresión en el núcleo (p53). En la Foto 3
se ven células positivas con los diferentes marcadores, con anti-GFAP (3A) mediante inmunoperoxidasa indirecta y por inmunofluorescencia indirecta en el primer pase (3B) donde se aprecia el patrón filamentoso característico, anti-S-100 (3C), anti-p53 en el segundo pase (3D) donde se muestra una marca celular tenue, anti-p53 en el sexto pase de cultivo (3E) con una marcación intensa, anti-Bcl-2 en el tercer pase (3F) y sexto pase con marcación intensa (3G).
Respecto a la frecuencia de la expresión, se hizo un recuento de las células inmuno-reactivas y no inmuno-reactivas para los diferentes marcadores; los datos se presentan como proporciones en la Gráfica 1. Para GFAP se evidenció 79% de expresión en el primer pase; 96.3% en el segundo; 82% en el tercero; y 100% en el sexto pase (Gráfica 1, diamantes). Para S-100 se encontró 77.3% de expresión en el primer pase; 81% en el segundo; 96% en el tercero; y 94% en el sexto pase (Gráfica 1, círculos). A medida que las células se diferenciaban, se evidenció mayor expresión de los marcadores gliales. En caso contrario, para p53 no se encontró expresión en el primer pase, para los pases segundo y tercero se encontró una baja expresión, con una marca tenue sólo en el citoplasma (21 % fueron positivas) y en el sexto pase se apreció 95.3% de expresión que comprometía tanto el citoplasma como el núcleo (Gráfica 1, cuadrados). Para Bcl-2 en los pases primero y sexto, se vio que todas las células eran positivas (100%), en el segundo 90.3%, y en el tercer pase sólo 8.4% de las células fueron positivas (Gráfica 1, triángulos); esto puso de manifiesto un proceso de indiferenciación celular.
Análisis citogenético. Las diferentes mitosis estudiadas a partir de los cultivos primarios se caracterizaron por ser en su mayoría aneuploides con un número modal cromosómico entre 43 y 45, siendo la más frecuente la monosomía del cromosoma Y (45, X, -Y) como se aprecia en la Foto 4A. Se observó un gran número de poliploidias (55-102 <4n>, XXYY) (Foto 4 C-D) y endo-reduplicaciones (end 45, X, -Y) (Foto 4B).
DISCUSIÓN
Muchos de los progresos conseguidos en oncogénesis, desarrollo y respuesta a la terapia de los tumores cerebrales han sido posibles gracias a estudios in vitro, como las técnicas de cálculo de la cinética celular en gliomas, la comprensión de las interacciones entre células gliales, neuronas, células endoteliales y tumorales, o la identificación de los mecanismos celulares implicados en la resistencia a ciertos medicamentos18. Un paso imprescindible en el estudio de los cultivos de tumores cerebrales es caracterizar las células de los cultivos resultantes4. Habitualmente las técnicas de citomorfología e inmunohistoquímica son las más empleadas, aunque las pueden complementar métodos como la hibridación in situ, la histoquímica enzimática y la microscopía electrónica18,19.
Las líneas celulares y los cultivos primarios, son una herramienta indispensable para investigar la biología de los tumores cerebrales. Por tanto, en este estudio se quiso establecer una línea celular inmortalizada a partir de un tejido obtenido de un paciente diagnosticado clínicamente con GBM. Mediante el análisis histopatológico se encontró tanto proliferación microvascular como necrosis, rasgos diagnósticos esenciales, que confirman las características de GBM de acuerdo con la clasificación WHO2,25.
En cuanto a la caracterización celular, se encontró en los cultivos primarios una migración de las células, que se disponen inicialmente en forma radial con células bipolares y unipolares de gran tamaño, para luego transformarse con rapidez en elementos fibroblastoides, un patrón celular característico en estos cultivos que concuerda con estudios anteriores20-22. En pases posteriores (pase 30) al hacer la caracterización morfológica se halló un fenotipo estable a través del tiempo, con un predominio de células unipolares y bipolares.
Mediante el análisis inmunocitoquímico se encontró que los cultivos retuvieron la expresión para S-10020,23 y GFAP, que es un marcador específico para células astrocíticas20-22. La inmuno-reactividad encontrada con estos dos marcadores gliales en los cultivos en los diferentes pasajes, permitió establecer que la expresión fue progresiva y que el fenotipo se mantuvo a través de los pases analizados, los datos concuerdan con la expresión que se evidenció mediante el análisis por inmunohistoquímica.
Y a su vez se evaluó la expresión de p53 y Bcl-2, como moduladores de apoptosis, pues se cree que defectos en la vía que regulan la susceptibilidad a la apoptosis están comprometidos en el desarrollo y progresión en la malignidad de los gliomas. Rieger et al.6 encontraron 70% de incidencia de reacciones positivas para Bcl-2. Stirket et al.12 revelaron un alto porcentaje de reacción positiva para Bcl-2 en glioblastoma tanto recurrentes como iniciales (92% y 97%, respectivamente) y Krajewski et al.10 comunicaron 92% de expresión para Bcl-2. Estos datos concuerdan con los resultados obtenidos en los cultivos analizados para la expresión de Bcl-2 mediante inmunocitoquímica, en los cuales se vio un alto porcentaje de células positivas en tres de los cuatro pases analizados.
En contraste, para p53 no se halló expresión en los primeros pases de cultivo. Se ha encontrado que la mutación o inactivación de p53 ocurre en etapas tempranas en los gliomas y se asocia con la progresión del tumor. Muchos tumores, incluso glioblastomas multiformes de alto-grado, llevan un gen de p53 funcionalmente intacto24. En el sexto pase hubo alta expresión de p53, esto es explicable porque un alto porcentaje de inmunopositividad a través de los diversos pases sugiere que este tipo de cultivo exhibe una alta tasa de mutaciones para p53. A su vez, p53 se encontró a nivel citoplasmático; este fenómeno se propuso como un mecanismo por el cual la función de p53 es abolida. Es posible que un aumento en la frecuencia nuclear de la sobreexpresión de p53 silvestre25 sea un signo de anormalidades de otros componentes de la vía para p53, pues con frecuencia se sobre-expresa p53 en astrocitomas humanos de todos los grados, mientras que en mucho otros tipos de cánceres se encuentran en la mitad de los casos en estado normales. Esto sugiere un mecanismo para subvertir la apoptosis mediada por p5315.
La pérdida de inmuno-reactividad en los distintos pases de cultivo ocurre normalmente en cultivos primarios, se ha descrito que las células que mantienen las características tumorales por más tiempo son las que expresan una mayor inmuno-reactividad. De forma semejante ocurre con los marcadores de la cinética tumoral, como la bromodeoxiuridina, cuyo resultado decrece con el tiempo en las células en cultivo, e indica algún mecanismo no identificado de diferenciación in vitro, particularmente para los astrocitomas de alto grado de malignidad. Una vez que se establece una línea celular, por lo general en el pase 20 ó después de 4-6 meses in vitro, las células en los pases van adquiriendo un fenotipo estable18-22.
Todas las líneas de gliomas estudiadas hasta ahora son altamente aneuploides; además, el daño y los re-arreglos cromosómico son comunes21,26. En estudios citogenéticos llevados a cabo en glioblastomas primarios y secundarios se ha encontrado una alta frecuencia de anormalidades combinadas en los cromosomas sexuales y autonómicos, éstas incluyen trisomía del cromosoma 7, monosomía del cromosoma 10, monosomía del cromosoma X y la pérdida del cromosoma Y27,28. La línea celular establecida presentó una alta tasa de aneuploidías, siendo la más frecuente la monosomía del cromosoma Y (45, X-Y) lo que corrobora otros estudios en gliomas malignos26,27, además tuvo un gran número de poliplodías (55-102 <4n>, XXYY) y endo-reduplicaciones (end 45, X-Y), indicativos propios de la progresión tumoral.
Este estudio confirma la utilidad de los cultivos primarios y las líneas celulares derivadas a partir de tumores cerebrales, pues por medio de ello se pueden establecer diferentes estrategias experimentales y terapéuticas para el estudio de tratamientos de quimioterapia, radioterapia y terapia génica.
AGRADECIMIENTO
Los autores expresan sus agradecimientos a la Clínica El Bosque, a la División de Investigaciones de la Universidad El Bosque y a Diana Patricia Martínez del Instituto de Genética de la Universidad Nacional de Colombia.
REFERENCIAS
1. Escobar A. Gliomas y angiogénesis. Rev Mex Neuroci 2002; 3: 21-24.
2. Kleihues P, Burger PC, Collins VP, Newcomb EW, Ohgaki H, Cavenee, WK. Glioblastoma. In: Kleihues P, Cavenee WK (eds.). Pathology and genetics of tumours of the nervous system. 2nd ed. Lyon: International Agency Research on Cancer Press; 2000. p. 29-39.
3. Stark AM, Witzel P, Strege RJ, Hugo H-H, Mehdorn HM. p53, mdm2, EGFR, and msh2 expression in paired initial and recurrent glioblastoma multiforme. J Neurol Neurosurg Psychiatry 2003; 74: 779-783.
4. Louis D, Holland E, Cairncross G. Glioma classification. A molecular reappraisal. Am J Pathol 2001; 159: 779-786.
5. Muñoz J, Fan X, Inda MM, Sáez-Castresana J. Genética molecular de los astrocitomas. An Sist Sanit Navar 2000; 23: 265-278.
6. Rieger L, Weller M, Borneman A, Schabet M, Dichgans J, Meyermann R. Bcl-2 family protein expression in human malignant glioma: a clinical-pathological correlative study. J Neurol Sci 1998; 155: 68-75.
7. Rieger J, Roth W, Glaser T, Winter S, Rieger L, Dichgans J, et al. Glioblastoma multiforme: mechanisms of resistance to chemotherapy. Neurol Psychiatry Brain Res 1999; 7: 37-46.
8. Szkudlarek M, Lebelt A, Kilm B, Pawlak J, Lemancewiez D, Boguslowiez W, et al. Apoptosis phenomenon in the selected neoplasms of the glial origin. Rock Akad Med Bialynst 2004; 49 (Suppl 1): 16-18.
9. Steinbach J, Séller M. Apoptosis in gliomas: molecular mechanisms and therapeutic implications. J Neuro-Oncol 2004; 70: 245-254.
10. Krajewski S, Krajewska M, Ehrmann J, Sikorska M, Lach B, Chatten J, et al. Immunohistochemical analysis of Bcl-2, Bcl-X, Mcl-1, and Bax in tumors of central and peripheral nervous system origin. Am J Pathol 1997; 150: 805-814.
11. Tyagi D, Sharma BS, Gupta SK, Kaul D, Vasishta RK, Khosla VK. Expression of Bcl2 proto-oncogene in primary tumors of the central nervous system. Neurol India 2002; 50: 290-294.
12. Strik H, Deininger M, Streffer J, Grote E, Wickboldt J, Dichgans J, et al. BCL-2 Family protein expression in initial and recurrent glioblastomas: modulation by radiochemotherapy. J Neurol Neurosurg Psychiatry 1999; 67: 763-768.
13. Weller M, Rieger J, Grimmel C, Van Meir EG, De Dribolet N, Krajewski S, et al. Predicting chemoresistance in human malignant glioma cells: the role of molecular genetic analyses. Int J Cancer 1998; 79: 640-644.
14. Ellison DW, Gatter KG, Steart PV, Laner DP, Weller RO. Expression of the p53 protein in a spectrum of astrocytic tumours. J Pathol 1992; 168: 383-386.
15. Alderson L, Castleberg R, Harsh G, Louis D, Henson J. Human gliomas with wild-type p53 express Bcl-2. Cancer Res 1995; 55: 999-1001.
16. Shu HK, Kim M, Chen P, Furman F, Julin C. The intrinsic radioresistance of glioblastoma-derived cell lines is associated with failure of p53 to induce p21BAX expression. Proc Natl Acad Sci USA 1998; 95: 14453-14458.
17. Gómez-Manzano C, Fueyo J, Kyritsis A, McDonnell T, Steck P, Levin V, et al. Characterization of p53 and p21 functional interactions in glioma cells en route to apoptosis. J Natl Cancer Inst 1997; 89: 1036-1044.
18. Gil-Salú J, Domínguez-Pascual I, Pérez-Requena J, Maestro-Sarrión E, Bosco J, López-Escobar M. Características citomorfológicas e inmunohistoquímicas de cultivos primarios obtenidos a partir de tumores cerebrales. Rev Esp Patol 2002; 35: 207-212.
19. Westphal M, Meissner H. Establishing human glioma-derived cell lines. In: Mather J, Barnes D (eds.). Animal cell culture methods. Methods in cell biology. Volume 57. San Diego: Academic Press; 1998. p. 147-165.
20. Machado C, Schenka A, Vasallo J, Tamashin W, Gonçalves E, Genaro S, et al. Morphological characterization of a human glioma cell line. Cancer Cell Int 2005; 5: 13-19.
21. Bigner DD, Bigner SH, Pontén J, Westermark B, Mahaley MS, Ruoslahti E, et al. Heterogeneity of genotypic and phenotypic characteristics of fifteen permanent cell lines derived from human gliomas. J Neuropathol Exp Neurol 1981; 40: 201-229.
22. Lolait S, Harper H, Auteri J, Pedersen S, Toh B. Expression of glial fibrillary acidic protein actin, fibronectin and factor VIII antigen in human astyrocytomas. Pathology 1983; 15: 373-378.
23. Zimmer D, Cornwall E, Landar E, Song W. The S100 protein family: History, function, and expression. Brain Res Bull 1995; 37: 417-429.
24. Li H, Alonso-Vanegas M, Colicos M, Jung S, Lochmuller H, Sadikot A, et al. Intracerebral adenovirus-mediated p53 tumor suppressor gene therapy for experimental human glioma. Clin Cancer Res 1999; 5: 637-642.
25. Burton E, Lamborn K, Forsyth P, Scott J, O’Campo J, Uyehara-Lock J, et al. Aberrant p53, mdm2 and proliferation differ in glioblastoma from long-term compared with typical survivors. Clin Cancer Res 2002; 8: 180-187.
26. Nuki Y, Uchinokura S, Miyata S, Fukushima T, Hamasuna R, Nakano S, et al. Establishment and characterization of a new human glioblastoma cell line, NYGM. Hum Cell 2004; 17:145-150.
27. Thiel G, Losanowa T, Kintzel D, Nisch G, Martin H, Vorpahl K, et al. Karyotypes in 90 human gliomas. Cancer Genet Cytogenet 1992; 58: 109-120.
28. Amalfitano G, Chatel M, Paquis P, Michiels JF. Fluorescence in situ hybridization study of aneuploidy of chromosomes 7, 10, X, and Y in primary and secondary glioblastomas. Cancer Genet Cytogenet 2000; 116: 6-9.
29. Bancroft J, Gamble M. Theory and practice of histological techniques. 5th ed. Edinburgh: Churchill Livingstone; 2002. p 796.