Frecuencia de la mutación F508del en estudiantes de la Facultad de Medicina de la Universidad del Rosario, Bogotá, Colombia
Heidi Eliana Mateus, M.D., M.Sc.1, Dora Janeth Fonseca, Biol., M.Sc.1, Lina S. Sánchez2, Iván F. Peñaloza2, Diana V. Forero2, Pamela A. Perdomo2, Diana C. Quiasua2, Alexander Ramírez2, Laura C. Montoya2; Luis A. Pérez2, Hilda P. Amado2, Jorge A. Molano2, Sergio A. Amaya2, María H. Durán2, Vanesa C. Cárdenas2, Karen Guevara2, Diego A. Parga2, Claudia L. Esparrogosa2
1. Profesora Principal, Unidad de Genética, Facultad de Medicina, Universidad del Rosario, Bogotá, Colombia.
e-mail: hmateus@urosario.edu.co e-mail: dfonseca@urosario.edu.co
2. Estudiante, Facultad de Medicina, Universidad del Rosario, Bogotá, Colombia.
Recibido para publicación enero 19, 2007 Aceptado para publicación octubre 8, 2007
RESUMEN
Introducción: La fibrosis quística es la enfermedad letal autosómica recesiva más frecuente en caucásicos, donde su incidencia es de 1 en 2000 nacidos vivos. Se debe a mutaciones en el gen CFTR, de las cuales la más frecuente es la F508del presente en 66% de los enfermos y en 1 de cada 25 personas sanas de origen caucásico.
Objetivo: Identificar la tasa de portadores de la mutación F508del en una muestra de estudiantes de la Facultad de Medicina de la Universidad del Rosario.
Materiales y métodos: Se determinó la presencia de la mutación F508del mediante PCR y análisis de heterodúplex en 110 estudiantes de IV y VII semestre de la Facultad de Medicina.
Resultados: Se obtuvieron 4 heterocigotos para la mutación F508del, es decir, una frecuencia de portadores de 1 en 27 estudiantes.
Conclusiones: La frecuencia de portadores de esta mutación en la población analizada es considerable, e indica que hay un alto número de personas en riesgo de heredar la enfermedad y que deben recibir asesoramiento genético. Es necesario aumentar el tamaño de la muestra para obtener datos representativos de la población colombiana.
Palabras clave: Fibrosis quística; delta F508; Portadores; Colombia.
Carrier frequency of F508del mutation of cystic fibrosis in medical students from Universidad del Rosario, Bogotá, Colombia
SUMMARY
Introduction: Cystic fibrosis (CF) is the most frequent autosomical recessive disorder in Caucasian population with an incidence of 1 in 2000 newborns. The disease is caused by mutations in the cftr gene, but the most common mutation is F508del, which accounts for 66% of CF chromosomes worldwide and a carrier frequency for Caucasian population of 1 in 25.
Objective: To determine the carrier frequency of the F508del mutation in 110 unrelated, healthy students from the Facultad de Medicina, Universidad del Rosario.
Methods: The presence of F508del mutation using PCR and heteroduplex analysis was determined.
Results: Only four heterozygotes for F508del mutation were discovered. This represents a carrier frequency of 1 in 27 students.
Conclusions: This estimated frequency of F508del carriers is higher than expected, encouraging further screening in normal control individuals from different regions of Colombia.
Keyword: Cystic fibrosis; deltaF508; Carrier; Colombia.
La fibrosis quística (FQ) es la enfermedad autosómica recesiva más frecuente en la población caucásica, se caracteriza por una tríada clásica de enfermedad pulmonar obstructiva crónica, alteración en la porción exocrina del páncreas y elevación de las pruebas de electrólitos en sudor. Se debe a mutaciones en el gen CFTR (por las siglas en inglés regulador de la conductancia transmembranal de la fibrosis quística), localizado en 7q31.21. Hasta la fecha se han descrito más de 1500 mutaciones en este gen, dentro de las cuales la más común a nivel mundial es la F508del, presente en 66% de quienes sufren esta entidad2.
Aunque la incidencia varía según el origen étnico de la población, es más alta en caucásicos, donde oscila de 1 en 800 a 1 en 2,000 nacidos vivos, mientras que para poblaciones negroides o asiáticas está entre 1/40,000 y 1/100,000, respectivamente3. En Latinoamérica, los estudios realizados muestran que la incidencia de la FQ oscila entre 1 en 8,500 para la población de México4 y 1 en 3,862 para Cuba5.
La frecuencia de la mutación F508del también presenta variaciones considerables de acuerdo con la población analizada, desde 27% en Turquía6 hasta 87%, en Dinamarca7. Los estudios en Colombia indican una frecuencia que oscila entre 39% y 48%8,9 con una marcada variación según los departamentos, desde 25% en Bolívar, hasta 66% en Santander9.
En artículos colombianos previos, se ha encontrado una frecuencia de portadores sanos de la mutación F508del que oscila entre 1/65 y 1/799,10, cifras que justifican nuevos estudios poblacionales con un número de personas que sea representativo para el país.
La importancia de identificar los portadores sanos que se encuentran en riesgo de transmitir la enfermedad, radica en poder ofrecer un adecuado asesoramiento genético que les permita optar por opciones reproductivas conducentes a prevenir la aparición de nuevos casos o al tratamiento temprano de los afectados, y se justifica por el alto impacto económico y social que representa para una familia un hijo con FQ. El costo del tratamiento básico de un niño con FQ para el Sistema de Salud, se calculó en Estados Unidos como $10,000 dólares/año, suma que asciende a $40,000 dólares, si se tiene en cuenta el valor de las repetidas hospitalizaciones. Si se considera que un diagnóstico de portadores tiene un precio que oscila entre $50 y $150 dólares, es claro el beneficio que trae identificar estas personas, más aún si esta acción primaria repercute en bajar la incidencia de la enfermedad lo que disminuiría hasta en 90% los costos para el sistema de seguridad social de un país11,12.
El objetivo de este estudio es determinar la frecuencia de portadores de la mutación F508del en estudiantes de la Facultad de Medicina, Universidad del Rosario a quienes se les brindará el asesoramiento genético indicado.
MATERIALES Y MÉTODOS
Muestras analizadas. La muestra se tomó al azar en estudiantes de los semestres IV y VII matriculados en el II semestre del 2006, en las materias Genética Básica y Clínica, respectivamente y pertenecientes a la Facultad de Medicina de la Universidad del Rosario. Estos estudiantes aceptaron en forma voluntaria participar en la investigación, y diligenciaron el consentimiento informado respectivo. Se excluyeron quienes tenían antecedentes personales o familiares sugestivos de FQ. Se tomó una población total de 140 estudiantes inscritos en estos semestres y al considerar como base la frecuencia de portadores descrita para Colombia por Keyeux9, de 1/65 se calculó un tamaño de muestra de 110 personas con el programa Epi-Info versión 6 (intervalo de confianza: 95%).
Métodos. Se obtuvo el ADN por técnicas convencionales. Tanto la cantidad como la calidad del ADN, se verificaron mediante visualización en geles de agarosa al 1.2% teñidos con bromuro de etidio.
Las muestras de ADN se amplificaron con la reacción en cadena de polimerasa (PCR) con primers específicos, se prepararon mezclas de reacción (amortiguador de PCR 1X, MgCl2, 1.5 mM, deoxinucleótidos trifosfato 0.04 mM, 1U Taq ADN polimerasa, primers 0.5 pmol/µl y 100 ng de ADN). En cada montaje de PCR se incluyó como control positivo un ADN heterocigoto para la mutación F508del. Los productos de PCR se corrieron en geles de poliacrilamida al 10% y se visualizaron mediante tinción con bromuro de etidio, según las condiciones ya descritas por Jay et al.10
Los estudiantes portadores se verificaron y se sometieron al análisis de heterodúplex. La frecuencia de portadores se determinó mediante recuento directo y se comparó con estudios previos de Colombia y de otros países del mundo por medio de la prueba exacta de Fisher (p<0.05).
RESULTADOS
Se analizaron 110 estudiantes de IV y VII semestre de la Facultad de Medicina, 71 mujeres (64.5%) y 39 hombres (35.5%), con edades que oscilaban entre 18 y 25 años con un promedio de 21.4 años, en su mayoría (71%) originarios de la ciudad de Bogotá y provenientes de estratos socio-económicos alto y medio-alto (93.6%).
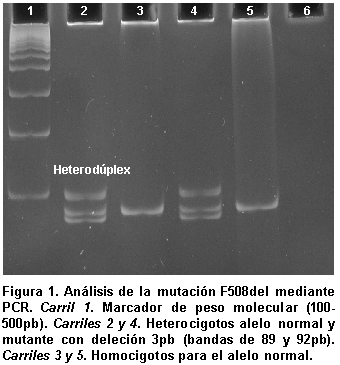
En los geles de electroforesis, la presencia de una banda de 92pb indicaba un homocigoto normal, mientras que las bandas de 89pb y 92pb correspondían a un presunto portador de la mutación F508del (Figura 1).
Las muestras de los portadores se confirmaron con la técnica de heterodúplex, la cual permite diferenciar las mutaciones F508del y I507del, que tienen el mismo peso molecular por corresponder ambas a una deleción de tres bases. El fundamento de este análisis es la formación de bandas de migración lenta, producto de interacciones no covalentes entre hebras de ADN no totalmente complementarias. La confirmación de portador para la mutación de F508del se realiza ante la presencia de 3 bandas, que corresponden al alelo normal (92pb), al alelo mutado (89pb) y al heterodúplex de peso molecular superior al alelo normal, formado por el apareamiento entre la hebra normal y la mutante F508del (Figura 2), mientras que si el paciente es portador de la mutación I507del aparecerá una banda adicional producto del heterodúplex formado por las dos hebras mutantes diferentes (F508del e I507del).
Luego del análisis de la mutación F508del se confirmó el resultado en las 4 personas portadoras, que indica una frecuencia de 1 en 27 estudiantes.
Se compararon los datos con otros estudios a nivel nacional9,10, sin encontrar diferencias estadísticamente significativas (p>0.05). Al analizar varios informes internacionales hubo diferencia con las poblaciones de Israel13, India14, Uruguay15 y judíos ashkenazi16 (p<0.05), mientras que en relación con los resultados en poblaciones de Chile17,18, Argentina19, Estados Unidos20, afroamericanos21, Polonia22 y Malasia23, los datos no mostraron diferencias significativas (p>0.05) (Cuadro 1).
A quienes resultaron portadores de la mutación se les dio un asesoramiento genético consistente en explicar la enfermedad, el riesgo de tener hijos afectados, los estudios que deben realizar a sus parejas, así como las opciones reproductivas indicadas si se tiene en cuenta el carácter autosómico recesivo de la FQ.
DISCUSIÓN
La FQ es una enfermedad de herencia autosómica recesiva, con una morbimortalidad alta en todo el mundo; la mutación que se le asocia con más frecuencia en casi todas las poblaciones analizadas, incluyendo a Colombia, es la F508del, que corresponde a una deleción de tres pares de bases (CTT) en el exón 10 de donde resulta la pérdida de una fenilalanina en la posición 508 de la proteína1.
En diversas poblaciones del mundo se ha establecido la tasa de portadores de mutaciones causantes de FQ, a fin de identificar personas y parejas en riesgo de tener hijos afectados, y con el asesoramiento genético permite disminuir la aparición de nuevos casos hasta en 65%12.
En Colombia, la mutación F508del es la más común en personas afectadas. Los resultados al analizar un grupo de estudiantes sanos de IV y VII semestre de la Facultad, revelan una frecuencia de portadores de 1 en 27 (3.6%), e indican que una de cada 729 parejas formadas por estos estudiantes, muestra un riesgo de 25% de tener hijos con FQ. Esta tasa es muy similar a la descrita para poblaciones de origen europeo. Los resultados de portadores para esta población estudiantil no presentan diferencia significativa con otros informes colombianos, que han indicado frecuencias de portadores de 1/65 y 1/799,10 (Cuadro 1).
Al comparar los datos obtenidos con los de otros países latinoamericanos como Argentina19 y Chile17,18 no se encontró una diferencia significativa (Cuadro 1). Estos países han tenido una fuerte influencia europea, donde se presentan las más altas frecuencias de la mutación estudiada; la población chilena, corresponde a Valparaíso, que por su condición de puerto, fue una de las principales entradas para los colonos europeos, inmigrantes que posiblemente introdujeron la mutación a esta zona de ese país17. En el presente estudio, casi todos los participantes eran originarios de Bogotá (71%), ciudad que ha sido desde la década de 1950 uno de los principales sitios de ingreso para los inmigrantes al país, quienes pueden proceder de zonas de mayor influencia caucásica. Esto podría explicar la relativa alta frecuencia de portadores de la mutación F508del encontrada en el estudio. Sin embargo, como la muestra es significativa sólo para la población estudiada, estos datos no se pueden extrapolar para la población bogotana. Con el objeto de confirmar esta hipótesis, se deben realizar estudios más grandes que sean representativos de los habitantes de la ciudad de Bogotá. Al comparar con otras poblaciones como Israel13, India14, Uruguay15 y judíos ashkenazi16 hubo diferencias significativas, dadas sobre todo por la composición étnica de cada población; así en los israelitas, la mutación F508del no es la más frecuentemente asociada con la enfermedad, lo que determina que en esta población la frecuencia de portadores de la deleción sea muy baja. Respecto a la población uruguaya, se esperaría una tasa de portadores de F508del similar a la que se informa en este trabajo y a la de la población argentina, por la fuerte influencia europea en ese país15.
La mutación F508del está presente en 41.3% de los pacientes colombianos afectados por FQ24, mientras que el 57% restante tiene mutaciones distintas a esta, por tanto si se tiene en cuenta que el dato de 3.6% de portadores sólo corresponde a la mutación F508del, este valor representaría apenas 41.3% del número total de portadores de FQ. Si se incluyera el 100% de las mutaciones que causan la enfermedad. la frecuencia total de portadores esperada sería de 8.9%.
La relativa alta frecuencia de portadores que se encontró en esta muestra pequeña de estudiantes, muy similar a la informada para caucásicos, donde la incidencia de la enfermedad es mucho mayor que en otro tipo de poblaciones, justifica más estudios complementarios que sean representativos de cada una de las regiones geográficas de Colombia, y que permitan obtener conclusiones acerca de la tasa real de portadores para cada población y una aproximación para determinar la cifra verdadera en la población del país.
Este trabajo fue realizado por estudiantes de IV semestre de la Facultad de Medicina de la Universidad del Rosario como proyecto de investigación de la cátedra de Genética Básica.
REFERENCIAS
1. Welsh NJ, L-Tsui L, Boat TF, Beaudet AL. Cystic fibrosis. En: Scriver CR, Beaudet Al, Sly WS, Valle D (eds.). The metabolic and molecular bases of inherited diseases. New York: McGraw-Hill; 1995. p. 3799-3876.
2. Cystic fibrosis genetics analysis consortium. Population variation of common cystic fibrosis mutations. Hum Mutat 1994; 4: 167-177.
3. World Health Organization. The molecular genetic epidemiology of cystic fibrosis. Report of a joint meeting of WHO/ECFTN/ICF(M)A/ECFS. Genoa, Italy, 19 June 2002.
4. Orozco L, Velásquez R, Zielenski J, Tsui LC, Chávez M, Lezana JL, et al. Spectrum of CFTR mutations in Mexican cystic fibrosis patients: identification of five novel mutations (W1098C, 849delT, P750L, 4160insGGGG and 297-1G>A). Hum Genet 2000; 106: 360-365.
5. Collazo T, Magarino C, Chávez R, Suardiaz B, Gispert S, Gómez M, et al. Frequency of delta-F508 mutation and XV2C/KM19 haplotypes in Cuban cystic fibrosis families. Hum Hered 1995; 45: 55-57.
6. Hundrieser J, Bremer S, Peinemann F, Stuhrmann N, Hoffkencht N, Wulf B, et al. Frequency of the F508 deletion in the CFTR gene in Turkish cystic fibrosis patients. Hum Genet 1990; 85: 409-410.
7. Schwartz M, Johansen HK, Koch C, Brandt N. Frequency of the delF508 mutation on cystic fibrosis chromosomes in Denmark. Hum Genet 1990; 85: 427-428.
8. Restrepo C, Pineda L, Rojas-Martínez A, Gutiérrez C, Morales A, Gómez Y, et al. CFTR mutations in three Latin American countries. Am J Med Genet 2000; 91: 277-279.
9. Keyeux G, Rodas C, Bienvenu T, Garavito P, Vidaud D, Sánchez D, et al. CFTR mutations in patients from Colombia: implications for local and regional molecular diagnosis programs. Hum Mutat 2003; 22: 259.
10. Jay L, Mateus H, Fonseca D, Restrepo CM, Keyeux G. PCR-heterodúplex por agrupamiento: Implementación de un método de identificación de portadores de la mutación más común causal de fibrosis quística en Colombia. Colomb Med 2006; 37: 176-182.
11. Goodman DM, Méndez E, Throop C, Ogata ES. Adult survivors of pediatric illness: the impact on pediatric hospitals. Pediatrics 2002; 110: 583-589.
12. Simpson N, Anderson R, Sassi F, Pitman A, Lewis P, Tu K, et al. The cost-effectiveness of neonatal screening for cystic fibrosis: an analysis of alternative scenarios using a decision model. Cost Eff Resour Alloc 2005; 9: 3-8..
13. Chiba-Falek O, Nissim-Rafinia M, Argaman Z, Genem A, Moran I, Kerem E, et al. Screening of CFTR mutations in an isolated population: identification of carriers and patients. Eur J Hum Genet 1998; 6: 181-184..
14. Kapoor V, Shastri SS, Kabra M, Kabra SK, Ramachandran V, Arora S, et al. Carrier frequency of F508del mutation of cystic fibrosis in Indian population. J Cyst Fibros 2006; 5: 43-46
15. Cardoso H, Crispino B, Mimbacas A, Cardoso ME. A low prevalence of cystic fibrosis in Uruguayans of mainly European descent. Genet Mol Res 2004; 30: 258-263.
16. Kornreich R, Ekstein J, Edelmann L, Desnick RJ. Premarital and prenatal screening for cystic fibrosis: experience in the Ashkenazi Jewish population. Genet Med 2004; 6: 415-420.
17. Vera A, Henríquez-Roldán CF, González FJ, Molina G. Screening of the delta-F508 mutation and analysis of two single nucleotide polymorphism of the CFTR gene, in a sample of the general population of Valparaíso, Chile. Rev Med Chil 2005; 133: 767-775.
18. Valenzuela C. Genética de la fibrosis quística. Rev Chil Pediatr 1988; 31: 218-219.
19. Roqué M, Godoy CP, Castellanos M, Pusiol E, Mayorga LS. Population screening of F508del (DeltaF508), the most frequent mutation in the CFTR gene associated with cystic fibrosis in Argentina. Hum Mutat 2001; 18: 167.
20. Raskin S, Pereira-Ferrari L, Caldeira Reis F, Abreu F, Marostica P, Rozov T, et al. Incidence of cystic fibrosis in five different states of Brazil as determined by screening of p.F508del, mutation at the CFTR gene in newborns and patients. J Cyst Fibros 2007.
21. Dacus J, Mabie B, Gailey T, Rogers C, Likes C, Metcalf L. Cystic fibrosis screening at the Greenville Hospital System. J S C Med Assoc 2006; 102: 14-16.
22. Padoa C, Goldman A, Jenkins T, Ramsay M. Cystic fibrosis carrier frequencies in populations of African origin. J Med Genet 1999; 36: 41-44.
23. Skrzypczak U, Rutkiewicz E, Pogorzelski A, Witt M, Zietkiewicz E. Carrier status for 3 most frequent CFTR mutations in Polish PCD/KS patients: lack of association with the primary ciliary dyskinesia phenotype. J Appl Genet 2007; 48: 85-88.
24. Zilfalil BA, Sarina S, Liza-Sharmini AT, Oldfield NJ, Stenhouse SA. Detection of F508del mutation in cystic fibrosis transmembrane conductance regulator gene mutation among Malays. Singapore Med 2006; 47: 129-133.
25. Pérez MM, Luna MC, Pivetta OH, Keyeux G. CFTR gene analysis in Latin American CF patients: heterogeneous origin and distribution of mutations across the continent. J Cyst Fibros 2007; 6: 194-208.