Hemólisis inducida por el ejercicio: relación entre el nivel de actividad de la glucosa-6-fosfato deshidrogenasa y el grado de hemólisis
Javier F. Bonilla, MD, MSc1, Fernando Palomino, MD2
1. Profesor Asistente, Facultad de Medicina y Rehabilitación, Universidad del Rosario, Bogotá, DC, Colombia.
e-mail: jfbonill@urosario.edu.co
2. Profesor Asistente, Facultad de Medicina, División de Fisiología, Universidad Nacional de Colombia, Bogotá DC, Colombia.
e-mail: lfpalominoq@unal.edu.co
Recibido para publicación junio 1, 2007 Aceptado para publicación abril 18, 2008
RESUMEN
Introducción: La oxidación, al igual que la hemólisis asociadas con el ejercicio tanto moderado como extenuante han sido condiciones objeto de múltiples estudios, pero sólo en algunos recientes se evaluó cómo las variaciones en la capacidad de los mecanismos antioxidantes enzimáticos eritrocitarios específicos y genéticamente determinados, condicionan distintos grados de susceptibilidad a la hemólisis inducida por el ejercicio, pero esos trabajos se han hecho sobre todo en individuos no sedentarios y con deficiencia franca de la enzima G6PD.
Objetivo: El propósito de este trabajo fue determinar si existe o no relación entre el nivel de actividad de la enzima eritrocitaria G6PD y el grado de hemólisis inducida por el ejercicio en hombres adultos sedentarios en apariencia sanos, luego de un tiempo experimental de ejercicio moderado pre-extenuante y equivalente en modalidad y magnitud.
Metodología: Se evaluaron 25 voluntarios hombres, sedentarios, en apariencia sanos; se les aplicó una sesión de ejercicio, sobre un cicloergómetro, de una hora de duración, a 70% del VO2pico previamente hallado. Sobre la base de la concentración de hemoglobina plasmática se calculó el porcentaje de hemólisis y la haptoglobina consumida, tomando en cuenta la variación en el plasma de la haptoglobina y la hemólisis intravascular inmediatamente después y hasta tres horas luego del ejercicio.
Resultados: Se pudo determinar que los individuos presentaron, con base en la determinación de Hb plasmática libre, % de hemólisis y consumo de haptoglobina, hemólisis intravascular durante y hasta por lo menos tres horas post-ejercicio.
Conclusiones: La magnitud de la hemólisis presentada, por un lado, tuvo una relación inversa significativa con la actividad de la G6PD, y por otro, que tal magnitud tuvo un comportamiento significativamente distinto por debajo del percentil 40 de la actividad hallada para G6PD y por encima de la misma, o sea, la respuesta hemolítica oxidativa en individuos sedentarios sanos con niveles más bajos de actividad de G6PD frente a una sesión de ejercicio a 70% del VO2pico presenta una gran variabilidad.
Palabras clave: Hemólisis intravascular; Estrés oxidativo; Ejercicio (exhaustivo); G6PD, Haptoglobina; Hemoglobina plasmática.
Exercise induced hemolysis: relation between the activity of glucose-6-phosphate dehydrogenase and the magnitude of the hemolysis
SUMMARY
Introduction: Oxidation and hemolysis associated with physical exercise, moderate and severe, have been studied by several investigations, but only in the most recent have been evaluated how the variations of the genetic determined mechanisms for antioxidative enzymatic erytrocytic capacity, contribute to establish different levels of susceptibility to the hemolysis induced trough exercise, however, those studies have mainly been made on non sedentary subjects with deficiency of enzyme G6PD.
Purpose: The objective of this study was to establish if there is either yes or not a relationship between the activity level of erythrocytic activity of the enzyme G6PD and the hemolysis grade, induced by exercise in adult healthy sedentary men and after an experimental bout of moderate exercise pre-exhaustive and equivalent in modality and intensity.
Methods: Twenty five men, sedentary and seemingly healthy, were evaluated after an exercise session of 1 hour over a cycloergometer, with 70% of VO2peak previously founded. On the basis of plasmatic Hb, the proportion of hemolysis and haptoglobin consumed, taking in account the variation of plasma haptoglobin and intravascular hemolysis after and at least three hours post-exercise, were calculated.
Results: The experimental subjects presented laboratory evidence (free plasma hemoglobin, percentage of hemolysis and haptoglobin) of intravascular hemolysis immediately after and at least past three hours of exercise bouts.
Conclusion: The grade of hemolysis had an inversely significative correlation with the G6PD activity and, this intensity had a significative different behaviour below the percentil 40 media founded for G6PD and above of it. Thus, the oxidative hemolytic response in sedentary and healthy individuals who had lower levels G6PD activity with one bout of exercise with 70% of VO2peak was highly variable.
Keywords: Intravascular hemolysis; Oxidative stress; (Exhaustive) Exercise; G6PD, Haptoglobin; Plasmatic hemoglobin.
Se ha reconocido al ejercicio aeróbico moderado o intenso como productor de hemólisis intravascular1, que presenta una gran variación individual y está influida por la duración y tipo de actividad física, así como por el grado de entrenamiento, y probablemente por la administración de antioxidantes inespecíficos2-4. Se han postulado mecanismos para explicar la hemólisis por ejercicio: efecto mecánico, temperatura, cambios osmóticos y quizá estrés oxidativo5.
Durante el ejercicio aeróbico, principalmente extenuante se producen radicales libres de oxígeno (ROS) y de nitrógeno (RNS)6, así como fenómenos oxidativos asociados con ellos (estrés oxidativo)7. Al parecer, el entrenamiento físico aumenta la capacidad de los mecanismos antioxidantes del organismo8. Los eritrocitos sometidos a la acción de ROS experimentan fenómenos oxidativos que pueden llevar a hemólisis9, 10. La defensa antioxidante del eritrocito es limitada y dependiente del poder reductor del NADPH + H+; los niveles intracelulares de éste último, dependen en gran medida de la reacción catalizada por la glucosa 6-fosfato deshidrogenasa (G6PD)11.
La actividad eritrocitaria de la G6PD varía ampliamente entre los individuos de una población dada, especialmente en hombres, debido a su estado hemicigótico para el gen de la G6PD. Se han descrito multitud de alelos para este gen que determinan la producción de variantes de la enzima con diversos grados de actividad12. Los eritrocitos seriamente deficientes en sus mecanismos de defensa antioxidante son altamente susceptibles a la hemólisis (medicamentos, vegetales, etc.), como se ejemplifica en las deficiencias severas de G6PD (anemia hemolítica crónica/crisis hemolíticas)13.
A la fecha se encuentran pocos trabajos donde se evidencia como variaciones en la capacidad de los mecanismos antioxidantes enzimáticos eritrocitarios específicos y genéticamente determinados, condicionan diferentes grados de susceptibilidad a la hemólisis inducida por el ejercicio, ejemplo de ello están los trabajos donde se evaluó la respuesta al estrés oxidativo por el ejercicio en individuos que tenían deficiencia de G6PD14, 15. Se planteó entonces la pregunta de si diferentes grados de actividad de la G6PD eritrocitaria condicionarán diferentes magnitudes de hemólisis intravascular asociada con el ejercicio en individuos sedentarios que súbitamente se enfrentan con un evento de actividad física intensa.
METODOLOGÍA
El trabajo se desarrolló en el Laboratorio de Fisiología del Eritrocito de la Facultad de Medicina de la Universidad Nacional en Bogotá (Colombia), en 2 fases. La primera: selección e incorporación de los voluntarios, la segunda: aplicación del protocolo experimental y el análisis de los resultados. Los participantes: hombres saludables entre 18 y 40 años de edad, residentes a la altura de Bogotá, (2,600 metros snm) y sin haber cambiado de residencia en los últimos 3 meses. El Comité de Ética de la Facultad de Medicina de la Universidad Nacional de Colombia, aprobó el protocolo. Para la incorporación firmaron el consentimiento informado de acuerdo con la normatividad legal vigente16 y respondieron NO en el formulario de autoexclusión. Se les aplicó la prueba International Physical Activity Questionnaire (IPAQ) para seleccionar los que tuvieran actividad física baja17. Posteriormente fueron sometidos a evaluación médica y paraclínica básica (hemograma, uroanálisis, creatinina, velocidad de sedimentación globular, glutámico oxalacético transaminasa, glicemia, nitrógeno ureico en sangre).
En la segunda fase se aplicó la prueba de Åstrand y Ryhming para evaluación de capacidad aeróbica y hallar su VO2pico. Una semana después se desarrolló un protocolo de actividad física (pedaleo en cicla ergométrica por una hora) a 70% del VO2pico hallado previamente, con monitoreo electrocardiográfico continuo durante la prueba (Electrocardiógrafo Quinton®).
A cada uno de los participantes se les tomaron muestras de sangre inmediatamente antes de comenzar la sesión de ejercicio, una vez terminada y después. Se determinaron estos parámetros: G6PD (solamente pre-ejercicio), haptoglobina (Hp), hemoglobina (Hb) plasmática, Hb total y albúmina.
Para hallar la actividad de G6PD eritrocitaria se utilizó la técnica cuantitativa, y se calculó la cantidad de NADPH formado con la medición de la absorbancia a 340 nm (Sigma-Trinity 345B). La albuminemia se midió con el método del verde de bromocresol (Biosystems, Barcelona). La hemoglobinemia mediante el método de Drabkin. La concentración de Hb plasmática libre por la técnica colorimétrica (capacidad que tiene la Hb libre para oxidar la 3, 3´, 5, 5´,-tetrametil benzidina) con un Hemocue. La concentración de haptoglobina (Hp) plasmática, a través de la técnica inmunoturbidimétrica (Orion Diagnostics 21112).
El porcentaje de hemólisis se halló con la siguiente aproximación matemática:
% de hemólisis = [Hb] plasmática / [Hb] x 100
El tipo de estudio se catalogó como experimental para evaluar la relación entre dos variables.
Se compararon las distribuciones (promedios) de las variables (Hb plasmática, % de hemólisis, Hb, albúmina, Hp) en el tiempo (antes, inmediatamente después, a la hora y a las tres horas) mediante el modelo lineal general ANOVA de medidas repetidas y se compararon entre los diversos momentos y la línea de base y entre los mismos momentos con la prueba de comparaciones múltiples de Bonferroni.
Para las correlaciones lineales en las variables cuantitativas, éstas se evaluaron antes con la prueba de normalidad de Kolmogorov Smirnov. Para variables con distribución normal se aplicó el coeficiente de correlación producto momento de Pearson y para las distribuciones distintas a la normal el coeficiente no-paramétrico de correlación de Spearman. Se utilizaron diferentes modelos de ajuste lineal; se seleccionó el modelo de mejor ajuste tomando como base: el coeficiente de correlación, de determinación con y sin ajuste, el error estándar del modelo. Se evaluó el aporte del modelo en general con un análisis de varianza y en forma especifica con la prueba t de Student para cada coeficiente (bi) y se graficó mediante un diagrama de dispersión el mejor modelo. Las pruebas estadísticas se evaluaron a un nivel de significancia de 10% (p<0.1). Para evaluar la homogeneidad de varianzas se aplicó la prueba de Levene.
RESULTADOS
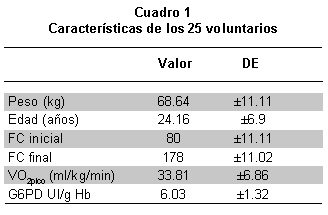
Las características de los voluntarios en cuanto peso, edad, frecuencia cardíaca inicial antes de la prueba del VO2pico y al final, así como su VO2pico y los valores de G6PD se encuentran en el Cuadro 1.
En reposo los valores para concentración de Hb estuvieron dentro de lo esperable para género, edad y altitud de residencia18, 19.
Los valores de albuminemia estuvieron dentro del rango de referencia para la técnica empleada20. Los valores de actividad de la G6PD tuvieron un rango de 3.6 a 8.31 UI/g Hb. No se encontraron individuos con deficiencia franca de la actividad de la enzima (valor menor a 10% del de referencia). Los valores para los parámetros de laboratorio se encuentran en el Cuadro 2.
Comportamiento de la Hb. Inmediatamente después del ejercicio el promedio de los valores de hemoglobinemia no fue distinto del que se encontró en reposo (p>0.05); una hora luego de terminado el ejercicio la hemoglobinemia descendió significativamente (p<0.05) para un valor promedio de 16.9 g/dl±0.62 manteniéndose en un valor promedio similar (16.9 g/dl ± 0.7) hasta tres horas luego de terminar la sesión de ejercicio.
Comportamiento de la concentración plasmática de albúmina. Inmediatamente terminado el ejercicio la cifra promedio de albuminemia fue 4.87 g/dl±0.47, valor significativamente mayor (p=0.02) al documentado en reposo; una hora después de finalizar el ejercicio, la albuminemia descendió a un valor promedio de 4.79 g/dl ± 0.38 y conservó una cifra similar (4.73 g/dl±0.43) hasta tres horas luego de terminado el ejercicio; los valores de albuminemia una y tres horas luego de ter-minado el ejercicio no son significativamente distintos del valor en reposo.
Comportamiento de la Hb plasmática y del % de hemólisis. Inmediatamente terminada la sesión de ejercicio los valores de Hb plasmática (0.048±0.031 g/dl) y el % de hemólisis (0.3%±0.2) se incrementaron de modo significante (p<0.05; p=0.001, respectivamente) con respecto a los valores de reposo. En cuanto a los valores hallados una y tres horas posteriores a la sesión de ejercicio tanto la Hb plasmática (a la hora: 0.041g/dl ± 0.021; a las tres horas: 0.042 g/dl ± 0.015) como el porcentaje de hemólisis (a la hora: 0.24%; a las tres horas: 0.25%) fueron significativamente mayores a los valores pre-ejercicio.
En cuanto a la concentración de Hp plasmática se pudo evidenciar como el valor encontrado inmediatamente después del ejercicio (1.19 ± 0.59 g/l) no difirió (p>0.05) del valor en reposo; sin embargo, a la hora sí presentó un descenso significativo con relación a los valores encontrados en reposo (1.02 ± 0.54; p<0.05) e inmediatamente terminado el ejercicio (p<0.05), de igual manera a las tres horas hizo una disminución significativa con respecto a los valores encontrados una hora después de acabar el ejercicio (p<0.05).
Se presentó una fuerte correlación inversa y significativa entre los niveles de G6PD con la concentración de Hp, tanto inmediatamente (r=-0.6; p<0.05), como a la hora (r=-0.58, p = 0.01) de haber terminado la sesión de ejercicio.
Con respecto al porcentaje de hemólisis inmediatamente después de la sesión de ejercicio hubo una correlación débil (r=-0.38, p>0.05) con la concentración de G6PD, pero una relación inversa significativa 3 horas después de haber terminado la sesión de ejercicio (r=-0.58, p=0.04) (Gráfica 1).
Fue necesario hacer una aproximación real de la concentración de Hp, pues se presentó plasmadilución post-ejercicio, y para reducir tal efecto se aplicó la siguiente relación:
Cambio pasivo en la Hp calculada =
[ ] de Hp medida ± % en el cambio de albúmina
En cuanto a los valores hallados de Hp «corregida», se pudo evidenciar que luego de finalizar el ejercicio, sus valores no fueron distintos (p>0.05) a los del reposo. Una hora después de terminar el ejercicio fue significativamente menor (p<0.05) al de reposo y al de recién terminado el ejercicio (p<0.05). Tres horas después, fue significativamente inferior al valor de reposo (p<0.05) y al valor inmediato después de acabar el ejercicio (p<0.05).
Existió una correlación negativa significativa (r=-0.65; p=0.002) entre la actividad eritrocitaria de G6PD y la [Hp] «corregida» inmediatamente después del ejercicio (Gráfica 2). Se presentó una fuerte y significante correlación negativa entre la disminución de la [Hp] «corregida» entre la finalización y una hora después (r=-0.62; p=0.001) (Gráfica 3) así como tres horas después (r=-0.50: p=0.036) de haber terminado el ejercicio con la actividad de G6PD.
Los individuos se agruparon en dos categorías en cuanto al valor de actividad de G6PD: individuos con actividad enzimática inferior a la mediana (<5.97 UI/g Hb) (Grupo A) e individuos por encima de ésta (>5.98 UI/g Hb) (Grupo B). Al calcular los respectivos promedios, desviación estándar (SD) y coeficiente de variación (CV) de estas categorías, los parámetros % de hemólisis y Hb plasmática mostraron, entre otros, un valor mayor en el grupo A en comparación con el B, inmediatamente después de terminado el ejercicio. Es de anotar que el CV para estos parámetros fue también mayor en el grupo A que en el B (84.4% vs 39.2% y 87.4% vs 37.5%, respectivamente). Al aplicar la prueba de Leven para homogeneidad de varianzas, se encontró que el grupo A presentó una varianza significativamente mayor (p<0.01) para los parámetros Hb plasmática y porcentaje de hemólisis una vez terminado el ejercicio y tres horas después; para el consumo de Hp se observó una varianza mayor de modo significante para la hora de terminado el ejercicio. Vistos en su conjunto, los datos indicadores de magnitud de hemólisis post-ejercicio correspondientes al Grupo A mostraron una dispersión mayor que en el grupo B. Esta diferencia significativa en las varianzas se mantuvo cuando los individuos se agruparon a partir del percentil 40.
Al realizar comparación de promedios en los individuos de las muestras agrupadas como arriba se mencionó, no se encontraron diferencias significativas para los parámetros porcentaje de hemólisis ni para Hp corregida, pero sí para consumo de Hp, tres horas post-ejercicio (p<0.1), siendo entonces mayor dicho consumo en los individuos con actividad de la G6PD por debajo del percentil 40.
DISCUSIÓN
En reposo la actividad promedio de la G6PD estuvo dentro del rango de referencia (4.6 a 13.5 UI/g Hb). En 3 individuos (12%) hubo una actividad enzimática por debajo del límite inferior del rango de referencia, sin haber cifras por encima. Ninguno de estos tres individuos tuvo una actividad enzimática inferior a 10% del promedio considerado normal. De acuerdo con los criterios de la OMS, los que son de la clase III o con actividad moderada, no muestran ninguna manifestación de enfermedad (anemia hemolítica crónica), pero pueden ser susceptibles a crisis hemolíticas agudas por la ingestión de medicamentos o de habas (favismo)12, 21-23.
La proporción informada en el estudio de individuos clase III (12%) se encuentra dentro de la esperable según la OMS para los hombres12.
El aumento significativo de las cifras de Hb plasmática y del porcentaje de hemólisis inmediato post-ejercicio (p<0.05) vs reposo, así como la persistencia de un valor elevado hasta por lo menos tres horas luego de terminar el ejercicio, coinciden con lo que se informó en estudios con maratonistas24, 25 y al comparar ciclistas con corredores26.
El incremento en la Hb plasmática visto en este estudio es menor que el conocido en corredores, pero mayor al que se documentó antes en ciclistas; en los trabajos que se citaron, la intensidad o la duración del ejercicio aplicado fueron superiores a los del presente estudio24-26.
Esto podría interpretarse como el reflejo que el efecto del entrenamiento deportivo tiene sobre la disminución en la susceptibilidad a la hemólisis, pues los voluntarios que participaron en el presente estudio eran sedentarios27.
En un trabajo previo con hombres sedentarios, no hubo cambios en la concentración de Hb plasmática 2 horas después de una sesión de 8 a 12 min de ejercicio exhaustivo, pero sí se observó un incremento en las 24 horas luego de terminar el ejercicio26.
Al parecer el tiempo del ejercicio puede influir la cinética de la hemólisis, que es más precoz entre mayor sea tal duración; así, en un estudio en nadadores de competencia se evidenció una relación entre el lapso del ejercicio y el grado de hemólisis intravascular28.
La Hp plasmática «sin corregir» y «corregida» no cambiaron inmediatamente después (p=0.16; p=0.436, respectivamente) con respecto al reposo, pero sí disminuyeron significativamente una y 3 horas post-pedaleo, para coincidir con lo documentado antes en otros estudios25, 26. El consumo de Hp comienza algún tiempo luego del incremento, por hemólisis intravascular, de la Hb plasmática, y persiste hasta por 72 horas o más según la duración y la intensidad del ejercicio29, 30 y quizá del grado de entrenamiento31.
Los valores de Hb y Hp plasmática, así como el porcentaje de hemólisis, indican que la hemólisis ocurrió tempranamente y siguió sucediendo hasta por lo menos 3 horas post-ejercicio.
El grupo de individuos con actividad de la enzima menor del percentil 40 en apariencia tuvo una mayor magnitud del fenómeno hemolítico post-ejercicio, a juzgar por un significativo mayor consumo de Hp; esto se acompañó de una varianza significativa mayor (p<0.01) en los individuos de este grupo para este parámetro así como para el porcentaje de hemólisis (p<0.05). Esto puede significar entonces que una menor actividad de la G6PD puede predisponer a una mayor susceptibilidad al fenómeno hemolítico sin que sea el único determinante, pues hay otros mecanismos antioxidantes en el eritrocito, así como otros factores fuera del estrés oxidativo que pueden causar la hemólisis.
La anterior aseveración también se puede sustentar con base en el análisis de correlación como se presenta en seguida:
La correlación estadística negativa tanto de la [Hb] plasmática como del porcentaje de hemólisis (p<0.05) con la actividad de G6PD, lleva a una tendencia en que los individuos con menor actividad de la enzima presenten cifras más altas de Hb plasmática y por tal motivo mayores proporciones de hemólisis en reposo, situación que no se ha informado antes.
La Hp estuvo dentro del rango de referencia aceptado (0.06 a 0.38 g/l)21. Existió una relación inversa significativa entre G6PD y [Hp] plasmática (p<0.05). En reposo los individuos con menor actividad de la enzima (que tienen a su vez mayores cifras de Hb plasmática y de proporción de hemólisis), presentaron una mayor [Hp] plasmática, situación que aparenta una paradoja. Sin embargo, se ha podido comprobar en los individuos con actividades moderadas o disminuidas de G6PD, un estado de inflamación crónica que se desencadena por una tasa sostenidamente mayor de hemólisis intravascular en reposo, sin llegar a constituir crisis hemolítica o anemia hemolítica franca.
La relación negativa y significante entre la Hb plasmática y el porcentaje de hemólisis con respecto a la actividad de G6PD (r=-0.6; p=0.008) y (r=-0.58; p=0.04), respectivamente, determinan que la magnitud del evento hemolítico producido por el ejercicio fue mayor en los individuos con una menor actividad de G6PD, relación no informada antes.
Como resultado de lo expuesto, se puede inferir que en este estudio al ser sedentarios, la mayor hemólisis que se asocia con el ejercicio aquí documentada en los individuos con menor actividad de la G6PD, es el resultado de una menor defensa ante el reto oxidativo impuesto por una sesión de ejercicio a 70% del VO2pico. Sin embargo, las diferencias estadísticamente significativas entre las varianzas de las diversas variables evaluadas a través del tiempo, en los dos grupos según los niveles de la actividad de la G6PD (prueba de Levene) determinan cómo la respuesta, hemólisis, frente a un estímulo, el ejercicio a 70% del VO2pico, puede no ser tan predecible en hombres sedentarios con actividades de G6PD por debajo de la media hallada, pues determinan que probablemente existan múltiples factores coadyuvantes favorecedores de la hemólisis oxidativa asociada con el ejercicio, mecanismos que no logran manifestarse como una hemólisis importante en los individuos «protegidos» por una actividad relativamente mayor de G6PD.
En cuanto al estrés oxidativo a la hemólisis asociada con el ejercicio, se ha mencionado en trabajos previos que el evento mecánico es el principal responsable de la hemólisis en atletas (footstrike)26, sin embargo, esta teoría se debe retomar a la luz de otras teorías como el aumento de la temperatura32, alteraciones estructurales de la membrana del hematíe33, cambios osmóticos34, 35 y la a oxidación36, 37.
Los datos que aquí se presentan, constituyen evidencia indirecta del papel que el evento oxidativo juega en determinar la hemólisis inducida por el ejercicio en individuos sedentarios, unáis como evidencia directa del papel que juega la expresión fenotípica de un carácter genético mendeliano en determinar la respuesta eritrocitaria al estrés oxidativo generado por un evento de ejercicio submáximo.
CONCLUSIONES
Se encontró que el nivel de actividad eritrocitaria de G6PD se asoció inversamente con la magnitud de la hemólisis intravascular inducida por una sesión de ejercicio a 70% del VO2pico en individuos sedentarios sanos en apariencia. (Pero que de igual manera la respuesta hemolítica oxidativa en individuos con niveles más bajos de actividad de G6PD frente a ejercicios al 70% del VO2pico presenta una gran variabilidad.)
REFERENCIAS
1. Egan L, Watts P, Silta B. Changes in serum haptoglobin as an acute response to a marathon road race. J Sports Sci. 1987; 5: 55-60.
2. O´Toole M, Hiller W, Roalstad M, Douglas P. Hemolysis during triatlon races: its relation to race distance. Med Sci Sports Exerc. 1988; 20: 272-5.
3. Tsakiris S, Reclos GJ, Parthimos T, Tsakiris T, Parthimos N, Schulpis KH. b-tocopherol supplementatio restores the reduction of erythrocyte glucose-phosphate dehydrogenase activity induced by forced training. Pharmacol Res. 2006; 54: 373-9.
4. Peake JM, Suzuki K, Wilson G, Hordern M, Nosaka K, Mackinnon N, et al. Exercise-induced muscle damage, plasma cytokines, and markers of neutrophil activation. Med Sci Sports Exerc. 2005; 37: 737-45.
5. Blache D, Lussier-Cacan S, Gagnon J, Leon AS, Rao DC, Skinner JS, et al. Effect of exercise training on in vitro LDL oxidation and free radical-induced hemolysis: the HERITAGE Family Study. Antioxid Redox Signal. 2007; 9: 123-30.
6. Gómez-Cabrera MC, Domenech E, Viña J. Moderate exercise is an antioxidant: upregulation of antioxidant genes by training. Free Radic Biol Med. 2008; 44:126-31.
7. Sen C. Oxidants and antioxidants in exercise. J Appl Physiol. 1995; 79: 675-86.
8. Balog T, Sobocanec S, Sverko V, Krolo I, Rociæ B, Marotti M, et al. The influence of Seaton on oxidant-antioxidant status in trained and sedentary subjects. Life Sci. 2006; 78: 1441-7.
9. Liu M, Berghol R, Mäkimattila S, Lahdenperä S, Valkonen M, Hilden H, et al. A marathon run increases the susceptibility of LDL to oxidation in vitro and modifies plasma antioxidants. Am J Physiol. 1999; 39: 1083-91.
10. Snyder L, Fortier L, Trainor J, Jacobs J, Leb L, Lubin B, et al. Effect of hydrogen peroxide exposure on normal human erythrocyte deformability, morphology, surface characteristics, and spectrin-hemoglobin cross-linking. J Clin Invest. 1985; 76: 1971-7.
11. Grimes A. The hexose monophosphate pathway. Chapter 8. In: Human red cell metabolism. London: Editorial Blackwell Scientific Publications; 1980. p. 192-201.
12. WHO Working Group. Glucose-6-phosphate dehydrogenase deficiency. Bull WHO. 1989; 67: 601-11.
13. Salvemini F, Franzé A, Iervolino A, Filosa S, Salzano S, Ursini MV. Enhanced glutathione levels and oxidoresistance mediated by increased glucosa-6-phosphate dehydrogenase expression. J Biol Chem. 1999; 274: 2750-7.
14. Jamurtas A, Fatouros I, Koukosias N, Monthou E, Tofas T, Yfanti C, et al. Effect of exercise on oxidative stress in individuals with glucose-6-phosphate dehydrogenase deficiency. In Vivo. 2006; 20: 875-80.
15. Nidolaidis M, Jamurtas A, Paschalis V, Kostaropoulos I, Kladi-Skandali A, Balamitsi V. Exercise-induced oxidative stress in G6PD-deficient individuals. Med Sci Sports Exerc. 2006; 38: 1443-50.
16. Ministerio de Salud de la República de Colombia. Resolución 8430 de 1993. Por la cual se establecen las normas académicas, técnicas y administrativas para la investigación en salud.
17. Craig C, Marshall A, Sjöström M, Barman A, Booth M, Ainsworth B, et al. International physical activity questionnaire: 12-country reliability and validity. Med Sci Sports Exerc. 2003; 35: 1381-95.
18. Sarasti H. Concepto, función y origen del eritrón. Capítulo. 1 En: Restrepo A, Campuzano G, Falabella F, Layrisse M, Sarasti H, editores. Hematología. Medellín: CIB. 1987.
19. Restrepo A, Vélez H, Londoño F, Restrepo J. Cifras de hemo-grama normal. Antioquia Med. 1970; 20: 95-9.
20. Perkins S. Normal blood and bone marrow values in humans, appendix A. In: Greer J, Rodgers G, Foerster J, Paraskevas F, Lukens J, Glader B, eds. Wintrobe´s Clinical Hematology. 11th ed. Volume 2. Philadelphia: Lippincott Williams & Wilkins; 2004.
21. Richterich R, Colombo S. Química clínica. Barcelona: Salvat Editores SA; 1983. p. 346-8.
22. Beutler E. G6PDH deficiency. Blood. 1994; 84: 3613-36.
23. Frank J. Diagnosis and management of G6PD deficiency. Am Fam Physician. 2005; 72: 1277-82.
24. Miller B, Pate R, Burgess W. Foot impact force and intravascular hemolysis during distance running. Int J Sports Med. 1988; 9: 56-60.
25. Weight L, Byrne M, Jacobs P. Haemolytic effects of exercise. Clin Sci. (Lond) 1991; 81: 147-52.
26. Telford R, Sly G, Hahn A, Cunningham R, Bryant C, Smith J. Footstrike is the major cause of hemolysis during running. J Appl Physiol. 2003; 94: 38-42.
27. Senturk U, Gunduz F, Kuru O, Kocer G, Gul Y, Yesilkaya A. Exercise-induced oxidative stress leads hemolysis in sedentary but not trained human. J Appl Physiol. 2005; 99: 1434-41.
28. Selby G, Eichner E. Endurance swimming, intravascular hemolysis, anemia, and iron depletion. New perspective on athlete´s anemia. Am J Med. 1986; 81: 791-4.
29. Deitrick R. Intravascular haemolysis in the recreational runner. Br J Sports Med. 1991; 25: 183-7.
30. Lijnen P, Hespel P, Fagard R. Indicators of cell breakdown in plasma of men during and after a marathon race. Int J Sports Med. 1988; 9: 108-13.
31. Aguiló A, Tauler P, Fuentespina E, Tur J, Córdova A, Pons A. Antioxidant response to oxidative stress induced by exhaustive exercise. Physiol Behav. 2005; 84: 1-7.
32. Richieri G, Mel H. Temperature affects on osmotic fragility and the erythrocyte membrane. Biochim Biophys Acta. 1985; 813: 41-6.
33. Beneke R, Bien D, Hutler M, Leithauser R. Haemolysis caused by alterations of alpha-and beta-spectrin alter 10 to 35 min of severe exercise. Eur J Appl Physiol. 2005; 95: 307-12.
34. Smith J. Exercise, training and RBC turnover. Sports Med. 1995; 19: 9-31.
35. Radomski M, Sabiston B, Isoard P. Development or «sports anemia» in physically fit men after daily sustained submaximal exercise. Aviat Space Environ Med. 1980; 51: 41-5.
36. Evelo C, Palmen N, Artur Y, Janssen G. Changes in blood glutathione concentrations, and in erythrocyte glutathione reductase and glutathione S-transferase activity after running training and after participation in contests. Eur J Appl Physiol. 1992; 64: 354-8.
37. Ji L. Antioxidants and oxidative stress in exercise. Proc Soc Exp Biol Med. 1999; 222: 283-22.