Trichosporon mucoides infeccion en paciente inmunocompetente
Lucy García, MD1, Guiovana Fernanda Osorio, MD2
1. Profesora Adjunta, Servicio de Dermatología, Departamento de Medicina Interna, Facultad de Salud, Universidad del Valle, Cali, Colombia.
e-mail: lucyga47@hotmail.com
2. Becaria de Investigación, Servicio de Dermatología, Hospitales Universitarios Virgen del Rocío, Sevilla, España. e-mail: giosorio77@yahoo.com
Recibido para publicación agosto 8, 2007 Aceptado para publicación abril 18, 2008
RESUMEN
Mujer de 40 años, con historia de un mes de evolución de necrosis progresiva del lecho ungueal del cuarto dedo de la mano derecha, con dolor intenso y destrucción de la placa ungueal. Sin antecedentes patológicos, ni traumáticos. En la biopsia se observaron estructuras micóticas y en los cultivos para hongos se obtuvo crecimiento de Trichosporon mucoides, confirmado mediante pruebas bioquímicas. Se inició fluconazol y se obtuvo resolución del cuadro. Estos hongos son habitantes normales del suelo y se caracterizan por la presencia de hifas verdaderas, pseudohifas, artroconidias y blastoconidas. T. mucoides puede comportarse como un patógeno oportunista que produce infecciones graves en huéspedes inmunocomprometidos. Se conocen casos aislados de T. mucoides como agente causal de onicomicosis pero ninguno con la severidad del caso que aquí se presenta.
Palabras clave: Onicomicosis; Trichosporon mucoides; Trichosporon spp.
Trichosporon mucoides infection in an immunocompetent host
SUMMARY
A forty-year-old woman, hairdresser, presented a month history of progressive necrosis of the left fourth finger nailbed, accompanied by intense pain, without pathological antecedents and no trauma. Histologic examination showed extensive surface necrosis with abundant cell detritus and erythrocytes, within the necrotic tissue displacing the collagen. There were hyaline, birrefringent structures compatible with arthroconidia Tissue culture for aerobic as well as anaerobic bacteria and mycobacteria were negative. In tissue culture for fungus grew Trichosporon mucoides. A fluconazole therapy was initiated with 400 mg per week dosage, with clinical improvement. This fungus also normal soil inhabitant, is characterized by the presence of true hyphae, other members of the genus have pseudohyphae, arthroconidia y blastoconidia. T. mucoides can also be an opportunistic pathogen producing potentially fatal systemic infections in immunocompromised hosts. Cases of onychomycoses with this fungus as causative organism have been reported, but their symptomatology has not been as severe as in this case.
Keywords: Onychomycosis; Trichosporon mucoides; Trichosporon spp.
Las infecciones originadas por las especies Trichosporon, considerados patógenos oportunistas, presentan un espectro de manifestaciones clínicas que dependen de la condición inmune del individuo, y van desde infecciones cutáneas superficiales como piedra negra, tiña pedis u onicomicosis, hasta infecciones sisté-micas severas, incluso fatales, en pacientes inmunocomprometidos.
El objetivo de este trabajo es analizar la infección severa por Trichosporon mucoides con invasión a tejidos blandos, que genera necrosis y pérdida permanente de la uña del dedo afectado en una persona inmunocompetente y su respuesta adecuada a fluconazol.
CASO CLÍNICO
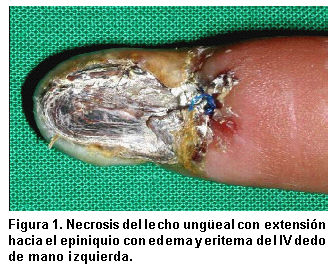
Mujer, estilista de 40 años de edad, que consulta con historia de un mes de evolución de cuadro consistente en necrosis progresiva de lecho de la uña, en el cuarto dedo de la mano izquierda, con dolor intenso. Al examen físico se observa paciente en buen estado general, afebril, normotensa, con una lesión hiperpigmentada que compromete toda la unidad ungueal con destrucción de la placa y necrosis del lecho de la uña, que se extiende hacia el epiniquio, con una costra fuertemente adherida (Foto 1). Además, se aprecian en la superficie palmar, nódulos subcutáneos, dolorosos que siguen un trayecto lineal (Foto 2). Antecedentes negativos para diabetes, hipertensión e infecciones.
Exámenes de laboratorio: Hemograma 5,900 leucocitos x mm3, neutrófilos 67%, linfocitos 34%; hemoglobina 11.9 g/dl, hematócrito 35%. Velocidad de eritrosedimentación 48 mm/h. ELISA para VIH negativo. ANAS negativos. C3: 68 mg/dl, C4: 10.2 mg/dl. Cultivos para bacterias aerobias, anaerobias y micobacterias negativos, radiografía de la mano sin compromiso óseo.
Histopatología: La biopsia del lecho ungueal, teñida con hematoxilina eosina mostró necrosis epidérmica y en la dermis presencia de infiltrado de células inflamatorias, células gigantes, necrosis con áreas hemorrágicas y visualización de hifas, blastoconidias y artroconidias vistas en mayor detalle con la coloración de ácido peryódico de Schiff (PAS) (Foto 3).
Cultivos para hongos: Se realizaron cultivos de tejido por duplicado en agar Sabouraud suplementados con cloranfenicol (Sigma, St. Louis, MO, USA) y ciclo-heximida (Sigma, St. Louis, MO, USA) incubados a temperatura ambiente (25º C), y se obtuvo crecimiento macroscópico de colonias levaduriformes, color crema, rugosas y con pliegues (Foto 4). La visualización microscópica con azul de lactofenol, reveló la presencia de hifas verdaderas, pseudohifas, blastoconidias y artroconidias típicas del género Trichosporon (Foto 5).
Las colonias se identificaron como T. mucoides con crecimiento en agar de harina de maíz (agar corn meal) y con el empleo de las pruebas bioquímicas, kit API20C AUX (BioMerieux, Inc., Lyon, France), se obtuvo un perfil de uso de los carbohidratos compatible con T. mucoides.
Tratamiento: Se instaura tratamiento con fluconazol a dosis de 400 mg semanales, con lo cual se detuvo la rápida extensión del proceso. Luego de seis meses de terapia continua, el cuadro infeccioso se resuelve y deja como secuela una importante distrofia de la unidad ungueal y retracción del dedo, por lo que se pasa a tratamiento fisiátrico.
DISCUSIÓN
Se trata de una levadura aislada del suelo, agua, vegetales, mamíferos y pájaros1 que es colonizadora común del sistema gastrointestinal, la piel y las uñas. De crecimiento rápido en medios de cultivo para hongos de rutina, forma colonias de color crema, grisáceas o sin pigmentación, rugosas, con pliegues. Microscópicamente se caracteriza por la presencia de hifas verdaderas, pseudohifas, artroconidias y blastoconidas. Las especies se distinguen por el perfil de empleo de los carbohidratos. El diagnóstico se hace por cultivo, KOH (positivo para artroconidias e hifas), histopatología, prueba de utilización de los carbohidratos. En los últimos años para diagnóstico rápido en pacientes graves se utiliza el PCR2. No se cuenta con pruebas serológicas específicas, pero puede mostrar reactividad cruzada con la prueba de aglutinación con látex para criptococo.
El Trichosporon se considera como agente causal de infecciones superficiales en pacientes inmunocompetentes y de infecciones profundas e invasivas en enfermos inmunocomprometidos; en estos casos cursa con una mortalidad hasta de 70% de los casos.
Tradicionalmente las especies de Trichosporon se han asociado sólo con enfermedades superficiales, no graves como la piedra blanca que compromete el tallo piloso. Pero emergen como causa importante de entidades graves desde el primer caso informado de una infección profunda por un Trichosporon, ocurrido en 1970 en una mujer africana con un adenocarcinoma metastásico que desarrolló un absceso cerebral por T. cutaneum3. A partir de entonces ha habido algunos informes que se asocian con pacientes inmunocomprometidos, neutropénicos4, con VIH, en quimioterapia, con malignidades hematológicas5 y con prótesis cardíacas o transplantados6.
Nettles et al.7 comunican un caso de una infección diseminada por T. mucoides en un paciente con transplante de corazón y riñón. En Alemania identifican a T. mucoides también como colonizador de uñas y agente causal de onicomicosis con compromiso exclusivo de la placa ungueal. Hace poco se han informado algunos casos de infecciones por Trichosporon en pacientes inmunocompetentes8.
El tratamiento se hace con fluconazol, itraconazol y anfotericina B, sin que se tenga un esquema terapéutico preciso. Los nuevos antifúngicos, derivados de los triazoles como el voriconazol, posaconazol y ravuconazol, parecen ser más activos contra Trichosporon spp. que la línea de antifúngicos antigua9.
Hasta hace poco tiempo la mayoría de los aislados de Trichosporon se designaban exclusivamente como T. beigelii o T. cutaneum. La designacion de T. beigelii ampliamente utilizada en la literatura, se ha transformado a partir de la clasificación de 1992 por considerarse que los casos atribuidos a T. beigelii probablemente se debían a T. asahii o T. cutaneum. En 1992 Gueho et al.10 propusieron una revisión taxonómica como género Trichosporon y posteriormente Sugita et al.11 reconocen 17 especies y 5 variedades del género, con sólo 6 especies causantes de infecciones en el hombre. De ellos T. asahii y T. mucoides están comprometidos en infecciones profundas mientras que T. asteroides, T. ovoides y T. cutaneum son responsables por la piedra blanca y otras infecciones superficiales. La sexta especie, T. inkin, puede causar tanto infecciones profundas como superficiales y recientemente se ha agregado a la lista T. pullulans en individuos con enfermedades granulomatosas.
En conclusión se tiene una paciente que desarrolló una infección severa, necrótica de tejidos blandos por T. mucoides, con diseminación linfática, sin inmunodeficiencia, ni neutropenia. En este caso se supone la ocupación de la paciente como factor de riesgo, quizá por haber sufrido un trauma, con pelo contaminado por el microorganismo.
REFERENCIAS
1. Walsh TJ, Melcher GP, Lee JW, Pizzo PA. Infections due to Trichosporon species: new concepts in mycology, pathogenesis, diagnosis and treatment. Curr Top Med Mycol. 1993; 5: 79-113.
2. Glass NL, Donaldson GC. Development of primer sets designed for use with the PCR to amplify conserved genes from filamentous ascomycetes. Appl Environ Microbiol. 1995; 61: 1323-30.
3. Watson KC, Kallichurum S. Brain abscess due to Trichosporon cutaneum. J Med Microbiol. 1970; 3: 191-3.
4. Marín J, Chiner E, Franco J, Borras R. Trichosporon beigelii pneumonia in a neutropenic patient. Eur J Clin Microbiol Infect Dis. 1998; 98: 631-3.
5. Tashiro T, Nagai H, Kamberi P, Goto Y, Kikuchi H, Nasu M, et al. Disseminated Trichosporon beigelii infection in patients with malignant diseases: Immunohistochemical study and review. Eur J Clin Microbiol Infect.Dis. 1994; 13: 218-24.
6. Moretti-Branchini ML, Fukushima K, Schreiber AZ, Nishimura K, Papaiordanou PM, Trabasso P, et al. Trichosporon species infection in bone marrow transplanted patients. Diagn Microbiol Infec Dis. 2001; 39: 161-4.
7. Nettles RE, Nichols LS, Bell-McGuinn K, Pipeling M, Scheel PJJr, Merz WG. Successful treatment of Trichosporon mucoides infection with fluconazole in a heart and kidney transplant recipient. Clin Infect Dis 2003; 36: e63-6.
8. Pulvirenti N, Dall'Oglio F, Greco A, Oliveri S, Schwartz R, Micali G. Superficial cutaneous Trichosporon asahii infec-tion in an immunocompetent host. Int J Dermatol. 2006; 45: 1428-31.
9. Paphitou NI, Ostrosky-Zeichner L, Paetznick VL, Rodríguez JR, Chen E, Rex JH. In vitro antifungal susceptibilities of Trichosporon species. Antimicrob Agents Chemother. 2002; 46: 1144-6.
10. Gueho E, Improvisi L, de Hoog GS, Dupont B. Trichosporon on humans: a practical account. Mycoses. 1994; 37: 3-10.
11. Sugita T, Nishikawa A, Ikeda R, Shinoda T. Identification of medically relevant Trichosporon species based on sequences of internal transcribed spacer regions and construction of a database for Trichosporon identification. J Clin Microbiol. 1999; 37: 1985-93.