El estado del arte en las infecciones producidas por el virus del papiloma humano
Julio César Reina, MD1, Nubia Muñoz, MD, MPH, DrSc2, Gloria Inés Sánchez, MSc, PhD2
1. Profesor Emérito e Investigador, Departamento de Pediatría, Escuela de Medicina, Facultad de Salud, Universidad del Valle, Cali, Colombia. e-mail: julioc.reina@imbanaco.com.co
2. Científica Emérita, Unidad de Estudios de Campo, Agencia Internacional de Investigacion del Cáncer. Lyon, Francia. e-mail: nubia.munoz@free.fr
3. Profesora Asistente, Departamento de Microbiología y Parasitología, Facultad de Medicina, Coordinadora, Grupo Infección y Cáncer, Universidad de Antioquia, Medellín, Colombia. e-mail: sanchezg@medicina.udea.edu.co
Recibido para publicación julio 9, 2007 Aceptado para publicación abril 18, 2008
RESUMEN
La infección anogenital por el virus del papiloma humano (VPH) es la infección de transmisión sexual mas frecuente en todo el mundo. En los humanos se han identificado alrededor de 100 genotipos de los cuales unos 40 infectan la región ano-genital. Los 15 genotipos de alto riesgo, son causa necesaria del cáncer cervical y han sido implicados como agentes carcinogénicos de la vulva, vagina, pene, ano y región orofaríngea. Los VPH de bajo riesgo producen las verrugas genitales (condilomas) y la papilomatosis respiratoria recurrente en hombres y mujeres. Se calcula que unas 300 millones de mujeres en el mundo portan la infección por VPH. El advenimiento de las vacunas profilácticas contra el VPH representa una estrategia prometedora en la prevención de las enfermedades relacionadas con este virus.
Palabras clave: Infecciones por papillomavirus; Neoplasias del cuello uterino; Neoplasias de cabeza y cuello; Neoplasias del pene; Neoplasias vaginales; Neoplasias de la vulva; Neoplasias orofaríngeas papilomatosis; Condiloma Aacuminado; Vacunas contra papillomavirus.
State-of-the-art of infections produced by human papillomavirus
SUMMARY
Anogenital human papillomavirus infection is the most frequent sexually transmitted disease. Around one hundred genotypes have been identified in humans, and 40 infect the genitalia and anal regions. Fifteen genotypes, classified as high-risk HPVs, are the necessary cause of cervical cancer and have been involved as carcinogenic agents for cancer of the vulva, vagina, anus, penis, and oropharyngeal cavity. Low-risk HPVs are the causative agents of genital warts, and recurrent respiratory papillomatosis in both men and women. The number of women harboring HPV-DNA worldwide is estimated to be 300 million. The recently introduced prophylactic HPV vaccines represent a hopeful strategy to prevent HPV infection and HPV-related diseases.
Keywords: Papillomavirus infections; Uterine cervical neoplasms; Head and neck neoplasms; Penile neoplasms; Vaginal neoplasms; Vulvar neoplasms; Oropharyngeal neoplasms; Papillomatosis; Condylomata acuminata; Papillomavirus vaccines.
La principal característica de los virus de la familia Papillomaviridae, donde se han reconocido cerca de 200 genotipos, es su capacidad de infectar e inducir proliferación de los epitelios de mamíferos. La clasificación taxonómica de los papilomavirus se lleva a cabo con base en la secuencia de sus nucleótidos. Se considera que un genoma representa un tipo nuevo cuando las secuencias del gen L1 difieren en más de 10% de las de cualquier tipo conocido. En los seres humanos se han aislado y caracterizado molecularmente cerca de 100 Tipos de virus de papiloma humano (VPH) y de éstos, alrededor de 40 infectan los tractos anogenital y aerodigestivo superior1. Estos virus son desnudos, pequeños, de cápside icosahédrica y contienen un genoma de ADN de doble cadena de aproximadamente 8,000 pares de bases y más o menos resisten a la desecación.
Funcionalmente el genoma del VPH se puede dividir en tres regiones distintas: la conformada por los genes E1 y E2 que regulan la replicación del ADN y la transcripción viral, y los genes E5, E6 y E7 que codifican proteínas que interfieren con las funciones de regulación del crecimiento de las células epiteliales; la región LCR (long control region) donde se localizan las secuencias de ADN que contienen los promotores y sitios de iniciación de replicación del genoma viral y la región conformada por los genes estructurales L1 y L2 que codifican las proteínas que forman la cápside. El mejor método diagnóstico son las pruebas moleculares entre las que se cuentan la hibridización con sondas genéricas o específicas para cada genotipo, bien sea del genoma completo o de fragmentos amplificados mediante la reacción en cadena de la polimerasa. Estos métodos permiten detectar con alta sensibilidad el genoma del virus en muestras de células exfoliadas del cérvix, tejidos embebidos en parafina o tumores frescos1.
El ciclo de vida de infección productiva, que da lugar a los condilomas o verrugas y lesiones intraepiteliales de bajo grado, posee tres pasos fundamentales. Establecimiento de la infección en la capa basal, inducción de proliferación y amplificación del genoma viral en la capa suprabasal y ensamblaje y liberación de partículas virales en la capa granular del epitelio. Inicialmente, el virus invade las células basales mediante los proteoglicanos de heparán sulfato con ayuda de la integrina a62, 3, y utiliza la capacidad replicativa de esta célula, para replicar el ADN viral que se mantiene en forma de plásmido o episoma en el núcleo de la misma. Las proteínas E1 y E2 son esenciales para esta parte del ciclo. Después de esta etapa corta de replicación y a medida que las células se diferencian y migran hacia la superficie del epitelio, el virus induce una proliferación celular masiva de la capa suprabasal que da lugar a amplificación de un gran número de copias del genoma viral y producción de las proteínas de la cápside. En este paso las proteínas E7 y E6 juegan un papel muy importante. E7, se une e inactiva la proteína celular pRb (proteína del retinoblastoma), lo cual permite que se libere y active el factor de transcripción E2F, que induce la producción de las proteínas celulares para estimular la replicación del ADN y proliferación celular de estas células epiteliales que en condiciones normales no proliferan. Usualmente, la proliferación inesperada de células epiteliales en estado de diferenciación, induce la expresión de la proteína p53, que bloquea la proliferación celular o induce apoptosis (muerte celular) para evitar precisamente la transformación celular. Sin embargo, la proteína E6, une e inactiva la proteína celular p53 y con esto ayuda a que se establezca y mantenga el estado proliferativo de la infección del virus. Por último, cuando las células epiteliales están completamente diferenciadas, el ADN del VPH entra en la cápside viral y las partículas virales maduras son liberadas a medida que se descaman del epitelio.
Las lesiones de alto grado y el cáncer que eventualmente se da lugar a partir de este tipo de lesiones, es el resultado de un aborto de la infección productiva, que ocurre cuando el virus infecta células que no permiten el desarrollo completo del ciclo de vida viral. Se ha sugerido que este fenómeno ocurre en células de la unión escamo-columnar de la zona de transformación del cuello uterino. En este caso, el virus induce proliferación celular sostenida de todas las capas del epitelio debido a una expresión anormal de las proteínas E6 y E7 y hay poca o nula producción de las proteínas de la cápside y de partículas virales. Una consecuencia de esta proliferación incontrolada es la inestabilidad genómica, que lleva a facilitar la integración del genoma del virus en el genoma de la célula hospedera, proceso en el que el virus pierde totalmente la capacidad de regular las funciones proliferativas de E6 y E7. Estas dos condiciones, la inducción constante de proliferación de las células epiteliales y la pérdida del autocontrol de este crecimiento anormal, junto con acumulación de mutaciones y otros defectos genéticos, generan a largo plazo los cambios necesarios que conducen al cáncer4. La gran mayoría de las infecciones son asintomáticas o subclínicas, no originan ninguna manifestación clínica o morfológica y pasan desapercibidas a no ser que se haga una prueba molecular para detectar fragmentos del genoma en las células infectadas. Casi todas las infecciones son transitorias, pues son controladas por la respuesta inmune, sólo entre 10% y 20% de las infecciones se vuelven crónicas o persistentes y son éstas las que tienen un mayor potencial oncogénico5.
EPIDEMIOLOGÍA
Prevalencia. La infección por el VPH es una de las infecciones de transmisión sexual más comunes en el mundo. Los estudios coordinados por la International Agency for Research on Cancer (IARC) en más de 18,000 mujeres mayores de 15 años en 13 países han mostrado tasas de prevalencia de ADN de VPH que van desde 1.6% en España y Hanoi (Vietnam), con tasas de incidencia muy bajas de cáncer cervical, hasta 27% en Nigeria, con una tasa de cáncer cervical muy alta6. Existe una relación directa entre la prevalencia de la infección por VPH y la incidencia de cáncer cervical6. La prevalencia es mayor en mujeres menores de 25 años, y disminuye paulatinamente hasta llegar a los niveles más bajos en la cuarta o quinta décadas. En algunos estudios se ha observado un segundo pico después de la quinta década, y da lugar a una curva bimodal que es muy común en la mayoría de los países latinoamericanos7-10. El primer pico representa la rápida adquisición de las infecciones después del comienzo de la actividad sexual. Hay varias posibles explicaciones para el segundo pico observado en mujeres postmenopáusicas. Puede representar reactivación de infecciones latentes (pero todavía no se demuestra un estado de latencia para el VPH) o puede representar nuevas infecciones11.
Los estudios epidemiológicos recientes en adolescentes y mujeres jóvenes en Estados Unidos muestran una prevalencia de infección cervical por VPH que oscila entre 51% y 64%12. La prevalencia de la infección por VPH en hombres es menos definida, principalmente debido a la dificultad en la obtención de las muestras adecuadas para la detección de ADN. Los estimativos generales de infección por VPH en hombres oscilan entre 16% y 45%, y son similares o superiores a los encontrados en mujeres13. En estudiantes de Estados Unidos se calculó una prevalencia de 33%14, y en soldados de México15 y Dinamarca16 tasas de 34% a 46%. Casi todas las infecciones en los hombres son asintomáticas. Los hombres sin circuncisión muestran un riesgo significativo mayor para infección por VPH si se comparan con los circuncidados (19.6% vs 5.5%)17. El sexo anal se relaciona con un mayor riesgo de adquirir la infección por VPH. Más de 60% de homosexuales VIH-negativos, son positivos para la prueba de ADN-VPH anal18.
Aunque la infección por el VPH usualmente no causa enfermedades en la infancia, la transmisión perinatal, el contacto sexual casual o el abuso sexual pueden ser causa de papilomatosis laríngea, infecciones orales y verrugas genitales (condilomas), en los niños de ambos géneros19, 20. Se conoce muy poco acerca de la epidemiología de la infección ano-genital por VPH en niños. La asociación entre las verrugas (condilomas) ano-genitales en niños y el abuso sexual se estudió a partir de niños con condilomas ano-genitales. Las tasas de abuso sexual en niños con condilomas varía entre 4% y 90%21, sin embargo estos estudios adolecen de dificultades en reconocer la certeza o falsedad del abuso sexual y el inadecuado tamaño de la muestra. Las técnicas de diagnóstico molecular han servido para demostrar la evidencia de transmisión vertical, y así se han descubierto genomas de VPH en las mucosas oral y genital de neonatos22. Estos estudios muestran que la mayoría de las infecciones ano-genitales, laríngeas y orales por VPH en los niños se deben a transmisión perinatal y horizontal, y al abuso sexual, sobre todo en niños mayores de 2 años. El período de incubación entre la infección vertical por VPH y la aparición de las lesiones no está bien definido, y se estima que va de 6 semanas a varios años23.
La papilomatosis respiratoria recurrente (PRR) es una neoplasia casi siempre benigna, pero potencialmente fatal, consecuencia de la infección por el VPH, caracterizada por múltiples excrecencias verrugosas en la superficie de la mucosa del aparato respiratorio. Tiene una presentación bimodal según la edad: el tipo infantil tiene un pico de incidencia entre los 2 y los 4 años y el tipo adulto entre los 20 y los 40 años. Se ha estimado que la incidencia de PRR en la población pediátrica de los Estados Unidos es de 4.3 por 100,000 niños y 1.8 por cada 100,000 adultos24. El ADN de VPH se descubre entre 70% y 80 % de los casos de PRR25. Los Tipos VPH 6 y 11 son los agentes etiológicos más comunes. El tipo 11 se asocia con las formas más agresivas de la enfermedad26. El virus se transmite al sistema respiratorio del recién nacido a partir del aparato genital de la madre, que en la mayoría de los casos presenta condilomas clínicos aparentes27. En Estados Unidos se ha calculado un riesgo de transmisión entre 1% y 3% en bebés de madres con condilomas28. Se mencionan como factores de riesgo la presencia de condilomas en el canal del parto en el momento del nacimiento, madre joven en su primer embarazo y ruptura prematura de membranas29. La cesárea en madres con condilomas genitales puede disminuir la incidencia de infección perinatal.
Incidencia. La adquisición de la infección es muy común, sobre todo en los adolescentes y en personas jóvenes. Se estima que por lo menos 75% de la población sexualmente activa puede adquirir la infección durante la vida. Estudios de cohortes en Estados Unidos e Inglaterra, donde se hizo el seguimiento de adolescentes de 15 a 19 años al comenzar su actividad sexual, y con muestras de células cervicales para la detección de ADN de VPH cada 4-6 meses demostraron que a los 4 años 50% a 60% de los individuos había adquirido la infección y que el intervalo promedio entre el primer coito y el descubrimiento de VPH es de alrededor de 3 meses30, 31. Brown et al.32 observaron que 49 de 60 mujeres adolescentes entre los 14 y 17 años de edad, seguidas cada 3 meses fueron positivas para VPH cervico-vaginal en 27 meses de observación, lo que indica una incidencia acumulada de 82%. Un estudio de cohorte en Bogotá33 en 1,610 mujeres con citología vaginal normal y VPH-negativas al ingreso, mostró que el grupo de 15 a 19 años tenía el mayor riesgo de adquirir la infección por VPH (43%), seguido por el grupo de 20 a 24 años (35%); y que 13% de las mujeres mayores de 45 años habían adquirido la infección al quinto año de seguimiento.
Transmisión. La gran mayoría de las infecciones genitales por VPH se transmiten durante el acto sexual con o sin penetración incluyendo el contacto genital-genital, genital-manual, genital-oral y genital-anal. El VPH requiere del acceso a las células basales del epitelio escamoso o mucoso a través de micro-abrasiones o micro-rasgaduras, producidas durante el acto sexual o durante infecciones previas tanto por VPH como por otros microorganismos34. Además del cuello uterino, el VPH puede infectar otras áreas del periné: genitales externos o el ano si hay contacto de piel con piel en las caricias y estimulación sexual sin penetración como sucede en las adolescentes que practican la abstinencia. Se ha mencionado la posible transmisión por fómites como espéculos, guantes u objetos sexuales, pero no se ha comprobado. Como se mencionó antes, el VPH se puede transmitir por la madre al recién nacido durante el parto vaginal con el resultado de la PRR, entidad que tiene una alta morbilidad en el niño35.
Factores de riesgo para la adquisición de la infección. El factor de riesgo más consistente y documentado para la infección por VPH es el número de compañeros sexuales5, 33. A mayor número de compañeros sexuales, mayor será el riesgo de adquirir la infección por VPH, sin embargo la actividad sexual con un solo compañero (que tiene o ha tenido varias compañeras) también se asocia con la infección por VPH. La prevalencia de infección por el VPH en mujeres contactadas en un servicio de salud universitario, con historia de un solo compañero sexual fue 20% comparado con 69% en aquellas que habían tenido 10 ó más compañeros sexuales a lo largo de su vida36, 37. Un nuevo compañero sexual aumenta 10 veces el riesgo de infección por VPH34. Otros posibles factores de riesgo para adquirir la infección por VPH son la iniciación temprana de relaciones sexuales y el consumo de cigarrillo38. El uso de anticonceptivos orales, la paridad y la infección previa por otros agentes transmisibles por vía sexual, no se han encontrado en asociación clara con el riesgo de adquirir VPH en estudios recientes5. La circuncisión y el uso de preservativo ofrecen una protección parcial contra la adquisición del VPH17, 39.
ENFERMEDADES ASOCIADAS CON EL VPH Y SUS FACTORES
Estudios de seguimiento de mujeres que han adquirido el VPH muestran que la gran mayoría de ellas (80%) han eliminado la infección a los 18 meses40, 41. Sólo una pequeña proporción de infecciones se manifiesta clínicamente y resulta en lesiones precancerosas, cáncer o lesiones benignas. El resultado final de una infección por VPH, está determinado por el tipo de VPH, por la respuesta inmune del huésped y por otros cofactores42.
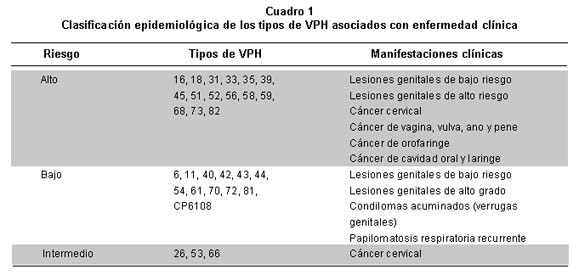
Tipos de VPH. Los Tipos de VPH se han dividido en alto y bajo riesgo de acuerdo con su alta o baja asociación con cáncer. Recientemente se ha propuesto una clasificación epidemiológica de los 40 Tipos asociados con infecciones ano-genitales con base en un estudio internacional de casos y controles en 13 países hecho por Muñoz et al.43 Un total de 15 Tipos se clasificaron como de alto riesgo, porque su presencia estaba asociada con un riesgo muy alto de cáncer cervical, 12 como de bajo riesgo, asociados con un riesgo bajo y no significante con cáncer cervical y 3 como de riesgo intermedio. Esta clasificación epidemiológica mostró una concordancia casi perfecta con la clasificación filogenética basada en la secuencia del gen L1. El Cuadro 1 muestra la clasificación epidemiológica de los Tipos de VPH y su asociación con las diferentes enfermedades clínicas. Además del cáncer invasor de cuello uterino, los Tipos de alto riesgo se asocian con cáncer de vulva, de vagina, de ano y de pene y con las lesiones precancerosas de bajo y alto grado de estos cánceres. Estudios realizados en más de 1,000 mujeres con cáncer cervical invasor en 22 países de varias regiones del mundo demostraron que el VPH es una causa necesaria para el desarrollo del cáncer cervical, es decir que 100% de estos cánceres son producidos por el VPH44. Se estima que la gran mayoría de los cánceres de la vagina y del ano (64-91%) se deben a este virus; así como 40% de los cánceres de vulva y pene, 30% de los cánceres de orofaringe y 10% de cánceres de la cavidad oral y laringe42. Lo anterior indica que 20% de los cánceres en mujeres en los países en vías de desarrollo son causados por VPH, o sea que es la causa más importante de cáncer en mujeres. Otros factores ligados con el virus, como las variantes moleculares especialmente de los genotipos 16 y 18, son también determinantes de importancia en la progresión a lesiones de alto grado del cérvix45.
Cofactores. En los estudios de casos y controles del IARC que sirvieron como base para la clasificación epidemiológica de los Tipos de VPH se compararon las mujeres con cáncer cervical positivas para VPH con mujeres controles positivas para VPH y se identificaron los siguientes cofactores que aumentan la probabilidad de progresión de la infección hacia el cáncer: Alta paridad, uso prolongado de anticonceptivos orales, consumo de tabaco y las infecciones previas como virus del herpes simple-2 y Chlamydia trachomatis46. Resultados similares se obtuvieron en análisis combinados de todos los estudios publicados y en algunos estudios de cohortes42. Otros posibles cofactores son algunas carencias nutricionales (vitaminas, antioxidantes), pero la evidencia epidemiológica es menos clara.
Factores del huésped. Factores genéticos e inmunológicos son ciertamente importantes, pero su papel no se ha establecido con claridad. Los estudios familiares han revelado que el tener o haber tenido una madre o una hermana con cáncer cervical aumenta el riesgo de padecerlo, y estudios de genes de HLA indican que la presencia de HLA DRB1*1301 confiere una cierta protección contra el cáncer cervical47. La carga viral es también un determinante importante de las manifestaciones clínicas de la infección48.
CONCLUSIONES
El VPH es una de las infecciones de transmisión sexual más frecuentes. La gran mayoría de las infecciones son transitorias y no dejan secuela. Sin embargo persisten entre 10% y 20% de las infecciones y son la causa de cáncer cervical en mujeres y de lesiones verrucosas (condilomas) en la región ano-genital tanto en las mujeres como en los hombres. La identificación del VPH como causa necesaria del cáncer cervical, el segundo cáncer más frecuente en las mujeres, ha cambiado totalmente el panorama de su prevención. El desarrollo de vacunas para prevenir la infección por VPH 16 y 18, los dos Tipos virales responsables por 70% de los cánceres cervicales y VPH 6 y 11 causantes de 90% de las verrugas genitales (condilomas) y la PRR, ha abierto grandes perspectivas para la prevención primaria. En la prevención secundaria, la integración de una prueba que permita identificar los Tipos de alto riesgo de VPH como prueba primaria de tamización ofrece la posibilidad de mejorar la eficiencia y disminuir los costos de los programas de filtro que al basarse solamente en citología vaginal han fallado en la mayoría de los países en vías de desarrollo donde se diagnostican 82% de los cánceres cervicales que ocurren en el mundo.
REFERENCIAS
1. de Villiers EM, Fauquet C, Broker TR, Bernard HU, zur Hausen H. Classification of papillomaviruses. Virology. 2004; 324: 17-27.
2. Evander M, Frazer IH, Payne E, QI YM, Hengst K, McMillan NAJ. Identification of the ?6 integrin as a candidate receptor for papillomavirus. J Virol. 1997; 71: 2449-56.
3. Joyce JG, Tung JS, Przysiecki CT, Cook JC, Lehman ED, Sands JA, et al. The L1 major capsid protein of human papillomavirus type 11 recombinant virus-like particles interacts with heparin and cell-surface glycosaminoglycans on human keratinocytes. J Biol Chem. 1999; 274: 5810-22.
4. Doorbar J. Molecular biology of human papillomavirus infection and cervical cancer. Clin Sci. (Lond) 2006; 110: 525-41.
5. Moscicki AB, Schiffman M, Kjaer S, Villa LL. Chapter 5: Updating the natural history of HPV and anogenital cancer. Vaccine. 2006; 24 Suppl 3: 42-51.
6. Clifford GM, Gallus S, Herrero R, Muñoz N, Snijders PJ, Vaccarella S, et al. Worldwide distribution of human papillomavirus types in cytologically normal women in the International Agency for Research on Cancer HPV prevalence surveys: a pooled analysis. Lancet. 2005; 366: 991-8.
7. Herrero R, Hildesheim A, Bratti C, Sherman ME, Hutchinson M, Morales J, et al. Population-based study of human papillomavirus infection and cervical neoplasia in rural Costa Rica. J Natl Can Inst. 2000; 92: 464-74.
8. Lazcano-Ponce E, Herrero R, Muñoz N, Cruz A, Shah, Alonso P, et al. Epidemiology of HPV infection among Mexican women with normal cervical cytology. Int J Cancer. 2000; 91: 1-9.
9. Molano M, Posso H, Weiderpass E, van der Brule ACJ, Ronderos M, Franceschi S, et al. Prevalence and determinants of HPV infection among Colombian women with normal cytology. Br J Cancer. 2002; 87: 324-33.
10. Ferreccio C, Prado RB, Luzoro AV, Ampuero SL, Snijders PJ, Meijer CJ, et al. Population-based prevalence and age distribution of human papillomavirus among women in Santiago, Chile. Cancer Epidemiol Biomarkers Prev. 2004; 13: 2271-6.
11. Franceschi S, Herrero R, Clifford GM, Snijders PJ, Arslan A, Anh PT, et al. Variations in the age-specific curves of human papillomavirus prevalence in women worldwide. Int J Cancer. 2006; 119: 2677-84.
12. Tarkowski TA, Koumans EH, Sawyer M, Pierce A, Black CM, Papp JR, et al. Epidemiology of human papillomavirus infection and abnormal cytologic test results in an urban adolescent population. J Infect Dis. 2004; 189: 46-50.
13. Partridge JM, Koutsky LA. Genital human papillomavirus infection in men. Lancet Infect Dis. 2006; 6: 21-31.
14. Weaver BA, Feng Q, Holmes KK, Kiviat N, Lee SK, Meyer C, et al. Evaluation of genital sites and sampling techniques for detection of human papillomavirus DNA in men. J Infect Dis. 2004; 189: 677-85.
15. Lajous M, Mueller N, Cruz-Valdez A, Aguilar LV, Franceschi S, Hernández-Avila M, et al. Determinants of prevalence, acquisition, and persistence of human papillomavirus in healthy Mexican military men. Cancer Epidemiol Biomarkers Prev. 2005; 14: 1710-6.
16. Kjaer SK, Munk C, Winther JF, Jorgensen HO, Meijer CJ, van den Brule AJ. Acquisition and persistence of human papillomavirus infection in younger men: a prospective follow-up study among Danish soldiers. Cancer Epidemiol Biomarkers Prev. 2005; 14: 1528-33.
17. Castellsagué X, Bosch X, Muñoz N, Meijer C, Shah K, de Sanjosé S, et al. Male circumcision, penile human papillomavirus infection and cervical cancer. N Engl J Med. 2002; 346: 1105-12.
18. Chin-Hong PV, Vittinghoff E, Cranston RD, Buchbinder S, Cohen D, Colfax G, et al. Age-specific prevalence of anal human papillomavirus infection in HIV-negative sexually active men who have sex with men: the EXPLORE study. J Infect Dis. 2004; 190: 2070-6.
19. Syrjanen S, Puranen M. Human papillomavirus infections in children: the potential role of maternal transmission. Crit Rev Oral Biol Med. 2000; 11: 259-74.
20. Sinclair KA, Woods CR, Kirse DJ, Sinal SH. Anogenital and respiratory tract human papillomavirus infections among children: age, gender, and potential transmission through sexual abuse. Pediatrics. 2005; 116: 815-25.
21. Gutman LT, St Claire K, Herman-Giddens ME. Prevalence of sexual abuse in children with genital warts. Pediatr Infect Dis J. 1991; 10: 342-3.
22. Sinal SH, Woods CR. Human papillomavirus infections of the genital and respiratory tracts in young children. Semin Pediatr Infect Dis. 2005; 16: 306-16.
23. Boyd AS. Condylomata acuminata in the pediatric population. Am J Dis Child. 1990; 144: 817-24.
24. Armstrong LR, Preston EJ, Reichert M, Phillips DL, Nisenbaum R, Todd NW, et al. Incidence and prevalence of recurrent respiratory papillomatosis among children in Atlanta and Seattle. Clin Infect Dis. 2000; 31: 107-9.
25. Syrjanen S. Human papillomavirus (HPV) in head and neck cancer. J Clin Virol. 2005; 32 Suppl 1: 59-66.
26. Rabah R, Lancaster WD, Thomas R, Gregoire L. Human papillomavirus-11-associated recurrent respiratory papillomatosis is more aggressive than human papillomavirus-6-associated disease. Pediatr Dev Pathol. 2001; 4: 68-72.
27. Silverberg MJ, Thorsen P, Lindeberg H, Grant LA, Shah KV. Condyloma in pregnancy is strongly predictive of juvenile-onset recurrent respiratory papillomatosis. Obstet Gynecol. 2003; 101: 645-52.
28. Shah KV, Kashima HK. Prevention of juvenile-onset recurrent respiratory papillomas. Curr Opin Otolaryngol Head Neck Surg. 1997; 5: 107-11.
29. Shah KV, Stern WF, Shah FK, Bishai D, Kashima HK. Risk factors for juvenile onset recurrent respiratory papillomatosis. Pediatr Infect Dis J. 1998; 17: 372-6.
30. Winer RL, Lee SK, Hughes JP, Adam DE, Kiviat NB, Koutsky LA. Genital human papillomavirus infection: incidence and risk factors in a cohort of female university students. Am J Epidemiol. 2003; 157: 218-26.
31. Collins S, Mazloomzadeh S, Winter H, Blomfield P, Bailey A, Young LS, et al. High incidence of cervical human papillomavirus infection in women during their first sexual relationship. BJOG 2002; 109: 96-8.
32. Brown DR, Shew ML, Qadadri B, Neptune N, Vargas M, Tu W, et al. A longitudinal study of genital human papillomavirus infection in a cohort of closely followed adolescent women. J Infect Dis. 2005; 191: 182-92.
33. Muñoz N, Méndez F, Posso H, Molano M, van den Brule AJ, Ronderos M, et al. Incidence, duration, and determinants of cervical human papillomavirus infection in a cohort of Colombian women with normal cytological results. J Infect Dis. 2004; 190: 2077-87.
34. Moscicki AB. Impact of HPV infection in adolescent populations. J Adolesc Health. 2005; 37: 3-9.
35. Derkay CS, Darrow DH. Recurrent respiratory papillomatosis. Ann Otol Rhinol Laryngol. 2006; 115: 1-11.
36. Ley C, Bauer HM, Reingold A, Schiffman MH, Chambers JC, Tashiro CJ, et al. Determinants of genital human papillomavirus infection in young women. J Natl Cancer Inst.1991; 83: 997-1003.
37. Winer RL, Kiviat NB, Hughes JP, Adam DE, Lee SK, Kuypers JM, et al. Development and duration of human papillomavirus lesions, after initial infection. J Infect Dis. 2005; 191: 731-8.
38. Burchell AN, Winer RL, de Sanjose S, Franco EL. Chapter 6: Epidemiology and transmission dynamics of genital HPV infection. Vaccine. 2006; 24 Suppl 3: 52-61.
39. Winer RL, Hughes JP, Feng Q, O'Reilly S, Kiviat NB, Holmes KK, et al. Condom use and the risk of genital human papillomavirus infection in young women. N Engl J Med. 2006; 354: 2645-54.
40. Ho GY, Bierman R, Beardsley L, Chang CJ, Burk RD. Natural history of cervicovaginal papillomavirus infection in young women. N Engl J Med. 1998; 338: 423-8.
41. Schiffman M, Kjaer SK. Chapter 2: Natural history of anogenital human papillomavirus infection and neoplasia. J Natl Cancer Inst Monogr. 2003; 3: 14-9.
42. Muñoz N, Castellsague X, de González AB, Gissmann L. Chapter 1: HPV in the etiology of human cancer. Vaccine. 2006; 24 Suppl 3: 1-10.
43. Muñoz N, Bosch FX, de Sanjosé S, Herrero R, Castellsagué X, Shah KV, et al. Epidemiologic classification of human papillomavirus types associated with cervical cancer. N Engl J Med. 2003; 348: 518-27.
44. Walboomers JM, Jacobs MV, Manos MM, Bosch FX, Kummer JA, Shah KV, et al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J Pathol. 1999; 189: 12-9.
45. Sichero L, Ferreira S, Trottier H, Duarte-Franco E, Ferenczy A, Franco EL, et al. High grade cervical lesions are caused preferentially by non-European variants of HPVs 16 and 18. Int J Cancer. 2007; 120: 1763-8.
46. Castellsague X, Muñoz N. Chapter 3: Cofactors in human papillomavirus carcinogenesis-role of parity, oral contraceptives, and tobacco smoking. J Natl Cancer Inst Monogr. 2003; 3: 20-8.
47. Wang SS, Hildesheim A. Chapter 5: Viral and host factors in human papillomavirus persistence and progression. J Natl Cancer Inst Monogr. 2003; 3: 35-40.
48. Snijders PJ, Hogewoning CJ, Hesselink AT, Berkhof J, Voorhorst FJ, Bleeker MC, et al. Determination of viral load thresholds in cervical scrapings to rule out CIN 3 in HPV 16, 18, 31 and 33-positive women with normal cytology. Int J Cancer. 2006; 119: 1102-7.