Evaluación del efecto genotóxico del Antracol WP 70 en cultivos de linfocitos humanos*
Carlos Hernán Barrera, Biol1, Liz Carolina Pardo, Biol2, Germán David Cortina, PhD3†
* El presente trabajo de investigación fue financiado por la Dirección de Investigaciones (DIN) y la Escuela de Ciencias Biológicas de la Universidad Pedagógica y Tecnológica de Colombia, Tunja, Colombia.
1.Investigador, Dirección de Investigaciones (DIN), Escuela de Ciencias Biológicas, Facultad de Ciencias Básicas, Universidad Pedagógica y Tecnológica de Colombia, Tunja, Colombia. e-mail: cahebaro@yahoo.com
2.Investigadora, Universidad Pedagógica y Tecnológica de Colombia, Facultad de Ciencias Básicas, Universidad Pedagógica y Tecnológica de Colombia, Tunja, Colombia e-mail: lizcapar@yahoo.com.mx
3. Docente Asociado, Universidad Pedagógica y Tecnológica de Colombia, Facultad de Ciencias Básicas, Universidad Pedagógica y Tecnológica de Colombia, Tunja, Colombia (QEPD).
Recibido para publicación mayo 30, 2007 Aceptado para publicación abril 18, 2008
RESUMEN
Introducción: El Antracol WP 70 es un plaguicida de uso común en la agricultura para mitigar fitopatologías asociadas con hongos. Dado su gran espectro de aplicación e incorrecta manipulación, no se encontraron estudios de genotoxicidad, realizados en humanos, acerca de este compuesto.
Objetivo: Evaluar, a partir de la prueba de aberraciones cromosómicas estructurales (ACE), el efecto genotóxico del Antracol WP 70 en cultivos de linfocitos humanos de sangre periférica.
Materiales y métodos: Se establecieron con réplica, cultivos de linfocitos humanos en medio RPMI 1640 complementado, e incubaron a 37° C. Estos cultivos se trataron con agua destilada estéril (control), concentración alta del plaguicida (2.5 mg/ml), media (1.25 mg/ml) y baja (0.02 mg/ml), durante un período de 48 horas. Se evaluaron las células en metafase, se registraron las ACE observadas y se analizaron los datos para calcular los respectivos valores estadísticos.
Resultados: El mayor número de aberraciones cromosómicas se encontró en las células tratadas con la concentración media y el menor fue para el grupo control. Sin embargo, no se encontraron diferencias estadísticamente significativas a un nivel de confianza de 95% entre la frecuencia de aberraciones cromosómicas en relación con el grupo control (p = 0.63). Los porcentajes entre aberraciones de tipo cromatídico y cromosómico encontradas fueron 77.3 y 22.7%. De la misma manera, no se encontraron diferencias estadísticamente significativas.
Conclusión: No se informa daño genotóxico, medido a través de la prueba ACE in vitro del Antracol WP 70 en cultivos de linfocitos humanos. Se recomienda continuar con estudios de toxicología genética y citogenética en Boyacá para resolver dudas acerca de los efectos mutagénicos, carcinogénicos y teratogénicos de los diferentes compuestos físicos, químicos y biológicos en los seres vivos.
Palabras clave: Genotoxicidad; Linfocitos; Aberraciones cromosómicas.
Antracol WP 70 genotoxicity in human lymphocyte cultures
SUMMARY
Introduction: Antracol WP 70 is a pesticide of common use in farming activities to mitigate pathologies in plants associated to mushrooms. In spite of its great application spectrum and incorrect manipulation, there were no genotoxicity studies found, carried out on human beings regarding this compound.
Aim: To evaluate, by means of structural chromosomal aberration test (SCA), the genotoxicity effect of Antracol WP 70 in human lymphocyte cultures of peripheral blood.
Materials and methods: Human lymphocyte cultures were established in RPMI 1640 supplemented Medium and incubated at 37° C. The cultures were treated with sterile distilled water (control), high concentration of the pesticide (2.5 mg/ml), half (1.25 mg/ml) and low (0.02 mg/ml), during a 48 hours period. The metaphase cells were evaluated and the SCA observed were registered and analyzed to estimate the respective statistical values.
Results: The biggest number of SCA was found in cells tried with the half concentration and the lowest one was for the group control. However, there were no statistically significant differences found at a confidence interval of 95% in the SCA frequency in relation with the group control (p = 0.63). The percentages of chromatid and chromosome aberrations were 77.3 and 22.7%, respectively. There were no statistically significant differences found.
Conclusion: Damage genototoxic, measured through the SCA test in vitro of the Antracol WP 70 in human lymphocyte cultures, is not reported. To continue with genetic toxicology and cytogenetic studies in Boyacá Department (State) to solve doubts about the mutagenic, carcinogenic and teratogenics effects of the different physical, chemical and biological compounds in the living beings is recommended.
Keywords: Genotoxicity; Lymphocyte; Chromosome aberrations.
El Antracol WP70 es un fungicida orgánico utilizado a nivel mundial, cuya acción se ejerce específicamente para el control de hongos causantes de enfermedades como antracnosis (Colletotrichum gloeosporioides), cenicilla (Oidium sp.), mancha púrpura (Alternaria porri), mildeo (Peronospora sp.), podredumbre (Botrytis sp.), gota (Phytoptora infestans) y tizón (Alternaria solani) en cultivos agrícolas de arroz, café, cacao, papa, cebolla, y plantas ornamentales, entre otros1.
Este plaguicida es un compuesto organosulfurado incluido en los fungicidas ditiocarbamatos2, 3, que se clasifica en la categoría toxicológica III4, correspondiente a compuestos de toxicidad media5. De acuerdo con las características toxicológicas, la dosis letal 50 (DL50) en ratas (toxicidad aguda) suministrado vía oral y cutánea es de 5,000 mg/kg, y la dosis de toxicidad crónica en rata por ingestión es de 50 mg/kg6.
Los registros disponibles acerca de los efectos adversos encontrados en sistemas biológicos experimentales informan: para ratas, disminución en el tamaño de los fetos al nacer y efectos histopatológicos7, malformaciones y defectos craneofaciales8, efectos sobre funciones musculares y sobre el citoesqueleto de células neuronales, astrocitos y células musculares9, lesiones preneoplásicas y neoplásicas en tiroides, riñón y vejiga urinaria10, disminución en el peso corporal e incremento en la queratinización e hiperplasia en células epidérmicas11. Para Drosophila melanogaster se informan alteraciones morfológicas en patas y alas12, y para protozoos del género Colpidium toxicidad leve13. No obstante, en otros estudios no se encontraron efectos adversos en los sistemas biológicos experimentales usados, medidos a partir del porcentaje de micronúcleos14, y las anormalidades en los espermatozoides3, evaluado en ratones.
De acuerdo con la literatura consultada, no se encontraron informes sobre poderes genotóxicos en los seres humanos para este compuesto; por tanto, con el presente estudio, se evaluó el efecto genotóxico del fungicida Antracol WP 70 en cultivos de linfocitos de sangre peri-férica mediante la prueba de aberraciones cromosómicas estructurales, a partir de tinción regular homogénea.
MATERIALES Y MÉTODOS
Obtención del producto. El fungicida Antracol WP 70 se obtuvo de la casa productora Bayer CropScience S. A., en unidad de presentación comercial, que contiene ingrediente activo (Propineb) a un grado de pureza de 70%.
Selección de donantes. Se aplicaron encuestas para obtener información personal y familiar, estado de salud, hábitos de consumo (tabaquismo, alcoholismo y psicoactividad), ocupación previa, actual y alterna de los posibles donantes. Se seleccionaron 5 mujeres y 5 hombres entre 18 y 25 años de edad, sin problemas de salud conocidos, sin exposición directa a compuestos mutagénicos, carcinogénicos y teratogénicos, sin consumo de cigarrillo, ni sustancias psicoactivas y alcohol.
Obtención de las muestras. Se tomaron, por punción venosa del antebrazo, con jeringa heparinizada, 5 ml de sangre periférica total por donante. Este procedimiento lo hizo personal especializado y con técnicas de asepsia admitidas médicamente.
Prueba de genotoxicidad. Inmediatamente después de tomada la muestra de sangre, se establecieron con réplica 4 cultivos de linfocitos por donante. Se depositaron directamente 0.5 ml de sangre periférica total por individuo en 5 ml de medio RPMI 1640 (Sigma), suplementado con 20% de suero fetal bovino estéril inactivado (Microgen), 1% de L-glutamina (Sigma) y 1% de penicilina/estreptomicina (Sigma). Los cultivos se estimularon con 100 µl de fitohemaglutinína (Eurobio) y se incubaron a 37°C. A las 24 horas, los cultivos controles se sometieron 100 µl de agua destilada estéril y los cultivos experimentales se trataron con 100 µl de las concentraciones 2.5 (alta), 1.25 (media) y 0.02 mg/ml (baja) del fungicida por 48 horas. Estas concentraciones correspondieron a las finales en el medio de cultivo. Preliminarmente se aplicó la técnica de índice mitótico para seleccionar las concentraciones alta, media y baja que disminuyeron las células en mitosis en 75%, 50% y 25%, respectivamente en relación con el control. Para el análisis de aberraciones cromosómicas, se utilizó la técnica de doble ciego para eliminar la tendencia subjetiva de correlacionar los resultados entre las concentraciones y los controles. Se realizaron los respectivos extendidos celulares y se observaron por cultivo entre 100-200 células en metafase con un rango entre 44 y 47 cromosomas. Se registraron en cuadros únicamente las ACE observadas a partir de coloración regular homogénea (Giemsa). No se efectuaron evaluaciones posteriores a las 48 horas de tratamiento, para evaluar in vitro los daños genéticos no reparados por los mecanismos de control celular y reparación de ADN, inducidos por el fungicida. Se tomaron microfotografías de algunas metafases observadas con y sin aberraciones cromosómicas.
Análisis estadístico: Los datos se procesaron con el programa estadístico StatGraphics Plus para Windows y DOS. Se aplicaron las pruebas de X2, ANOVA, prueba de Kruskal Wallis y prueba t de Student para evaluar las diferencias estadísticamente significativas entre aberraciones cromosómicas en las concentraciones evaluadas en relación con el grupo control.
Consideraciones éticas. Se realizó una reunión con los individuos seleccionados para informarles los objetivos, procedimientos metodológicos, resultados esperados, requerimientos y riesgos de participación en el estudio. Las personas, que aceptaron voluntariamente ser parte del estudio, firmaron un consentimiento informado. Lo anterior se realizó con base en la Resolución Nº 08430 de 1993 del Ministerio de Protección Social15.
RESULTADOS
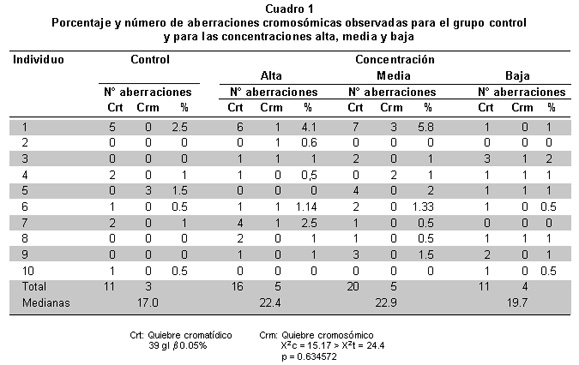
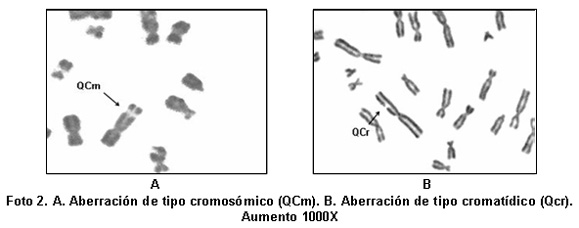
Se encontraron 75 aberraciones cromosómicas en 7,486 células en metafase analizadas (Foto 1). De estas, 14 (18.6%) corresponden al grupo control, y 21 (28%), 25 (33.3%) y 15 (20%) a las concentraciones alta, media y baja, respectivamente (Cuadro 1). No se encontraron diferencias estadísticamente significativas entre el grupo control y las concentraciones alta, media y baja, en rela-ción con el porcentaje de aberraciones cromosómicas. De 100% de las aberraciones encontradas, 23% corresponden a alteraciones de tipo cromosómico (Foto 2A) y 77% son de tipo cromatídico (Foto 2B). No se encontraron diferencias estadísticamente significativas entre quiebres de tipo cromatídico y cromosómico. Tampoco hubo figuras multirradiadas, cromosomas en anillo o cromosomas dicéntricos, u otro tipo de aberración.
DISCUSIÓN
El Antracol WP 70 no indujo aumento estadísticamente significativo en el porcentaje de aberraciones cromosómicas a concentraciones de 2.5, 1.25 y 0.02 mg de Antracol/ml de agua, en relación con el grupo control. El promedio en el porcentaje de aberraciones cromosómicas espontáneas por individuo para los cultivos controles del presente estudio fue 0.07% y estuvo por debajo de lo informado por otros autores16, 17. Asimismo, los resultados encontrados estuvieron entre el rango de 0-2% que se plantea para aberraciones cromosómicas espontáneas en cultivos de linfocitos humanos de sangre periférica18.
Las alteraciones cromosómicas son el resultado de fallas en los mecanismos de control celular y de reparación en el ADN. Estas alteraciones se pueden expresar en el sucesivo ciclo celular19, 20. Por ello, en este estudio se considera el tiempo de exposición un factor importante en la inducción de aberraciones cromosómicas. Si estas alteraciones se mantienen a nivel in vivo, es posible que en un individuo expuesto ocupacionalmente, puedan llegar a incidir en las células somáticas o germinales, y de esta manera, desencadenar enfermedades genéticas y ser transmitidas a la descendencia21, 22.
De la totalidad de aberraciones, 17 (23%) corresponden a cromosómicas y 58 (77%) a cromatídicas. En las aberraciones cromosómicas estructurales observadas en este estudio, se encontró una frecuencia mayor del quiebre cromatídico con respecto al cromosómico. Estos resultados fueron similares a los obtenidos en otras investigaciones23-25, donde informan mayor frecuencia de aberraciones de tipo cromatídico, originadas por sustancias químicas.
El análisis estadístico para el porcentaje de aberraciones cromosómicas demostró que no se encontraron diferencias estadísticamente significativas entre el grupo control y las concentraciones alta, media y baja. Sin embargo, la concentración media (1.25 mg/ml) registró el porcentaje más alto de aberraciones cromosómicas observadas correspondiente a 33%, seguido por las concentraciones alta y baja, con respecto al grupo control. La prueba t Student mostró diferencias estadísticamente significativas para la concentración baja (0.02 mg/ml) con respecto al porcentaje de quiebres cromatídicos en relación con los cromosómicos. Es necesario considerar que los quiebres cromosómicos presentan más riesgo genético, porque las dos cromátides están comprometidas en el daño. Esto indica, que la totalidad de sus descendientes presentarán esta aberración, por la reparación incorrecta, mientras que en el quiebre cromatídico, 50% de su descendencia conserva el material genético sin la presencia de la alteración cromosómica Los resultados obtenidos corresponden únicamente a aberraciones cromosómicas estructurales. Este hecho amerita un estudio complementario del efecto genotóxico del Antracol WP 70 con base en aneuploidías, pues la exposición a varios compuestos puede causar un incremento en la frecuencia de aneuploidías en los linfocitos de los individuos26; además del papel que éstas desempeñan en los procesos carcinogénicos27, 28.
Los efectos genotóxicos encontrados no se deben extraporlar en términos poblacionales o individuales, sino a nivel celular e in vitro. Debido a que a nivel in vivo, el efecto genotóxico del Antracol WP 70 puede ser aditivo por la exposición a mezcla de compuestos, a factores ambientales, ocupacionales, y a estilos de vida como consumo de alcohol, cigarrillo, drogas y hábitos alimenticios. Además, los individuos de acuerdo con su capacidad metabólica presentan procesos de biotransformación que evidencian una respuesta de susceptibilidad individual5. Se debe tener en cuenta que la influencia desconocida del ambiente y el mecanismo de reparación celular de los individuos, puede determinar significativamente la susceptibilidad y, por tanto, la repuesta de los linfocitos frente a las distintas concentraciones del Antracol WP 70, pues las respuestas individuales a los tóxicos del ambiente está influida por la capacidad metabólica de los individuos y también por la herencia de variación polimórfica20.
De acuerdo con lo anterior, el tiempo de exposición y los métodos de aplicación del Antracol WP 70 deben tener una correcta manipulación, porque aunque a las concentraciones evaluadas aparentemente inofensivas del Antracol WP 70 y los niveles de exposición que se informan en el presente estudio, no implica que a mayores concentraciones o mayor tiempo de exposición, no pueda afectar el material genético y convertirse en un cancerígeno potencial, debido al uso indiscriminado y frecuente por los trabajadores agrícolas. Este hecho amerita ampliar el análisis toxico, citotóxico y especialmente genotóxico de este agente químico en diferentes sistemas biológicos experimentales.
AGRADECIMIENTOS
Los autores expresan sus agradecimientos a la Escuela de Ciencias Biológicas y a la Dirección de Investigaciones DIN de la Universidad Pedagógica y Tecnológica de Colombia, Tunja, Colombia. A Luz Stella Hoyos Giraldo y Nancy Guerrero de la Unidad de Toxicología Genética y Citogenética de la Universidad del Cauca, Popayán, Colombia.
REFERENCIAS
1. Bayer Cropscience. Antracol. An old «warhorse» that's still going strong. Courier Agrochem. 2000; 2: 15-7.
2. Kazos E, Stalikas C, Nanos C, Konidari C. Determination of dithiocarbamate fungicide propineb and its main metabolite propylenethiourea in airborne samples. Chemosphere. 2007; 68: 2104-10.
3. Quinto I, De Marinis E. Evaluation of Propineb, a dithiocarbamate pesticide, in the mouse-sperm morphology assay. Mutat Res. 1983; 124: 235-40.
4. Hodgson E, Mailman R. Dictionary of toxicology. 2a ed. London: Editorial McMillan; 1988.
5. Córdoba D. Toxicología. 4a ed. Bogotá: Editorial Manual Moderno; 2001.
6. Bayer Cropscience. Hoja de datos de seguridad. Antracol WP 70. Centro América-Caribe: 2000. [fecha de acceso marzo 2006]. Disponible en: http://www.jedys.com.ar/data/HojaDeSeguridad_62.pdf
8. Larsson K, Arnander C, Cekanova E, Kjellberg M. Studies of teratogenic effects of the dithiocarbamates Maneb, Mancozeb, and Propineb. Teratol. 1976; 14: 171-83.
9. Schmuck G, Ahr H, Mihail F, Stahl B, Kayser M. Effects of the dithiocarbamate fungicide Propineb in primary neuronal cell cultures and skeletal muscle cells of the rat. Arch Toxicol. 2002; 76: 414-22.
10. Hasegawa R, Cabral R, Hoshiya T, Hakoi K, Ogiso T, Boonyaphiphat P, et al. Carcinogenic potential of some pesticides in a medium-term multi-organ bioassay in rats. Int J Cancer. 1993; 54: 489-93.
11. Yaldiz M, Akdeniz S, Bilgin U, Deveci E, Akkus M, Kilinc M, Deveci S. Teratogenic effects of Propineb on rat skin. Clin Exp Obstet Gynecol. 2000; 27: 235-7.
12. Sáenz D, Simbaqueba A. Evaluación del efecto genotóxico (variantes fenotípicas) del fungicida Antracol WP 70 en cepas silvestres de Drosophila melanogaster. [Trabajo de grado]. Escuela de Ciencias Biológicas, Facultad de Ciencias Básicas, Universidad Pedagógica y Tecnológica de Colombia, Tunja, Colombia; 1996.
13. Bonnemain H, Dive D. Studies on synergistic toxic effects of Copper and dithiocarbamate pesticides with the ciliate protozoan Colpidium campylum (Stokes). Ecotoxicol Environ Safety. 1990; 19: 320-6.
14. Rolandia A, De Marinis E, De Caterinab M. Dithiocarbamate pesticides: activity of Propineb in the micronucleus test in mice. Mutat Res Genetic Toxicol. 1984; 135: 193-7.
15. Ministerio de Protección Social, República de Colombia. Resolución Nº 8430 de octubre 4 de 1993, por la cual se establecen las normas científicas, técnicas y administrativas para la investigación en salud. Boletín Oficial del Ministerio de Protección Social. [fecha de acceso marzo 3 de 2006]. Disponible en: http://www.minproteccionsocial.gov.co/VBeContent/library/documents/DocNewsNo267711.pdf
16. Crane C, Zamora H, Bermúdez A, Barreto H, Pardo C, Ahumada J. Análisis de aberraciones cromosómicas para dosimetría genética. Acta Med Biol Colomb. 1994; 19: 330-9.
17. Paz-y-Miño C, Bustamante G, Sánchez M, Leone P. Cytogenetic monitoring in a population occupationally exposed to pesticides in Ecuador. Environ Health Perspect. 2002; 110: 1077-80.
18. Preston R, San S, Mcfee A. The in vitro human lymphocyte assays for assessing the clastogenicity of chemical agents. Mutat Res. 1987; 189: 175-83.
19. Iravathy K, Hasana Q, Balakrishnac N, Prabhakar K, Ahujae Y. Genotoxicity evaluation of individuals working with photocopying machines. Mutat Res. 2004; 563: 151-8.
20. Au W, Sierra C, Cajas N, Ship B, Legator M. Cytogenetic effects from exposure to mixed pesticides and the influence from genetic susceptibility. Environ Health Persp. 1999; 107: 501-5.
21. Hoyos L. Genotoxicidad de los plaguicidas. Mutagenicidad, carcinogenicidad y teratogenicidad. En: Córdoba D, editor. Toxicología. 4a ed. Bogotá: Editorial Manual Moderno; 2001.
22. Prieto E, Llópiz N. Normalización de la electroforesis de células individuales (Ensayo Cometa). Rev Cubana Invest Biomed. 1999; 18: 34-6.
23. Collazos F, Giraldo Y, Ospina N. Evaluación citotóxica y genotóxica del Endosulfán (Thiodán) in vitro e in vivo. [Trabajo de grado]. Universidad del Cauca. Facultad de Ciencias Naturales, Exactas y de la Educación. Departamento de Biología, Popayán, Colombia; 1995.
24. Au W, 1991. Citado por: Sánchez S, Vélez G. Evaluación del daño cromosómico potencial in vitro en tres plaguicidas de uso común: Dithane-M45, Benlate y Glifosato. [Tesis de pregrado en Biología]. Facultad de Ciencias Exactas y Naturales, Departamento de Biología, Universidad de Antioquia, Medellín, Colombia; 1993.
25. Hoyos L, Carvajal S, Solano L, Rodríguez J, Orozco L, López Y, et al. Cytogenetic monitoring of farmers exposed to pesticides in Colombia. Environ Health Persp. 1996; 104: 535-8.
26. Moore L, Titenko N, Smith M. Use of fluorescence in situ hibridization to detect chromosome-specific changes in exfoliated human bladder and oral mucosa cells. Environ Molec Mutag. 1993; 22: 130-7.
27. Galloway S. Chromosome aberrations induced in vitro: mechanisms, delayed expression, and intriguing questions. Environ Molec Mutag. 1994; 23: 44-53.
28. Fearon E, Vogelstein B. A genetic model for colorectal tuporigenesis, 1990. Citado por: Moore L, Titenko N, Smith M. Use of fluorescence in situ hibridization to detect chromosome-specific changes in exfoliated human bladder and oral mucosa cells. Environ Molec Mutag. 1993; 22: 130-7.