Seguridad hepática y hemática de la sulfadoxina-pirimetamina en el tratamiento de malaria por Plasmodium falciparum no complicada1
Jaime Carmona-Fonseca, MD, MSc2, Mary Luz López, Bact, MSc3, Juan Gabriel Piñeros, MD4
1. Trabajo financiado por la Dirección Seccional de Salud de Antioquia y la Universidad de Antioquia, Medellín, Colombia.
2. Grupo Salud y Sociedad, Universidad de Antioquia, Medellín, Colombia. e-mail: jaimecarmonaf@hotmail.com
3. Estudiante de doctorado, Grupo Malaria, Universidad de Antioquia, Medellín, Colombia.
e-mail: maryluze.lopez@gmail.com
4. Estudiante de doctorado, Universidad Nacional de Colombia, Bogotá, Colombia. e-mail: demian3@hotmail.com
Recibido para publicación agosto 17, 2007 Aceptado para publicación junio 26, 2008
RESUMEN
Introducción: Entre los fármacos ampliamente usados en la actualidad para el tratamiento de la malaria por Plasmodium falciparum se encuentra la sulfadoxina-pirimetamina, que es comúnmente administrada en combinación con otros medicamentos. Los eventos adversos informados se han asociado con altas dosis, uso como profiláctico o en personas con hipersensibilidad a las sulfas.
Objetivo: Evaluar la toxicidad hepática y hemática de la sulfadoxina-pirimetamina (SP) administrada en dosis y tiempos terapéuticos para la malaria por P. falciparum no complicada.
Metodología: Como parte de un estudio con diseño experimental, con determinación abierta del efecto, se hizo evaluación hemática y hepática a 17 personas tratadas con SP. En Turbo (Antioquia, Colombia), los pacientes se captaron consecutivamente y se siguieron por 10 días.
Resultados: Las variables hepáticas y hemáticas estuvieron alteradas durante el cuadro malárico antes del tratamiento y se normalizaron al poco tiempo del inicio del mismo (1-5 días), que fue eficaz en 100% de los pacientes (medido el día 10). La normalidad de todas las variables en los días 5 y 10 (fase postratamiento) sugiere la ausencia de efectos tóxicos imputables al medicamento. Los efectos adversos fueron pocos y leves y desaparecieron en el control del día 10.
Conclusiones: La SP no mostró eventos adversos, toxicidad hepática ni hemática usada en la dosis y el tiempo definidos para el tratamiento de la malaria por P. falciparum sin complicaciones.
Palabras clave: Malaria; Plasmodium falciparum; Sulfadoxina-pirimetamina; Amodiaquina; Toxicidad.
Liver and haematological safety of sulfadoxine-pyrimethamine treatment in non-complicated falciparum malaria
SUMMARY
Introduction: Sulfadoxine-pyrimethamine is an antimalarial used currently in worldwide for non-complicated falciparum malaria. This drug is administrated in combination with other ones. Previously adverse events had been reported with high doses, used in malaria prophylaxis and patients with hypersensibility to sulfas. Objetive: To evaluate hepatic and haematic toxicity of treatment with sulfadoxine-pyrimethamine (SP) in non-complicated falciparum malaria.
Methodology: This was a non-blinded experimental design. In Turbo (Antioquia, Colombia), 17 subjects treated with SP were evaluated for liver and hematic function. All individual were followed for 10 days.
Results: Before treatment, liver and hematic function tests were slight altedered. Hematic and liver variables returned to physiological levels after treatment. Treatment had 100% efficacy. All tests were within normal levels throughout the following period (postreatment); this suggests absence of toxic effects associates with treatment. Adverse effects were few and slight, and disappeared on day-10.
Conclusions: When is used in time and dose for treatment of non-complicated falciparum malaria, SP neither increased adverse events nor hepatic or hematic toxicity.
Keywords: Malaria; Plasmodium falciparum; Sulfadoxine-pyrimethamine; Amodiaquine; Toxicity.
La combinación sulfadoxina-pirimetamina (SP) (25 mg/1.25 mg base/kg de peso corporal, el primer día de tratamiento) es ampliamente usada para el tratamiento de malaria por Plasmodium falciparum, no complicada. El uso de SP sin asociarla con otro esquizonticida llevó al progresivo incremento de la resistencia del parásito al tratamiento y a la falla terapéutica de los pacientes; por tanto, desde hace años, se recomienda usarla en combinación con otros medicamentos. El uso de SP es considerado seguro por la Organización Mundial de la Salud (OMS) y otros expertos1.
López et al.2 evaluaron en 1998, en El Bagre (bajo Cauca antioqueño), la eficacia de la SP en personas con malaria no complicada producica por P. falciparum, con aplicación del protocolo OMS 1998, y obtuvieron una curación de 75%, con 14 días de seguimiento. Los autores de la presente investigación3 usaron el mismo protocolo OMS-1998 para medir la eficacia de SP en pacientes con paludismo por P. falciparum no complicado y se obtuvo una curación de 87%, con 14 días de seguimiento, en Turbo (zona de Urabá) y de 91%, con 7 días se seguimiento, en Zaragoza (área del bajo Cauca)4. Osorio et al.5 obtuvieron en Quibdó (región del Pacífico) una eficacia de 94%, con el mismo protocolo OMS-1998 y los mismos 14 días de seguimiento. En 2002 se evaluó de nuevo la eficacia de SP en Turbo y Zaragoza y se encontró que las proporciones de curación descendieron a 78% en Turbo y 74% en Zaragoza, con 21 días de seguimiento, según el protocolo OMS-19986. La falla terapéutica en 2002 no pudo explicarse por bajas concentraciones de sulfadoxina ni pirimetamina en sangre7. Una recopilación de datos sobre eficacia de SP en el tratamiento de la malaria por P. falciparum sin complicaciones en Colombia, para el período 1961-2003, reveló una curación de 85%7,8.
En Colombia, SP se ha usado asociada con amodiaquina (AQ-SP) para tratar el paludismo por P. falciparum sin complicaciones y las evaluaciones hechas a la eficacia de este esquema AQ-SP muestran una excelente actividad antimalárica, con curación de 98% a los 21 días7, según el protocolo OMS-1998.
La SP es un potente esquizonticida sanguíneo y se sospecha que estimula la producción de gametocitos de P. falciparum1,9; suprime la infectividad de los gametocitos para los anofelinos1 y altera las razones de sexo de los gametocitos, lo que influye en la infectividad para los mosquitos y la transmisión de la malaria; se considera que el efecto neto o global de la SP sobre supresión de la infectividad es nulo1. No se conoce si la elevada prevalencia de gametocitos posterior al uso de antimaláricos contra P. falciparum se debe a inducción de la gametocitogénesis por el medicamento o es consecuencia de la sobrevivencia y maduración postratamiento de células ya existentes9. Este posible papel causal de la SP en aumentar los gametocitos y, por ende, en el potencial aumento de la transmisibilidad de la enfermedad, es una de las más reiteradas críticas al medicamento. En Colombia, se ha evaluado la relación gametocitemia-SP5,10,11.
Tanto la sulfadoxina como la pirimetamina causan efectos tóxicos, pero son mucho más frecuentes los asociados con sulfadoxina12. La toxicidad de SP se relaciona casi exclusivamente con el uso prolongado de ella con fines de profilaxis antimalárica, pero no con el empleo para tratamiento de la enfermedad, que apenas requiere de dosis única12. SP no se debe usar en profilaxis por el riesgo de necrolisis epidérmica tóxica y de síndrome de Stevens Johnson. Es bien tolerada como tratamiento antipalúdico y cuando se usa como tratamiento preventivo intermitente en mujeres gestantes africanas1. No obstante lo anterior, se debe tener presente que en estudios recientes in vitro, se ha encontrado que SP parece ser capaz de inducir efectos genotóxicos moderados por aumento de la cromátides hermanas y los micronúcleos, además de sus efectos citotóxicos/citostáticos. Los autores sugieren que su empleo debe restringirse a situaciones donde otros antimaláricos no se puedan usar y nunca dar a gestantes13. SP no puede usarse en personas que simultáneamente reciban cotrimoxasol (combinación trimetoprim-sulfametoxazol) por el aumento del riesgo de efectos adversos, además de que ambos medicamentos tienen similar mecanismo de actividad antimalárica1.
El problema de los efectos tóxicos o adversos (que aquí se usan como sinónimos) de los medicamentos es complejo, lo cual incluye a la SP, pues la controversia persiste a pesar de los decenios que lleva en uso. En el año 2007 se publicó un informe sobre uso de la SP en gestantes, inclusive cuando se usa por tiempo prolongado (hasta seis meses, en los trimestres 2 y 3 de la gestación), en el llamado tratamiento preventivo intermitente (TPI); los autores dijeron que su empleo no está asociado con teratogenesis ni kernicterus. Ellos concluyen que «aunque pocos medicamentos se pueden administrar con completa seguridad durante el embarazo, la SP, cuando se aplica como TPI, tiene un perfil de seguridad favorable», que debe vigilarse su uso y «el acceso de las gestantes a este tratamiento debería continuar en expansión»14.
Como en Colombia se ha usado el tratamiento AQ-SP para la malaria por P. falciparum no complicada, los autores evaluaron los efectos sobre la sangre y el hígado de la AQ y de la SP. En relación con la AQ, encontraron que «usada en la dosis (25 mg/kg peso) y el tiempo (3 días) definidos para el tratamiento de la malaria por P. falciparum sin complicaciones, la amodiaquina no mostró efectos adversos ni toxicidad hepática ni hemática»15. El objetivo de este informe es dar cuenta de los hallazgos del estudio de efectos tóxicos de la SP, según la evaluación a un grupo de personas que hizo parte de un estudio sobre eficacia de antipalúdicos8.
Entre las pruebas que sugieren la alteración de la función hepática se encuentran la alaninoaminotransferasa (ALT), la bilirrubina total (BT) y la gamaglutamil transferasa (GGT), que presentan valores por encima de lo normal. El tiempo de protrombina (TP) y el tiempo parcial de tromboplastina (TPT) también son indicadores de falla hepática. Además, para atribuir a la SP la causa de la hepatotoxicidad se debe descartar la presencia de hepatitis A y B, leptospirosis y fiebre entérica, entre otras causas. La determinación de la toxicidad sanguínea se realiza mediante hemoleucograma.
MATERIALES Y MÉTODOS
Tipo de estudio y diseño de la muestra. Los pacientes de este informe hicieron parte de un estudio clínico controlado, con determinación abierta del efecto (curación o falla), para evaluar la respuesta terapéutica a varios esquemas de tratamiento de la malaria por P. falciparum no complicada. Se hizo evaluación hemática y hepática a los 17 individuos que tomaron SP. La evaluación de la respuesta terapéutica antimalárica se hizo con el protocolo OMS-1998 y los paciente se siguieron 21 días, pero el seguimiento para la evaluación hepática y hemática se limitó a 10 días. Todos los pacientes estaban curados el día 10, según la ausencia de fiebre, cefalea y escalofrío y la ausencia de parásitos sanguíneos.
Según datos previos de estudios en Colombia2-8, un grupo de 15-20 personas es suficiente para evaluar la eficacia de SP. En particular, los datos de estudios previos en El Bagre, Zaragoza y Turbo, citados por Carmona et al.7, indican una falla promedio alrededor de 11% para el tratamiento con SP.
Se calculó el tamaño muestral con
n = N Z2p(1–p ) / (Ne2) + Z2p(1-p)
y se usaron estos parámetros:
N: 2,200 pacientes con malaria por P. falciparum en Urabá, en el año 2000; Z: 1.96 (corresponde a un intervalo de confianza de 95%, es decir a un error alfa de 5%); p: prevalencia (p) de falla de SP; p=0.11 (prevalencia de falla); e: error de muestreo, tomado como 15% por los investigadores.
Esto llevó a un valor b=17. En la presente investigación se estudió los primeros 17 pacientes para hacer las mediciones hepáticas y hemáticas. Estos fueron captados consecutivamente entre junio y agosto del año 2002 en el puesto de malaria de la zona urbana de Turbo. Se aceptaron los que llenaron los criterios de inclusión. Se hicieron evaluaciones clínicas, parasitológicas y de laboratorio, realizadas por los mismos evaluadores, en los mismos sitios y laboratorios y con idénticas técnicas.
Población de referencia. Personas con malaria por P. falciparum, no complicada, que consultan al puesto de diagnóstico de malaria del Hospital Local de Turbo, de cualquier sexo, con edad superior a los 10 años, residentes en zona urbana (cabecera municipal) o rural (periferia).
Criterios de inclusión. Infección única por P. falciparum y sin complicaciones, con una parasitemia menor de 50,000 anillos/µl en el momento de ingreso al estudio; tener edad superior a 10 años, residencia en el área de estudio (urbana o cabecera municipal, rural o periferia) y posibilidad de asistir al seguimiento durante 10 días; otorgar el consentimiento escrito informado; no tener embarazo ni amenorrea mayor a 40 días; ausencia concomitante de enfermedades crónicas, en particular no tener infección por hepatitis A o B, leptospirosis o fiebre entérica; consumo semanal de licor inferior a 250 ml aproximadamente, y no más de 4 g diarios de acetaminofén; no haber recibido tratamiento antimalárico en las últimas 72 horas; ausencia de antecedentes de hipersensibilidad a los antimaláricos; ausencia de signos de peligro o de malaria grave y respuesta adecuada al tratamiento asignado durante los 10 días de seguimiento.
Criterios de exclusión. Presentar complicación de su enfermedad (incluyendo vómito que impida la adecuada administración del tratamiento), aparición de otra enfermedad, accidente, efecto adverso grave real o potencialmente asociado con el tratamiento, incumplir la prescripción médica, consumir otros medicamentos antimaláricos o antibióticos.
Aspectos éticos. A cada paciente se le informó del estudio, sus objetivos y procedimientos; quienes cumplieron con los criterios de ingreso y aceptaron su participación o la de su hijo firmaron un consentimiento informado, aprobado por el Comité de Ética del Centro de Investigaciones Médicas de la Universidad de Antioquia. Este trabajo cumplió con la Resolución 8430 de 1993 del Ministerio de Salud. En este trabajo no hubo uso de medicamentos nuevos, ni de dosificaciones o de vías de administración nuevas, ni de las combinaciones de ellos. El estudio consistió sólo en medir la eficacia de fármacos ya aprobados y evaluar los posibles eventos adversos.
Tratamiento antimalárico. Los investigadores entregaron diariamente a cada paciente el tratamiento antimalárico acompañado de un vaso con agua; se administró según la dosis del Ministerio de la Seguridad Social de Colombia, dosis única de 25 mg/kg de sulfadoxina y 1.25 mg/kg de pirimetamina. La Dirección Seccional de Salud de Antioquia (DSSA) suministró las tabletas que contienen 500 mg de sulfadoxina y 25 mg de pirimetamina (SP lote 10019RE). Cada persona se vigiló durante 30 minutos después de ingerir el medicamento y, si presentaba vómito, se repetía la dosis. La reaparición del vómito, fue causal de exclusión del estudio y de remisión al hospital local.
Estos pacientes no recibieron primaquina durante el seguimiento de diez días. Sólo el último día de seguimiento clínico y parasitológico (día 10) se administró a todos una dosis única de primaquina, como gametocitocida: 0.75 mg/kg de peso a los niños y 45 mg en total a los adultos1.
Seguimientos clínico y de laboratorio. El día 0 fue el día de ingreso (pre-tratamiento). Ese día un médico les realizó examen físico completo para descartar la presencia de signos de peligro de malaria complicada, según los criterios de OMS en 2000, enfermedad hepática o infección concomitante activa. También se aplicó una encuesta con variables clínicas y epidemiológicas (sexo, edad, etnia, ocupación, sitio de residencia y procedencia, antecedentes de malaria en el último año, tratamiento antimalárico recibido en los cuadros anteriores, hospitalizaciones y transfusiones en los 6 meses previos, tiempo de evolución de la enfermedad, antecedentes farmacológicos, uso de plantas antimaláricas y síntomas durante la enfermedad). Se tomaron 12 ml de sangre para gota gruesa, extendido, hemoleucograma, pruebas de función hepática y pruebas serológicas para hepatitis A y B, Leptospira y prueba de Widal. Los días 1, 2, 3, 5 y 10 los pacientes tuvieron evaluación médica. Los días 5 y 10 se sangraron para hemoleucograma y pruebas de función hepática.
Antes del tratamiento (día 0) y los días 1, 2, 3, 5 y 10 se hizo evaluación parasitológica (gota gruesa con coloración de Field). El diagnóstico se hizo en 200 campos microscópicos y aumento de 100X, la parasitemia se calculó con base en 200 leucocitos y un estándar de 8,000 leucocitos/µl. La gota gruesa se diagnosticó como negativa cuando no se observó ningún parásito en 200 campos microscópicos.
Exámenes de laboratorio. Las mediciones se realizaron en tres laboratorios ajenos a los investigadores, laboratorios que dieron los respectivos valores de referencia (normales).
a. Hemoleucograma: equipo automatizado (Cell pack auto net 8118K).
b. Pruebas de función hepática con fotocolorímetro RA-50 se hicieron TP (Sera-pack), TPT (Sera-pack), BT (Organon Tecnika) y bilirrubina directa (BD) (Organon Tecnika); por fotocolorimetría cinética se hicieron ALT (Biosystems; fotocolorímetro RA-50) y GGT (Human). Mediante seroaglutinación con la prueba de Widal (Cenogenics®) se evaluaron los antígenos H y O de Salmonella typhi, antígeno H de S. paratyphi y antígeno A de S. paratyphi B y antígeno O de Proteus OX-19. En la prueba de Widal, los títulos hasta 1:80 inclusive se consideraron negativos para fiebre entérica, cuyo diagnóstico se establece con títulos de 1:160 ó más16. Con la técnica de ELISA se analizaron IgM para hepatitis A (IgM-HA) (Alfa HAV IgM-EIA)®, antígeno de superficie de hepatitis B (AgS-HB) (Alfa AgS HB-EIA)®. Se usó la prueba de IFI para IgM anti-Leptospira (Biomerieux®) (IgM antiL), prueba para género, en la que un título mayor de 1:40 se considera positivo para ese agente.
Eventos adversos. Se definió como evento adverso la aparición durante el seguimiento de cualquier síntoma o signos, que no haya sido previamente referido por el paciente o por el médico, o el empeoramiento de los que han sido descritos antes. De acuerdo con el protocolo de la investigación, se evaluó la relación entre el efecto adverso y el medicamento mediante la siguiente escala: no se sabe, ninguna relación, posible, poco probable, probable, definitiva. El resultado del efecto adverso se clasificó en recuperación completa, todavía presente (al terminar el seguimiento), secuelas, muerte, no se sabe. La conducta aplicada por el médico tratante frente al evento adverso se clasificó en ninguna, suspensión del tratamiento, hospitalización, otra. Se preguntó específicamente si el efecto adverso se consideraba serio, lo que se definió como cualquier manifestación clínica que resultara en la muerte del paciente, que amenazara su vida, que obligara a hospitalizar al enfermo, que produjera incapacidad o discapacidad significativa o permanente, que pudiera ser peligroso de cualquier manera para el paciente, o que requiriera intervención para prevenir los resultados antes referidos.
Análisis estadístico. Para el análisis de los datos se usaron los programas Epi-Info 6.04 y SPSS 10.0. Siempre se consideró una probabilidad estadísticamente significativa cuando su valor fue menor de 5% (p<0.05). Las variables hemáticas y hepáticas comparadas fueron: tiempo de protrombina (TP), tiempo parcial de tromboplastina, bilirrubinas total (BT) y directa (BD), alanino amino transferasa (ALT), gamaglutamil tansferasa (GGT), eritrocitos, hemoglobina, hematocrito, leucocitos, neutrófilos, plaquetas. El análisis consistió en:
RESULTADOS
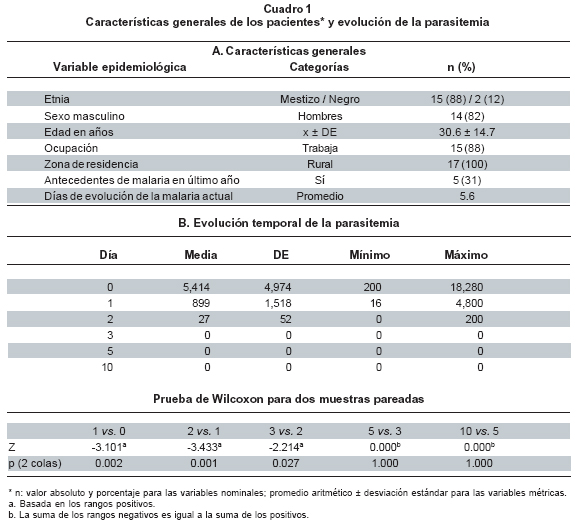
Desde el punto de vista hemático y hepático se estudiaron 17 pacientes con malaria por P. falciparum no complicada, 88% mestizos, 82% hombres, con edad de 30.6±10.7 años (promedio ± desviación estándar; siempre serán estas dos medidas), trabajadores activos (88%), residentes en zona rural 100%, con antecedentes de malaria en el último año (31%), con un promedio aritmético de 5.6 días de evolución de la enfermedad. La parasitemia asexual inicial fue de 5,414 ± 4,974 (mínimo: 200; máximo: 19,280). A las 24 horas de tratamiento son SP la parasitemia cayó a 899±1,518; a las 48 horas de tratamiento la parasitemia bajó a 27±52 y a las 72 horas fue cero, valor que se mantuvo hasta e final del seguimiento (día 10). Todos tuvieron resultado «negativo» en las pruebas de IgM-HA, IgM anti-L, AgS-HB y Widal.
Cuadro clínico y de laboratorio antes del tratamiento. La temperatura corporal fue 37.3±1°C, que bajó a 36.3±0.4°C a las 24 horas del tratamiento y a las 48 horas estaba en 36.1±0.5°C; continuó alrededor de este valor hasta el día 10. El pulso fue 90±18 por minuto, a las 24 horas estaba en 83±16, a las 48 en 71±10 y a las 72 horas de tratamiento estuvo en 67±7 por minuto, conservando un valor muy cercano a éste hasta el día 10. La frecuencia respiratoria por minuto fue 18±1 antes del tratamiento, 19±4 a las 24 horas de tratamiento, 17±1 a las 48 horas, y continuó alrededor de este valor hasta el final. En resumen, los signos vitales de temperatura, pulso y frecuencia respiratoria estuvieron en valores normales desde antes del tratamiento y continuaron mejorando progresivamente.
La parasitemia pasó de 5,414 parásitos/µl antes del tratamiento a 899, 27 y 0 parásitos/µl a las 24, 48 y 72 horas del tratamiento, en su orden (Cuadro 1B); siguió en cero hasta el final. Entre cada par de días comparados, la parasitemia siempre mostró reducción significativa.
Según la frecuencia de los fenómenos (Cuadro 2), el porcentaje de pacientes con valor dentro del intervalo fisiológico varió ampliamente (29% plaquetas a 100% eritrocitos) según sea la variable considerada. Ninguna de las variables hepáticas fue normal en la totalidad de los pacientes: variando de 41% para bilirrubina directa hasta 94% para ALT. En las variables hemáticas, la proporción de pacientes con valores anormales (fuera del intervalo fisiológico) fue máximo para las plaquetas (71%) y mínimo (todos normales) para los eritrocitos (0%); así, la trombocitopenia fue la anomalía más frecuente. Las enzimas ALT y GGT mostraron aumento en pocos pacientes (6% y 12%, respectivamente), mientras que las bilirrubinas total y directa estuvieron incrementadas en la mayoría: 47% y 59%, en su orden, con posiciones intermedias para TP y TPT (40% cada una). Hubo anemia (hemoglobina <11 g/dl) en 12%, leucopenia en 18%, leucocitosis en 6%, trombocitopenia en 71%.
Según la magnitud de los fenómenos, antes del tratamiento, ambos tipos de variables (hepáticas y hemáticas) están dentro del intervalo fisiológico, con excepción de las plaquetas (bajas) y la BD (elevada) (Cuadro 3). Aunque hubo 12% de pacientes con anemia, el promedio general de hemoglobina es normal (12.6 g/dl), asociado con hematocrito de 37.7%. La hepatomegalia (>1 cm debajo del reborde costal derecho) se encontró en 53%; no hubo pacientes ictéricos ni con hemorragias. Ninguna de las variables hepáticas y hemáticas se correlacionó con la parasitemia; ésta tampoco se correlacionó con la temperatura corporal, el pulso ni la frecuencia respiratoria.
Evolución temporal postratamiento de los valores hepáticos y hemáticos. El día 5 todos los pacientes estaban curados, según la ausencia de fiebre, cefalea y escalofrío, y la ausencia de parásitos sanguíneos; ese día 5, las pruebas de TP y TPT tuvieron poco cambio en relación con el día 0 (pretratamiento), porque siguieron afectadas entre 30% y 42% (Cuadro 2); la ALT fue normal en 100% y la GGT estuvo elevada en más sujetos (pasó de ser alta en 12% a serlo en 25%); BT y BD mostraron gran mejoría, porque sólo 7% y 21% están elevadas. El porcentaje de pacientes con anemia se duplicó al pasar de 12% a 24%, asociado con la disminución del hematocrito (fue bajo en 58.8%, contra 88.2% del día pretratamiento). El cambio más intenso sucedió en el recuento de las plaquetas, que ahora fue normal en 94% de los pacientes.
El día 10 hubo aumento del TP, porque sólo 47% presentaron un valor fisiológico (en lugar de 58% del día 5), pero la TPT cambió poco respecto al día 5 (25% elevado). BT y BD estuvieron estables respecto al día 5, pues 94% y 76% de los pacientes tuvieron valores normales, respectivamente. Las enzimas estuvieron altas en sólo 5%-8% de los enfermos, conservando la normalización vista desde el día 5.
Cuantitativamente, todas las variables hepáticas y hemáticas se encontraron normales en el día 5 (Cuadro 3). Fueron especialmente notorios los cambios en las bilirrubinas y en las plaquetas. La hemoglobina descendió de 12.6 g/dl a 11.7 g/dl. El día 10 se conservó la normalidad fisiológica y siguió el proceso de mejoría. Entre los días cero y cinco casi todas las variables mostraron diferencia estadísticamente significativa, usualmente indicando mejoría del estado clínico, excepto la hemoglobina que disminuyó. Entre los días 5 y 10 continuó la recuperación, aunque, en general, no hubo diferencia estadísticamente significativa entre los valores de esos días. En resumen, la normalización de las variables hemáticas y hepáticas fue precoz y sostenida.
Hasta finalizar el seguimiento (día 10), los pacientes presentaron poca frecuencia de eventos adversos (EA), que tuvieron intensidad leve y desaparecieron en el control del día 10. Los EA los días 1 y 2 fueron: mareo, 10% y epigastralgia, 5%; el día 3 se encontró mareo en 3%. En el caso del mareo la relación entre el EA y el medicamento fue catalogada como «ninguna relación» y en el caso de la epigastralgia se señaló como «posible». El resultado del EA se clasificó siempre en «recuperación completa». La conducta aplicada por el médico tratante frente al EA se clasificó siempre en «ninguna» (no hubo necesidad de ninguna medida). Nunca el efecto adverso fue «serio». Es pertinente señalar que la búsqueda de EA se hizo en forma planificada y persistente, con la ayuda de un cuestionario precodificado.
DISCUSIÓN
Al ingresar al estudio, los individuos tenían compromiso hemático evidente y, sobre todo, hepático, atribuible a la malaria. La elevación de las bilirrubinas es consecuencia del daño hepático que aparece hasta en 37% de las personas infectadas con P. falciparum17. El inicio del tratamiento con SP coincide con la mejoría de las variables evaluadas, incluidos los signos vitales.
Las anomalías hepáticas y hemáticas medidas en términos cuantitativos (promedio ± desviación estándar) fueron pocas y leves, pero cuando se midieron en términos de frecuencia de pacientes con valores anómalos, fueron muchos los afectados, es decir, con valores por fuera de lo fisiológico. Sin embargo, en el primer control postratamiento (día 5), casi la totalidad de los enfermos estaba en los intervalos normales, tanto cualitativa como cuantitativamente. Esto sugiere que los tratamientos con SP no tienen efectos tóxicos hepáticos ni hemáticos de importancia clínica.
En los casos de malaria por P. falciparum no complicada se describe la aparición de un cuadro anémico 48 horas después del inicio de la fiebre con disminución en la hemoglobina, recuento de eritrocitos y hematocrito, el cual puede permanecer hasta por 2 semanas después de eliminar la parasitemia18. Entre los mecanismos fisiopatológicos propuestos para la anemia se encuentra la destrucción aumentada de glóbulo rojos y una eritropoyesis inadecuada18,19. Este cuadro posiblemente es la explicación del comportamiento de estas variables en la presente muestra, lo cual puede reflejar que el tratamiento con SP no influye en dichos mecanismos fisiopatológicos y concuerda con lo encontrado por otros autores20 en niños tratados con cloroquina, AQ o SP, donde el día 7 presentan un hematrocrito inferior al día 0 independientemente del tratamiento recibido.
El medicamento no causó leucopenia o neutropenia, descrita por otros17,18. Los leucocitos y neutrófilos no mostraron diferencias en el tiempo y permanecieron dentro del rango normal con un leve aumento, lo que puede corresponder a la respuesta inflamatoria como consecuencia del cuadro malárico.
Hubo trombocitopenia antes del tratamiento, lo que concuerda con varios trabajos, incluyendo un hallazgo previo en Turbo donde 71% de los pacientes con malaria no complicada causada por P. vivax o P. falciparum la presentan21, posiblemente causada por destrucción y consumo de plaquetas a nivel periférico22. En los pacientes del presente estudio, los valores de plaquetas regresaron a la normalidad el día 5, lo que demuestra una recuperación a partir de precursores en médula ósea y es congruente con lo observado en otros estudios, donde el retorno a la normalidad sucedió en 5 a 14 días23. Por otra parte, los eventos adversos encontrados en este trabajo fueron leves, pasajeros y sin secuelas, lo que concuerda con lo informado en la literatura. para el uso de SP para tratar la enfermedad malárica, que es bien diferente de su uso en la quimioprofilaxis del paludismo, para lo cual no se debe emplear.
El «Formulario Modelo de la OMS 2004» relaciona los efectos adversos de SP y entre ellos no aparecen mareo ni epigastralgia. Otras fuentes sí refieren que entre los eventos adversos asociados con SP está el mareo y que es común (>1/100 y <1/10)24. También se dice de la pirimetamina (Daraprim®): «en raras ocasiones se han informado náusea, cólico, vómito, diarrea…» y que «con menor frecuencia se han presentado cefalea, mareo, sequedad de boca, fiebre, malestar general, dermatitis…»25. Una fuente registra como EA muy comunes o comunes estos: en el sistema hemolinfático, es muy común la anemia y son comunes leucopenia y trombocitopenia; en el sistema nervioso es muy común la cefalea y es común el mareo; en el sistema gastrointestinal son muy comunes vómito, náusea, diarrea; en la piel y el tejido subcutáneo es muy común el brote o erupción24.
Previamente se informó que «usada en la dosis (25 mg/kg peso) y el tiempo (3 días) definidos para el tratamiento de la malaria por P. falciparum sin complicaciones, la amodiaquina no mostró efectos adversos ni toxicidad hepática ni hemática»15. Al comparar el comportamiento de las variables hemáticas y hepáticas en función de los dos tratamientos (AQ y SP) se encontró que los dos grupos fueron comparables antes del tratamiento, que no hubo diferencia significativa entre ambos y que, además, la clase, frecuencia, gravedad y duración de los efectos adversos fueron similares, con excepción del prurito, el tinitus, el «sabor amargo en la boca», que sólo aparecieron con AQ. El día 5, las variables comparadas entre los dos tratamientos, mostraron diferencia significativa en el caso de BT, BD, leucocitos, neutrófilos y plaquetas, más bajos en los pacientes con SP. El día 10, la diferencia estuvo en las variables BT, hematocrito y plaquetas, la primera más baja y las otras dos más altas en quienes tomaron SP.
La SP más la AQ constituye el tratamiento combinado usado desde el año 2000 en Colombia y desde 1985 en el departamento de Antioquia; esa combinación AQ-SP demostró excelente eficacia (98%)7.
Como datos adicionales importantes hay que decir que recientemente se ha informado que la eficacia de las combinaciones amodiaquina-placebo y amodiaquina-artesunato fue estadísticamente igual en pacientes con malaria por P. falciparum, en Quibdó (Chocó) (97% y 100%, respectivamente)26, hallazgo que ratifica la excelencia de la combinación AQ-SP, cuya eficacia en Antioquia fue similar (98%)7.
En conclusión, en este estudio se encontró que el uso de SP para el tratamiento de la malaria por P. falciparum no complicada, en dosis totales estándares, fue eficaz y seguro, porque no se hallaron alteraciones hepáticas o hematológicas graves y que pudieran imputarse a SP; por estas razones y por la seguridad y eficacia mostradas por AQ y por la combinación AQ-SP en otros estudios propios y ajenos, por su bajo precio y por la experiencia en su empleo, se recomienda que el tratamiento AQ-SP se mantenga como la primera opción terapéutica.
AGRADECIMIENTOS
Al personal del Hospital «Francisco Valderrama» de Turbo, al Laboratorio Clínico «Unilab», Apartadó y al Instituto Colombiano de Medicina Tropical, Medellín. A los técnicos del Programa de Control de Malaria por su invaluable ayuda. A los pacientes por su participación en este estudio.
REFERENCIAS
1. WHO. Guideliness for the treatment of malaria. Document WHO/HTM/MAL/2006.1108. Geneva: WHO; 2006.
2. López YL, Arroyave A, Salazar A. Evaluación de la resistencia in vivo a medicamentos antimaláricos. El Bagre, Antioquia, 1998. Rev Epidemiol Antioquia. 1999; 24: 181-94.
3. Blair S, Lacharme LL, Fonseca JC, Tobón A. Resistencia de P. falciparum a tres fármacos antimaláricos en Turbo (Antioquia, Colombia), 1998. Rev Panam Salud Publica. 2001; 9: 23-9.
4. Blair-Trujillo S, Lacharme-Lora L, Carmona-Fonseca J. Resistance of Plasmodium falciparum to antimalarial drugs in Zaragoza (Antioquia, Colombia), 1998. Mem Inst Oswaldo Cruz 2002; 97: 401-6.
5. Osorio LE, Giraldo LE, Grajales LF, Arriaga AL, Andrade AL, Ruebush TK, et al. Assessment of therapeutic response of Plasmodium falciparum to chloroquine and sulfadoxine-pyrimethamine in an area of low malaria transmission in Colombia. Am J Trop Med Hyg. 1999; 61: 968-72.
6. Blair S, López ML, Piñeros JG, Alvarez T, Tobón A, Carmona J. Eficacia de tres esquemas de tratamiento de malaria no complicada por Plasmodium falciparum. Antioquia, Colombia. Biomedica. 2003; 23: 318-27.
7. Carmona-Fonseca J, Tobón A, Álvarez G, Blair S. El tratamiento amodiaquina-sulfadoxina-pirimetamina tiene eficacia del 98% para la malaria falciparum no complicada. Antioquia, Colombia, 2003. Iatreia. 2005; 18: 5-26.
8. Blair S, Carmona-Fonseca J, Piñeros JG, Ríos A, Álvarez T, Álvarez G, et al. Therapeutic efficacy test in malaria falciparum in Antioquia, Colombia. Malaria J. 2006; 5: 14.
9. Schneider P, Bousema T, Omar S, Gouagna L, Sawa P, Schallig H, et al. (Sub)microscopic Plasmodium falciparum gametocytaemia in Kenyan children after treatment with sulphadoxine-pyrimethamine monotherapy or in combination with artesunate. Int J Parasitol. 2006; 36: 403-8.
10. Arango E, Álvarez T, Carmona J, Blair S. Gametocitemia de Plasmodium falciparum según la respuesta terapéutica a sulfadoxina-pirimetamina y cloroquina en dos municipios de Antioquia, Colombia. Biomedica. 2004; 24: 79-88.
11. Méndez F, Muñoz A, Carrasquilla G, Jurado D, Arévalo-Herrera M, Cortese JF, et al. Determinants of treatment response to sulfadoxine-pyrimethamine and subsequent transmission potential in falciparum malaria. Am J Epidemiol. 2002; 156: 230-8.
12. Tracy J, Webster L. Fármacos usados en la quimioterapia de infecciones causadas por protozoos. Paludismo. In: Hardman J, Limbird L, eds. Goodman & Gilman. Las bases farmacológicas de la terapéutica. Vol I, 10a ed. México: McGraw-Hill Interamericana; 2002. p. 1085-112.
13. Abou-Eisha A, Afifi M. Genotoxic evaluation of the antimalarial drug, fansidar, in cultured human lymphocytes. Cell Biol Toxicol. 2004; 20: 303-11.
14. Peters PJ, Thigpen MC, Parise ME, Newman RD. Safety and toxicity of sulfadoxine-pyrimethamine: implications for malaria prevention in pregnancy using intermittent preventive treatment. Drug Saf. 2007; 30: 481-501.
15. Piñeros JG, López ML, Carmona-Fonseca J, Blair S. Seguridad hepática y hemática de la amodiaquina en el tratamiento de la malaria no complicada por Plasmodium falciparum. Colomb Med. 2006; 37: 258-65.
16. Kulkarni ML, Rego SJ. Value of single Widal test in the diagnosis of typhoid fever. Indian Pediatr. 1994; 31: 1373-7.
17. Harris VK, Richard VS, Mathai E, Sitaram U, Kumar KV, Cherian AM, et al. A study on clinical profile of falciparum malaria in a tertiary care hospital in south India. Indian J Malariol. 2001; 38: 19-24.
18. Menéndez C, Fleming AF, Alonso PL. Malaria-related anaemia. Parasitol Today. 2000; 16: 469-76.
19. Dondorp AM, Kager PA, Vreeken J, White NJ. Abnormal blood flow and red blood cell deformability in severe malaria. Parasitol Today. 2000; 16: 228-32.
20. Muller O, van Hensbroek MB, Jaffar S, Drakeley C, Okorie C, Joof D, et al. A randomized trial of chloroquine, amodiaquine and pyrimethamine-sulphadoxine in Gambian children with uncomplicated malaria. Trop Med Int Health. 1996; 1: 124-32.
21. Srichaikul T. Hematologic changes in human malaria. J Med Assoc Thai. 1973; 56: 658-63.
22. Ríos-Orrego A, Álvarez-Castillo T, Carmona-Fonseca J, Blair-Trujillo S. Temporal evolution of platelets and anti-platelets antibodies in patients of endemic area with non complicated malaria. An Med Intern. 2005; 22: 561-8.
23. Karanikas G, Zedwitz-Liebenstein K, Eidherr H, Schuetz M, Sauerman R, Dudczak R. Platelet kinetics and scintigraphic imaging in thrombocytopenic malaria patients. Thromb Haemost. 2004; 91: 553-7.
24. Fasa. Daraprim. (fecha de acceso: 1 abril 2008). Disponible en: http://www.fasa.cl/stores/fasa/html/Mft/PRODUCTO/P5169.HTM
25. Famguerra. Daraprim. Consulta: (fecha de acceso: 1 abril 2008). http://www.famguerra.com/Meds/Search/Meds.cfm? pagina=34860.htm
26. Osorio L, González I, Olliaro P, Taylor WR. Artemisinin-based combination therapy for uncomplicated Plasmodium falciparum malaria in Colombia. Malar J. 2007; 6: 25.