Nuevo papel de los radicales libres de oxígeno en el ejercicio: ¿otra paradoja?
Adriana del Pilar Urbina-Bonilla, MD*
* Profesora Unidad de Fisiología, Departamento de Ciencias Básicas, Facultad de Medicina, Universidad del Rosario, Bogotá DC, Colombia. e-mail: adriana.urbina38@urosario.edu.co
Recibido para publicación septiembre 14, 2007 Aceptado para publicación junio 26, 2008
RESUMEN
Introducción: La actividad física genera estrés oxidativo que produce efectos indeseados. Sin embargo, se sabe que los radicales libres de oxígeno (RLO) en bajas concentraciones, también tienen efectos fisiológicos que median la adaptación misma al ejercicio. Adicionalmente, la mayoría de los estudios sobre suplementación antioxidante muestra disminución del estrés oxidativo inducido por el ejercicio pero no mejoran el desempeño físico.
Objetivos: Reinterpretar la evidencia disponible acerca del papel de los RLO en el ejercicio, y analizar por qué la suplementación antioxidante no ha mostrado el efecto ergogénico esperado.
Metodología: Se revisaron los siguientes puntos: a) biología de los radicales libres de oxígeno; b) sistemas antioxidantes; c) estrés oxidativo inducido por el ejercicio; d) estrés oxidativo y desempeño físico; e) suplementación antioxidante y desempeño físico.
Hallazgos: Existe clara evidencia de que el ejercicio se asocia con la producción excesiva de RLO. Los efectos indeseados de los RLO sobre el desempeño se han observado en su mayoría en estudios in situ, aunque también existe evidencia en seres humanos. Se ha demostrado que el ejercicio físico resulta en hipoxia muscular y que ésta desencadena respuestas adaptativas mediadas por el HIF-1α, probablemente a través de la generación de pequeñas cantidades de RLO que estabilizan este factor de transcripción. Asimismo, se sabe que se requiere de cierto nivel de RLO para que la contractilidad muscular sea óptima.
Conclusiones: Como los RLO son necesarios para la adaptación a la hipoxia inducida por el ejercicio y la óptima contractilidad muscular, la suplementación antioxidante a largo término interfiere con su papel fisiológico. Esto explica por qué si bien diminuye los marcadores de estrés oxidativo, no mejora el desempeño físico.
Palabras clave: Radicales libres; Estrés oxidativo; Ejercicio; Entrenamiento; Antioxidantes; Hipoxia.
New role of free radicals in exercise: another paradox?
SUMMARY
Introduction: Physical activity conduces to oxidative stress, which produces undesirable effects. However, it is well known that free radicals, when present in low concentrations, also have physiological effects in the exercise adaptation process. In addition, the majority of antioxidant supplementation studies, in spite of the fact of decreases oxidative stress, have failed to show a performance improving.
Objectives: The goals of this review are to reinterpret the available evidence about the role of free radicals in exercise, and to analyze why antioxidant supplementation have not shown the expectable ergogenic effect.
Methods: The following topics were reviewed: i) the free radical biology; ii) antioxidant systems; iii) exercise induced-oxidative stress; iv) oxidative stress and physical performance; and v) antioxidant supplementation and physical performance.
Results: There is evidence that physical exercise is associated with excessive free radical production. Deleterious effects of free radicals in physical performance have been shown by in situ studies, although evidence in humans is also available. Physical exercise results in muscular hypoxia, which conduces to adaptative responses, probably through free radical-mediated HIF-1α stabilization. Moreover, a certain level of free radicals is necessary for optimal muscle contractility.
Conclusions: Free radicals are necessary for exercise-induced hypoxia adaptation and muscle contraction, for that reason long term antioxidant supplementation interfere with its physiological role. This, explain why antioxidants decrease oxidative stress markers but fail to improve physical performance.
Keywords: Free radicals; Oxidative stress; Exercise; Training; Antioxidants; Hypoxia.
IMPORTANCIA BIOLÓGICA DE LOS RADICALES LIBRES DE OXÍGENO
El oxígeno como elemento es altamente tóxico para muchas formas de vida; sin embargo, los organismos de vida aerobia son capaces de utilizarlo como aceptor final de electrones alcanzando una mayor eficiencia en la producción de energía a partir de los combustibles metabólicos. A pesar de ello, el oxígeno puede causarle daño aun a las células aerobias.
El oxígeno molecular (O2) es altamente reactivo y de manera rápida genera una serie de compuestos denominados radicales libres de oxígeno (RLO), los cuales, en condiciones normales existen en concentraciones bajas en las células y tejidos. En cantidades excesivas producen daño a los componentes celulares mediante una serie de reacciones en cadena. Los organismos vivos se han adaptado a los RLO de dos maneras: pueden mitigar sus efectos indeseados a través de su remoción por parte de los sistemas antioxidantes y pueden utilizarlos de forma ventajosa como mensajeros en la señalización celular y en la regulación de las funciones corporales. Dentro de las funciones fisiológicas ventajosas de los RLO se encuentra la regulación del tono vascular, detección y adaptación a la hipoxia, e incluso la misma respuesta al estrés oxidativo1.
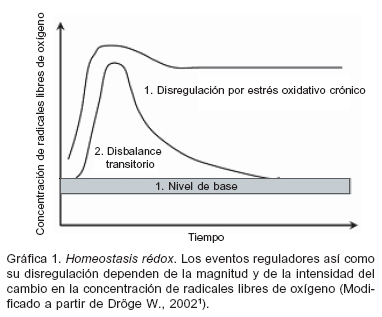
Las cantidades de RLO están determinadas por el balance entre su producción y su remoción, y un cambio en dicho balance en favor de su acumulación (estrés oxidativo) genera a su vez respuestas adaptativas en los sistemas antioxidantes manteniendo lo que se denomina «homeostasis rédox» (Gráfica 1)1. En condiciones basales, existe una pequeña concentración de RLO; sin embargo, cuando dicho nivel se ve sobrepasado se activan las vías de señalización sensibles al estado rédox. Este cambio en el balance obedece a la producción endógena regulada de RLO o a condiciones ambientales generadoras de estrés oxidativo, pero en ambos casos, si el aumento en la concentración de RLO es transitorio y/o de baja magnitud, los sistemas antioxidantes pronto son capaces de restaurar el estado inicial. De otro lado, bajo ciertas condiciones la producción de RLO aumenta más fuerte y persistentemente y las respuestas antioxidantes pueden no ser suficientes para reestablecer el balance hacia el nivel original, generándose un nuevo nivel de equilibrio, en donde las concentraciones de RLO son más elevadas y el patrón de expresión génica se modifica debido a la estimulación sostenida de las vías de señalización sensibles al estado rédox, incluyendo la del Factor Nuclear Kappa Betha (NF-KB) y MAP-quinasa (MAPK) (Para una revisión detallada ver referencia2). Cantidades excesivas de radicales libres están involucradas en la patogénesis de muchas enfermedades, incluyendo ateroesclerosis3, falla renal crónica4, y diabetes mellitus5, entre otras. También es sabido que la actividad física en sí misma es una fuente adicional de radicales libres.
SISTEMAS ANTIOXIDANTES
Las concentraciones de radicales libres dependen del balance entre su producción y su eliminación por parte de sustancias y enzimas antioxidantes. Halliwell y Gutteridge6 han definido los antioxidantes como «sustancias que son capaces, a concentraciones relativamente bajas, de competir con otros sustratos oxidables (por ejemplo, los componentes celulares) y así, inhibir o retardar significativamente la oxidación de dichos sustratos». Los sistemas antioxidantes pueden ser clasificados en: 1) enzimas antioxidantes, 2) sustancias antioxidantes, y 3) proteínas fijadoras de hierro y cobre6.
1.Enzimas antioxidantes. Las enzimas antioxidantes poseen especificidad de sustrato y catalizan la conversión de un RLO en compuestos menos reactivos, deteniendo la cadena de reacciones de oxidación. En el Cuadro 1 se resumen las características principales de las enzimas antioxidantes.2. Sustancias antioxidantes. Las sustancias antioxidantes son moléculas de bajo peso que pueden recibir un electrón proveniente de un radical libre o bien, donar un electrón a un radical con la formación de un bioproducto estable, por lo que detienen la cadena de reacciones oxidativas. Las sustancias antioxidantes se clasifican en aquellas de fase lipídica y de fase acuosa (Cuadro 2). Las primeras, importantes a nivel de las membranas celulares y las segundas a nivel extracelular. Como cada sustancia antioxidante es capaz de neutralizar varios tipos de RLO se consideran sistemas de carácter inespecífico.
Capacidad antioxidante total del plasma. Es la capacidad que tiene el plasma para detener una reacción oxidativa, la cual es el resultado de todas las sustancias antioxidantes que éste contiene. De hecho, el plasma se considera una solución heterogénea de antioxidantes de naturaleza diversa. El ácido úrico es el compuesto cuantitativamente más importante en la capacidad antioxidante total del plasma (contribuyendo en 60%) seguido por la vitamina C y las proteínas plasmáticas (15% y 10% respectivamente); también contribuyen elα-tocoferol y las bilirrubinas7.
3.Proteínas fijadoras de hierro y cobre. Tanto el hierro (Fe2+) como el cobre (Cu1+) catalizan la formación de RLO y la peroxidación de lípidos, mediante su reacción con el peróxido de hidrógeno, en una reacción que originalmente fue llamada reacción de Fenton:
A partir de esta reacción se genera una serie de reacciones que amplifica la producción de RLO. De esta manera, las proteínas que poseen la capacidad de unir y fijar estos metales de transición exhiben actividad antioxidante porque limitan la ocurrencia de dichas reacciones in vivo8 (Cuadro 3).
ESTRÉS OXIDATIVO INDUCIDO POR EL EJERCICIO
El ejercicio se considera como una condición de generación excesiva de RLO (Cuadro 4), que resulta asimismo en respuestas compensatorias por parte de los sistemas antioxidantes9, y aunque los mecanismos de su generación no están completamente claros, algunas de sus posibles fuentes incluyen: 1) procesos de isquemia-reperfusión; 2) oxidación de hemoglobina y mioglobina; 3) formación programada por las células del sistema inmune y 4) formación durante el metabolismo oxidativo. Estos mecanismos pueden actuar de forma sinérgica y también es probable que algunos de ellos contribuyan en magnitud diferente según el tipo de ejercicio realizado y su intensidad10.
Procesos de isquemia-reperfusión. El ejercicio induce hipoxia transitoria en varios órganos, e incluso isquemia. A través de la medición de la saturación de la hemoglobina por espectroscopia por resonancia nuclear magnética, se ha podido determinar que el ejercicio físico realizado en condiciones de normoxia ambiental disminuye la pO2 muscular desde un valor de 34 mmHg en reposo hasta 2-5 mmHg a intensidades de 60% a 100% de la carga máxima11, y cuando se realiza en condiciones de hipoxia ambiental, el ejercicio resulta en hipoxia muscular aún más intensa12. Las condiciones isquémicas generan la conversión de la xantina deshidrogenasa en xantina oxidasa, probablemente mediante un trastorno en la homeostasis del calcio y la activación de proteasas dependientes del calcio que degradan la porción terminal de la deshidrogenasa. Esta última cataliza la conversión de hipoxantina en xantina generando anión superóxido como producto secundario. Es sabido que la reoxigenación de los tejidos hipóxicos después del ejercicio, aumenta la actividad13 y la expresión14 de xantina oxidasa, y que el tratamiento con alopurinol protege contra la acumulación de superóxido después del ejercicio intenso en humanos15.
Oxidación de hemoglobina y mioglobina. Las hemoproteínas pueden auto-oxidarse y generar tanto anión superóxido como peróxido de hidrógeno. Vollaard et al.16 han informado del aumento inducido por el ejercicio en la concentración intraeritrocitaria de hemoglobina oxidada in vivo. La magnitud del incremento es significativa y similar en sujetos entrenados (triatletas) y no entrenados, con ejercicio máximo y submáximo. En todas estas condiciones la concentración de hemoglobina oxidada retornó a los valores iniciales al cabo de una hora16. Se desconocen las implicaciones fisiológicas de este fenómeno; sin embargo, el hecho de que sea controlado rápidamente sugiere la existencia de sistemas específicos de control del daño potencial, involucrando los sistemas enzimáticos de defensa antioxidante intraeritrocitarios (catalasa, superóxido dismutasa)16. Adicionalmente, se sabe que el ejercicio moderado a exhaustivo genera hemólisis17, por lo cual es factible inferir que también puede ocurrir oxidación de la hemoglobina plasmática liberada en el proceso de hemólisis; sin embargo, esta hipótesis necesita verificación experimental.
Formación por las células del sistema inmune. Se ha informado que el ejercicio físico modifica tanto el número como la función de los glóbulos blancos. El ejercicio físico aumenta la liberación y movilización de neutrófilos18, teniendo estas células una mayor capacidad de producción de anión superóxido y de peróxido de hidrógeno, así como mayor actividad fagocítica19.
Formación durante el metabolismo oxidativo: La «paradoja del oxígeno». Durante muchos años se creyó que el aumento en el flujo de oxígeno mitocondrial para suplir las demandas de ATP durante el ejercicio era suficiente para explicar la producción excesiva de RLO a nivel mitocondrial20. Sin embargo, actualmente se sabe que la hipoxia muscular que se desarrolla durante el trabajo físico11,12 también puede resultar en la producción de RLO, aunque en pequeñas cantidades21. A continuación se profundizará un poco más en esta aparente paradoja. Guzy et al.22 informaron que la mitocondria puede actuar como sensor de oxígeno y que en respuesta a la hipoxia produce de manera controlada anión superóxido en el complejo III de la cadena de transporte de electrones (espacio intermembranal mitocondrial), el cual se libera hacia el citosol donde estabiliza el factor inducible por la hipoxia (HIF-1α), de manera que puede mediar indirectamente a través de este último las respuestas adaptativas a la hipoxia22.
Los factores inducibles por la hipoxia (HIF-1 y HIF-2) son los mediadores de muchas de las respuestas a la hipoxia, incluyendo la activación transcripcional de los genes de eritropoyetina (EPO), factor de crecimiento endotelial vascular VEGF, enzimas glicolíticas, transferrina y mioglobina, entre otros23. El HIF-1α se transcribe y traduce constitutivamente. Sin embargo, en condiciones de normoxia e hiperoxia es degradado luego de su hidroxilación por un grupo de hidroxilasas de prolina. La actividad de este grupo de enzimas es máxima a FiO2 45%)24, lo que facilita su reconocimiento por el sistema de ubiquitina-proteasoma25. La hidroxilación y la degradación del HIF-1α se inhiben en condiciones de hipoxia por la generación de RLO22, y aunque también se generan cantidades adicionales de RLO durante la hiperoxia, se cree que éstas no son suficientes para inhibir las hidroxilasas de prolina cuando ellas se encuentran a un nivel cercano a su actividad máxima (FiO2 45%)26. Esto explica por qué sólo la hipoxia (y no la hiperoxia) resulta en la estabilización del HIF-1α.
Teniendo en cuenta lo anterior, se puede replantear la teoría de la producción mitocondrial de RLO durante el ejercicio. Ya no se trataría de una simple acción de masas en donde el aumento en la actividad en la cadena de transporte de electrones conduciría a una elevación en la producción de RLO, sino que puede tratarse también de una producción «controlada» de RLO, en la cual la mitocondria actuando como sensor de oxígeno sería capaz de detectar la disminución en la pO2 muscular (mitocondrial) que ocurre durante el ejercicio12, en respuesta a la cual produciría y liberaría más anión superóxido22 hacia el citosol, generando respuestas adaptativas a la hipoxia inducida por el ejercicio a través de la estabilización del HIF-1α. A este respecto, en humanos una carga aguda de ejercicio aumenta las concentraciones tanto de la proteína HIF-1α, como del mRNA de la EPO y el VEFG en la célula muscular27. Vale la pena enfatizar en que la producción «adaptativa y controlada» de ión superóxido durante la hipoxia inducida por el ejercicio sería ventajosa dentro de cierto rango de concentraciones, más allá del cual no se observarían las respuestas adaptativas benéficas mediadas por el HIF-1α, y predominarían en cambio, los efectos indeseados sobre los diferentes componentes celulares (estrés oxidativo)21.
ESTRÉS OXIDATIVO Y DESEMPEÑO FÍSICO
La generación de RLO inducida por el ejercicio y la adaptación consiguiente en los sistemas de defensa antioxidantes es similar a otras respuestas fisiológicas al ejercicio en las que una sobre carga altera la homeostasis y genera cambios reparativos y adaptativos que facultan al organismo para suplir esta sobre carga. Durante mucho tiempo se consideró que los RLO inducidos por el ejercicio eran deletéreos y se debían evitar.
A nivel celular, el daño oxidativo de los componentes celulares puede afectar las propiedades fisiológicas básicas de la fibra muscular: la excitabilidad causada por el daño de la bomba Na/K ATPasa sarcolemal28, que afecta la capacidad para desarrollar potenciales de acción, el acoplamiento excitación-contracción29 y la contractilidad29, por el daño de la bomba calcio ATPasa del retículo sarcoplásmico. Además, las proteínas contráctiles y las enzimas del metabolismo energético también son susceptibles de daño oxidativo30.
De otro lado, la evidencia del efecto de los RLO sobre el desempeño mismo, proviene en su mayoría de experimentos in situ en modelos animales usando fibras musculares aisladas tratadas con sustancias oxidantes, los cuales han mostrado una alteración de la contractilidad, disminución de la fuerza máxima y aumento de la fatigabilidad, fenómenos que son revertidos por la adición de sustancias antioxidantes o reductoras. Sin embargo, algunos de estos experimentos31,32 pusieron en evidencia que es necesario un nivel basal de sustancias oxidantes para un óptimo funcionamiento de la maquinaria contráctil, hecho que sirvió de fundamento para desarrollar una nueva teoría del papel de los RLO en el ejercicio31,32 según la cual es necesario un cierto nivel de RLO para que la contractilidad muscular sea óptima. En condiciones basales los músculos en reposo tienen una tasa muy baja de producción de RLO, por lo cual el balance rédox se encuentra en un estado relativamente «reducido», y esto atenúa la contractilidad del músculo. De otro lado, la actividad muscular intensa aumenta la producción de RLO y mueve el balance rédox a un estado «oxidado», lo cual también disminuye la fuerza. En un punto intermedio entre estos extremos, hay un estado rédox que optimiza la producción de fuerza en el músculo esquelético, por medio de la sensibilización miofibrilar al calcio (Gráfica 2)33.
SUPLEMENTACIÓN ANTIOXIDANTE Y DESEMPEÑO FíSICO
Está bien documentado que la suplementación con antioxidantes previene o mitiga el estrés oxidativo inducido por el ejercicio en varios tejidos, tanto en humanos como en animales34,35; sin embargo, teniendo en cuenta que los RLO también pueden desempeñar funciones fisiológicas, vale la pena considerar que su producción durante el ejercicio puede, en realidad, estar mediando algunas de las respuestas adaptativas a la actividad física. Esta hipótesis permitiría explicar por qué muchos de tales estudios de suplementación antioxidante muestran cambios en los marcadores de estrés oxidativo, pero fallan para demostrar cambios significativos en el desempeño físico.
De hecho, varios datos experimentales demuestran que la suplementación antioxidante a largo término afecta negativamente la adaptación muscular al ejercicio36-39. La suplementación oral con vitamina C mitiga el incremento adaptativo en la actividad de superóxido dismutasa, catalasa y en el contenido de proteínas de choque térmico que se observa en respuesta al ejercicio en sujetos humanos no suplementados36. Otro estudio37 de suplementación con vitamina C durante un ciclo de 8 semanas, mostró que el grupo de sujetos suplementados no tuvo la mejoría esperada de la capacidad aeróbica, y además presentó disminución de algunos factores de transcripción (coactivador del receptor activado por el proliferador del peroxisoma-1, el factor respiratorio nuclear-1 y el factor de transcripción mitocondrial-A), en comparación con los sujetos controles sin suplementación37. De otro lado, el ejercicio causó activación de MAP kinasas y del factor nuclear Kappa betha, tanto en humanos como en animales, pero estos cambios fueron abolidos por la disminución en la producción de RLO que se produjo tras la administración de alopurinol38,39. Con base en estos hallazgos y los de otros estudios, antes de la publicación de este artículo Jackson ha advertido sobre la necesidad de tener precaución en deportistas con el uso de suplementación antioxidante en altas dosis, por cuanto parecen interferir con el proceso mismo de adaptación al ejercicio40.
Según las teorías del estado rédox óptimo para la contractilidad muscular y de la homeostasis rédox (Gráfica 1), se podría pensar que la suplementación antioxidante aguda, en contraste con la de largo término sí podría llegar a tener un efecto benéfico sobre el desempeño físico mitigando los efectos adversos de cantidades excesivas de RLO por un lado y simultáneamente, mediante un rápido corrimiento hacia la izquierda en la curva de radicales libres vs contractilidad, llevar el estado rédox de la célula al nivel óptimo para el desempeño físico (Gráfica 2). Estos cambios benéficos potenciales no serían esperables con la suplementación antioxidante a largo plazo, porque con el paso del tiempo, el estado rédox de la célula podría retornar a su nivel homeostático inicial, en el cual la capacidad contráctil no es la óptima. Es tal vez por este motivo que los estudios de suplementación a largo término en humanos no han podido mostrar una clara mejoría en el desempeño41-43.
A favor de esta posibilidad, están los resultados de estudios de suplementación antioxidante aguda con N-acetilcisteína (NAC)44,45, la cual tras ser administrada intravenosamente a humanos, tanto entrenados como no entrenados, quienes se ejercitaron en un cicloergómetro hasta la fatiga, resultó en disminución de la fatigabilidad muscular (aumento en el tiempo transcurrido hasta la fatiga)44,45. El mecanismo de acción es al parecer la protección de la actividad de la Na/K ATPasa de la célula muscular45. En estos estudios no se hicieron determinaciones de actividad de enzimas antioxidantes ni de concentraciones de factores de transcripción. Como los efectos benéficos del medicamento fueron mayores en los sujetos entrenados que en los no entrenados, es necesario estudiar concienzudamente la contribución del grado de entrenamiento sobre el efecto observado45. No obstante, a pesar del factor de confusión que constituye el efecto del entrenamiento, es pertinente formularse la siguiente pregunta: ¿cuál es el efecto que la NAC tiene sobre otros marcadores de la adaptación muscular al ejercicio, como por ejemplo, la actividad de algunas enzimas antioxidantes o las concentraciones de algunos factores de transcripción, incluyendo el HIF-1α. En la actualidad no existen datos experimentales que permitan responder esta pregunta, por lo cual se analizarán los resultados provenientes de un estudio que evalúa el efecto de la NAC sobre la adaptación a la hipoxia ambiental simulada.
Se trata de un estudio de suplementación a largo plazo, realizado en seres humanos, voluntarios sanos, no entrenados, quienes se sometieron a hipoxia normobárica (FiO2 12%)46. Los sujetos se evaluaron primero en condiciones de normoxia y luego asignados aleatoriamente a un grupo placebo o a un grupo al cual se le administró NAC 200 mg/día vía oral durante 5 días, al cabo de los cuales se examinaron la cantidad de tioles (sulfidrilos) plasmáticos y la concentración de EPO46. Ambos parámetros se encontraron significativamente más elevados en los sujetos suplementados que en los controles sin suplementación, mientras que en este último grupo fue más elevada la concentración de peróxidos. Dicho en otros términos, el grupo suplementado mostró un estado rédox reducido y el grupo control un estado rédox oxidado. Luego, todos los sujetos se sometieron a hipoxia normobárica (FiO2 12%) por espacio de 6 horas, y se encontró que en el grupo suplementado las concentraciones de peróxidos eran menores y las de EPO mayores con respecto a los controles46, es decir, que se mantuvo un estado rédox relativamente más reducido en el grupo suplementado. Estos resultados sugieren que la concentración plasmática de tioles (y por tanto el estado rédox) puede modular la función de los sensores de oxígeno implicados en la respuesta a la hipoxia. La NAC, por su parte aumenta directamente la concentración de tioles (por su misma estructura química) y por tanto parece modular la respuesta de EPO, mientras que de forma simultánea mitiga el estrés oxidativo (medido como concentración de peróxidos). Aunque no se hayan realizado mediciones directas, es esperable que el aumento en la secreción de EPO haya sido mediado por un incremento del HIF-1α, es decir que es factible que la NAC directamente o a través de los tioles plasmáticos estabilicen el HIF-1α, por ejemplo por interferencia en la hidroxilación de sus residuos de prolina46.
En resumen, parece existir un efecto benéfico potencial de la suplementación aguda con NAC sobre el desempeño deportivo que se sabe involucra la protección de la actividad de la bomba Na/K ATPasa muscular; sin embargo, la evidencia disponible sugiere que también podría involucrar la adaptación a la hipoxia. A la luz del conocimiento actual sobre el papel de los radicales libres en el ejercicio, su efecto estaría mediado por una acción directa sobre la estabilización del HIF-1α, es decir que imitaría los efectos fisiológicos benéficos de los radicales libres en la adaptación al ejercicio, pero mitigando simultáneamente el estrés oxidativo, esto es, conseguiría una especie de efecto de cortocircuito. Esta especulación suena estimulante, por lo que es necesario estudiar el efecto de la NAC en la respuesta adaptativa a la hipoxia inducida por el ejercicio, en particular la respuesta eritropoyética (HIF-1α, concentraciones de EPO, peróxidos), teniendo la precaución de controlar el posible efecto del entrenamiento, e incluyendo un grupo experimental adicional que reciba suplementación (también aguda) con otras sustancias antioxidantes. Este tipo de diseño permitirá además determinar si otra sustancia antioxidante (por ejemplo, un antioxidante fisiológico, y por tanto menos tóxico) puede tener efectos similares.
CONCLUSIONES
Tradicionalmente los RLO han recibido gran atención para quienes estudian la fisiología del esfuerzo físico porque se les ha considerado deletéreos. Sin embargo, en la actualidad se sabe que pueden ser producidos de manera controlada en respuesta a la hipoxia y activar genes inducibles por la hipoxia mediante la estabilización del HIF-1α. Teniendo en cuenta que el ejercicio físico desde moderado a intenso, ya sea isotónico o isométrico, realizado en condiciones de normoxia o hipoxia ambiental, disminuye significativamente la pO2 intracelular muscular, se ha planteado que los RLO pueden en realidad estar mediando las respuestas adaptativas al ejercicio. Asimismo, se sabe que los RLO pueden modificar la capacidad contráctil del músculo, y que de hecho existe un nivel óptimo de RLO donde la capacidad contráctil es máxima. Por encima o por debajo de dicho nivel la contractilidad se encuentra disminuida.
Lo anterior ayuda a explicar por qué la suplementación antioxidante no mejora el desempeño, porque en realidad estaría interfiriendo con la respuesta fisiológica al ejercicio y porque es difícil que lleve la concentración de RLO justo al nivel óptimo para la contractilidad. No obstante, un conocido medicamento antioxidante, la NAC, sí parece tener efectos favorables sobre el desempeño: disminuye la fatigabilidad muscular cuando es administrado por vía endovenosa. El mecanismo de su acción es la protección de la actividad de la bomba Na/K ATPasa muscular, pero más allá de esto, es posible inferir que sea capaz de promover la estabilización del HIF-1α, y simultáneamente mitigar el estrés oxidativo; dicho en otras palabras imitar los efectos fisiológicos de los RLO, pero sin producir sus efectos indeseados. Por tanto, es necesario estudiar detalladamente los efectos de la NAC sobre el HIF-1α, sobre los genes que él activa y que son importantes en la adaptación al ejercicio, y sobre los marcadores de estrés oxidativo. También es necesario determinar si alguna otra sustancia antioxidante (preferiblemente fisiológica, en lugar de un fármaco como la NAC) puede ejercer este efecto benéfico con miras a diseñar una estrategia de suplementación antioxidante ergogénica efectiva y poco tóxica.
REFERENCIAS
1. Dröge W. Free radicals in the physiological control of cell function. Physiol Rev. 2002; 82: 47-95.
2. Allen RG, Trensini M. Oxidative stress and gene regulation. Free Radic Biol Med. 2000; 28: 463-99.
3. Harrison DG, Griendling KK, Landmesser U, Hornig B, Drexler H. Role of oxidative stress in atherosclerosis. Am J Cardiol. 2003; 91: 7A-11A.
4. Hasselwander O, Young IS. Oxidative stress in chronic renal failure. Free Radic Res. 1998; 29: 1-11.
5. Brownlee M. A radical explanation for glucose-induced beta cell dysfunction. J Clin Invest. 2003; 112: 1788-90.
6. Halliwell B, Gutteridge JM. Free radicals in biology and medicine. 2nd ed. Oxford: Clarendon Press; 1989.
7. Benzie IF, Strain JJ. Ferric reducing/antioxidant power assay: direct measure of total antioxidant activity of biological fluids and modified version for simultaneous measurement of total antioxidant power and ascorbic acid concentration. Methods Enzymol. 1999; 299: 15-27.
8. Stohs SJ, Bagchi D. Oxidative mechanisms o the toxicity of metal ions. Free Radic Biol Med. 1995; 18: 321-36.
9. Vollaard N, Shearman JP, Cooper CE. Exercise-induced oxidative stress: Myths, realities and physiological relevance. Sports Med. 2006; 35: 1045-62.
10. Finaud J, Lac G, Filaire E. Oxidative stress: Relationship with exercise and training. Sports Med. 2006; 36: 327-58.
11. Richardson RS, Newcomer SC, Noyszewski A. Skeletal muscle intracellular pO2 assessed by myoglobin desaturation: response to graded exercise. J Appl Physiol. 2001; 91: 2679-85.
12. Subudhi AW, Dimmen AC, Roach RC. Effects of acute hypoxia on cerebral and muscle oxygenation during incremental exercise. J Appl Physiol. 2007; 103: 177-83.
13. Hellsten Y, Ahlborg G, Jensen-Urstad M, Sjödin B. Indication of in vivo xanthine oxidase activity in human skeletal muscle during exercise. Acta Physiol Scand. 1988; 134: 159-60.
14. Hellsten Y, Hansson HA, Johnson L, Frandsen U, Sjödin B. Increased expression of xanthine oxidase and insulin-like growth factor I (IGF-I) immunoreactivity in skeletal muscle after strenuous exercise in humans. Acta Physiol Scand. 1996; 157: 191-7.
15. Viña J, Gimeno A, Sastre J, Desco C, Asensi M, Pallardó FV, et al. Mechanism of free radical production in exhaustive exercise in humans and rats; role of xanthine oxidase and protection by allopurinol. IUBMB Life. 2000; 49: 539-44.
16. Vollaard NBJ, Reeder BJ, Shearman JP, Menu P, Wilson MT, Cooper CE. A new sensitive assay reveals that hemoglobin is oxidatively modified in vivo. Free Radic Biol Med. 2005; 39: 1216-28.
17. Bonilla JF, Narváez R, Chuaire L. Sport as a cause of oxidative stress and hemolysis. Colomb Med. 2005; 36: 275-80.
18. Peake, J Suzuki K. Neutrophil activation, antioxidant supplements and exercise-induced oxidative stress. Exerc Immunol Rev. 2004; 10: 129-41.
19. Suzuki K, Sato H, Kikuchi T, Abe T, Nakaji S, Sugawara K, et al. Capacity of circulating neutrophils to produce reactive oxygen species alter exhaustive exercise. J Appl Physiol. 1996; 81: 1213-22.
20. Di Meo S, Venditti P. Mitochondria in exercise-induced oxidative stress. Biol Signals Recept. 2001; 10: 125-40.
21. Chandel NS, Budinger GR. The cellular basis for diverse responses to oxygen. Free Radic Biol Med. 2007; 42: 165-74.
22. Guzy RD, Schumacker PT. Oxygen sensing by mitochondria at complex III: the paradox of increased reactive oxygen species during hypoxia. Exp Physiol. 2006; 91: 807-19.
23. Ke Q, Costa M. Hipoxia-inducible factor 1 (HIF-1). Mol Pharmacol. 2006; 70: 1469-80.
24. Hirsila M, Koivunen P, Gunzler V, Kivirikko KI, Myllyharju J. Characterization of the human prolyl-4-hydroxylases that modify the hypoxia.inducible factor. J Biol Chem. 2003; 278: 30772-80.
25. Huang LE, Gu J, Schau M, Bunn HF. Regulation of hypoxia-inducible factor 1 alpha is mediated by an O2-dependent degradation domain via the ubiquitin-proteasome pathway. Proc Natl Acad Sci USA. 1998; 95: 7987-92.
26. Asikainen TM, Schneider BK, Waleh NS, Clyman RI, Ho WB, Flippin LA, et al. Activation of Hypoxia-inducible factors in hyperoxia through prolyl-4-hydroxylases blockade in cells and explants of primate lung. Proc Natl Acad Sci USA. 2005; 102: 10212-17.
27. Ameln H, Gustafsson T, Sundberg CJ, Okamoto K, Jansson E, Poellinger L, et al. Physiological activation of hypoxia inducible factor-1 in human skeletal muscle. FASEB J. 2005; 19: 1009-11.
28. Xu KY, Zweier JL, Becker LC. Oxygen-free radicals directly attack the ATP binding site of the cardiac Na/K-ATPase. Ann NY Acad Sci. 1997; 834: 680-3.
29. Xu KY, Zweier JL, Becker LC. Hydroxyl radicals inhibits sarcoplasmic reticulum Ca(2+)ATPase function by direct attack on the ATP binding site. Circ Res. 1997; 80: 76-81.
30. Könczöl F, Lorinczy D, Belagyi J. Effect of oxygen free radicals on myosin in muscle fibers. FEBS Lett. 1998; 427: 341-4.
31. Andrade FH, Reid MB, Allen DG, Westerblad H. Effect of hydrogen peroxide and dithiothreitol on contractile function of single skeletal muscle fibers from the mouse. J Physiol. 1998; 509: 567-75.
32. Reid MB. Redox modulation of skeletal muscle contraction: what we know and what we don´t. J Appl Physiol. 2001; 90: 724-31.
33. Andrade FS, Reid MB, Westerblad H. Contractile response to low peroxide concentrations: myofibrillar calcium sensivity as a likely target for redox-modulation os skeletal muscle function. FASEB J. 2000; 15: 309-11.
34. Tiidus PM, Houston ME. Vitamin E status and response to exercise training. Sports Med. 1995; 20: 12-23.
35. Beaton LJ, Allan DA, Tarnopolsky MA, Tiiuds PM, Phillips SM. Contraction-induced muscle damage is unaffected by vitamin E supplementation. Med Sci Sports Exerc. 2002; 34: 798-805.
36. Khassaf M, McArdle A, Esanu C, Vasilaki A, McArdle F, Griffiths RD, et al. Effect of vitamin C supplements on antioxidant defence and stress proteins in human lymphocytes and skeletal muscle. J Physiol. 2003; 549(Pt 2): 645-52.
37. Gómez-Cabrera MC, Doménech E, Romagnoli M, Arduini A, Borras C, Pallardo FV, et al. Oral administration of vitamin C decreases muscle mitochondrial biogénesis and ampres training-induced adaptations in endurance performance. Am J Clin Nutr. 2008; 87: 142-9.
38. Gómez-Cabrera MC, Martínez A, Santangelo G, Pallardo FV, Sastre J, Viña J. Oxidative stress in marathon runnners: interest of antioxidant supplmentation. Br J Nutr. 2006; 96 Suppl 1: 31-3.
39. Gómez-Cabrera MC, Borras C, Pallardo FV, Sastre J, Li JJ, Viña J. Decreasing xanthine-oxidase-mediated oxidative stress prevents useful cellular adaptations to exercise in rats. J Physiol. 2005; 567 (pt 1): 113-20.
40. Jackson ML. Free radicals generated by contracting muscle: By-products of metabolism or key regulators of muscle function? Free Radic Biol Med. 2008; 44: 132-41.
41. Braun B, Clarkson PM, Freedson PS, Kohl RL. Effects of coenzyme Q10 supplementation on exercise performance, VO2 max, and lipid peroxidation in trained cyclists. Int J Sport Nutr. 1991; 1: 353-65.
42. Bryant RJ, Ryder J, Martino P, Kim J, Carig BW. Effects of vitamin E and C supplementation alone or in combination on exercise-induced lipid peroxidation in trained cyclists. J Strength Cond Res. 2003; 17: 792-800.
43. Zhou S, Zhang Y, Davie A, Marshall-Gradisnik S, Hu H, Wang J, Brushett D. Muscle and plasma coenzyme Q10 concentration, aerobic power and exercise economy of healthy men in response to four weeks of supplementation. J Sports Med Phys Fitness. 2005; 45: 337-46.
44. Medved I, Brown MJ, Bjorksten AR, McKenna MJ. Effects of intravenous N-acetylcysteine infussion on time to fatigue and potassium regulation during prolonged cycling exercise. J Appl Physiol. 2004; 96: 211-17.
45. McKenna MJ, Medved I, Goodman CA, Brown MJ, Bjorksten AR, Murphy KT, et al. N-acetylcysteine attenuates the decline in muscle Na, K puma activity and delays fatigue during prolonged exercise in humans. J Appl Physiol. 2006; 576: 279-88.
46. Hildebrandt W, Alexander S, Bärtsch P, Dröge W. Effect of N-acetyl-cysteine on the hypoxic ventilatory response and erythropoietin production: linkage between plasma thiol redox state and O2 chemosensitivity. Blood. 2002; 99: 1552-5.
47. Sentman ML, Granström M, Jacobson H, Reaume A, Basu S, Marklund SL. Phenotypes of mice lacking extracellular superoxide dismutase and copper- and zinc-containing superoxide dismutase. J Biol Chem. 2006; 281: 6904-9.
48. McArdle A, Van Der Meulen J, Close GL, Pattwell D, Van Remmen H, Huang TT, et al. Role of mitochondrial super oxide dismutase in contraction-induced generation of reactive oxygen species in skeletal muscle extracellular space. Am J Physiol. (Cell Physiol) 2004; 286: C1152-C8.
49. Close GC, Ashton T, McArdle A, Jackson MJ. Microdialysis studies of extracellular reactive oxygen species in skeletal muscle: factors influencing the reduction of cytochrome c and hydroxylation of salicylate. Free Radic Biol Med. 2005; 39: 1460-7.
50. Servais S, Couturier K, Koubi H, Rouanet JL, Deplanches D, Sornay-Mayet MH, et al. Effect of voluntary exercise on H2O2 release by subsarcolemmal and intermyofibrillar mitochondria. Free Redic Biol Med. 2003; 35: 24-32.