Respuesta de una subpoblación de interneuronas y del transportador glial de glutamato GLT1 en la corteza contralateral a un foco isquémico
Adriana M. Medina, PhD1,2, Norberto García-Cairasco, MSc, PhD3, Martha Isabel Escobar, MSc1
1. Centro de Estudios Cerebrales, Facultad de Salud, Universidad del Valle; Cali, Colombia.
e-mail: maiesbe@yahoo.com
2. Neuroscience Laboratory, Michigan University, Ann Arbor, USA. e-mail: ammedina@umich.edu
3. Laboratorio de Neurofisiologia e Neuroetologia Experimental, Departamento de Fisiologia, Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo, Ribeirão Preto, Brasil. e-mail: ngcairas@fmrp.usp.br
Recibido para publicación diciembre 20, 2007 Aceptado para publicación junio 26, 2008
RESUMEN
Introducción: La isquemia cerebral es una de las formas de lesión cerebral mas frecuentes en el humano. Usualmente los investigadores cuando estudian su fisiopatología se centran en las áreas directamente comprometidas: región del foco, o en las zonas de penumbra, olvidando otros sectores vecinos o no del foco que están conectados con estos sectores de injuria, los cuales pueden estar implicados en algunos de los síntomas que se observan en los pacientes que sufren procesos isquémicos.
Objetivo: Evaluar el comportamiento laminar de una subpoblación de interneuronas y de la población glial de la corteza cerebral contralateral al foco isquémico, a través de los marcadores parvalbúmina (PV), que detecta neuronas gabaérgicas y del transportador glial de glutamato GLT1.
Materiales y métodos: Se ocluyó la arteria cerebral media derecha en ratas macho adultas, durante 90 minutos, utilizando una sutura intraluminal. Los animales se sacrificaron a las 24 y 72 horas post isquemia. El análisis se hizo en la corteza contralateral al foco, identificando interneuronas PV positivas y la expresión en astrocitos del transportador GLT1.
Resultados: Se encontró disminución significativa de la marcación del transportador de glutamato, GLT1, en las capas III y IV de la corteza contralateral al foco isquémico y un aumento en la expresión de PV en las capas II a V comparado con los animales controles.
Conclusiones: Los cambios en la expresión de GLT1 pueden proveer un nuevo estado de regulación de glutamato y un patrón diferente de actividad en áreas remotas a un foco isquémico. El aumento en la expresión de PV puede corresponder a un mecanismo adaptativo asociado al incremento de glutamato, por la disminución del transportador, en las envolturas gliales de las sinapsis. Este estudio representa un ejemplo de plasticidad neuronal y glial en zonas remotas al foco isquémico pero conectadas con el mismo.
Palabras clave: Parvalbúmina; Transportador glial de glutamato 1; Isquemia cerebral; Corteza contralateral; Plasticidad neuronal; Desconexión.
Contralateral cortical response of a subpopulation of interneurons and the glial glutamate transporter GLT1 to an ischemic core
SUMMARY
Introduction: Cerebral ischemia is an important cause of brain lesion in humans. The target in research has been the ischemic core or the penumbra zones; little attention has been given to areas outside the core or the penumbra but connected with the primary site of injury.
Objective: Evaluate the laminar response of a subpopulation of gabaergic cells, those that are parvalbumin (PV) positive and the astrocytes through the expression of the glial transporter GLT1 on the contralateral cortex to an ischemic core.
Methodology: For this purpose we used the medial cerebral artery occlusion model in rats. The artery was occluded for 90 minutes and the animals were sacrificed at 24 and 72 hours post-ischemia. The brains were removed, cut in a vibratome at 50 microns and incubated with the primary antibodies against PV or GLT1. Sections were developed using the vectastain Kit. In control tissue the primary antibody was omitted.
Results: When compared with control animals, treated ones show a decrease in the expression of GLT1, especially in layers III and IV of the contralateral cortex to the ischemic core. PV positive cells increases in layers II and V.
Conclusion: Increases in the expression of PV cells could correspond to an adaptation associated with glutamate increases in the synaptic compartment. These increases may be due to decreases in the expression of GLT1 transporter, that could not remove the glutamate present in the synaptic cleft, generating hyperactivity in the contralateral cortex. These changes could represent an example of neuronal and glial plasticity in remote areas to an ischemic core but connected to the primary site of injury.
Keywords: Parvalbumin; Ischemia; Stroke; Contralateral cortex; Plasticity; Disconnection.
La isquemia focal es una de las formas más frecuentes de lesión cerebral en humanos. Durante años los estudios se han dirigido a comprender la fisiopatología del foco isquémico y del área de penumbra. Por la amplia conectividad del sistema nervioso y los arreglos sinápticos precisos entre las células vecinas y la relación directa con células localizadas en áreas remotas, la lesión que ocurre en una región determinada del sistema nervioso central repercute directamente sobre zonas que no están involucradas en la injuria inicial, pero que reciben o pierden las aferencias de la región lesionada. Después de una lesión isquémica focal experimental se han descrito adaptaciones morfofuncionales y moleculares en la corteza contralateral1. Estos cambios involucran hiperexcitabilidad, cambios en la conformación de las espinas dendríticas y sobre-regulación en la expresión de varios genes, la mayoría de ellos asociados con plasticidad, señalización neuronal y factores de crecimiento. Se considera que en el ser humano los cambios remotos consecuentes a la isquemia pueden contribuir a la aparición de alteraciones neurológicas y neuropsiquiátricas tales como depresión, demencia y epilepsia, los cuales no en todos los casos pueden correlacionarse con el sitio primario de lesión2.
Los cambios observados en las zonas distantes al foco lesional se denominan cambios remotos o diasquisis3 que se pueden clasificar en cuatro niveles de acuerdo con el mecanismo de injuria:
1. Cambios remotos originados por edema cerebral.
2. Cambios remotos atribuibles a depresión diseminada (spreading depression)
3. Cambios remotos en áreas de proyección
4. Cambios remotos debidos a plasticidad reactiva y efectos sistémicos3.
El presente trabajo se centra en el tercer mecanismo, basándose en el conocimiento existente sobre la conectividad cortical y el fenómeno de la diasquisis. El propósito de este trabajo es analizar los cambios que ocurren en una subpoblación de interneuronas gabaérgicas y en los astrocitos localizados en la corteza cerebral contralateral a un foco isquémico, mediante un anticuerpo contra la proteína atrapadora de calcio parvoalbúmina (PV), que es específica de interneuronas gabaérgicas y el transportador glial de glutamato GLT1.
La hipótesis se basa en que una lesión focal de la corteza se debe reflejar en la corteza opuesta:
1. En interneuronas de la corteza contralateral que recibe aferentes comisurales y
2. En la población de astrocitos que expresan GLT1, el cual remueve 90% del glutamato presente en las interacciones sinápticas excitatorias.
Se espera que haya variaciones interlaminares en la expresión inmunohistoquímica de parvalbúmina y del transportador GLT1, considerando que si bien existen interacciones interlaminares en la corteza, en cada lámina hay variantes en la relación entre interneuronas y patrones de conectividad aferente y eferente.
MATERIALES Y MÉTODOS
Los experimentos se realizaron en ratas macho Wistar con un peso promedio entre 280-350 g, las cuales se obtuvieron del Bioterio de la Facultad de Salud de la Universidad del Valle. Los animales se mantuvieron en un ciclo de 12:12 horas de luz-oscuridad y recibieron comida y agua ad libitum. Todos los procedimientos y el protocolo experimental fueron aprobados por el Comité de Ética en Experimentación Animal de la Facultad de Salud, Universidad del Valle.
Procedimiento quirúrgico. Los animales se anestesiaron con una mezcla de ketamina-xilazina (50 mg/ml; 2 mg/ml; 0.8 mg/kg) por vía intraperitoneal. Se mantuvieron en una temperatura rectal de 37+0.5ºC con la ayuda de una lámpara de calor. Bajo microscopía estereotáxica, se disecó la vasculatura del cuello exponiendo la arteria carótida común derecha hasta la bifurcación, se disecó y ligó la arteria carótida externa (ACE), luego se disecó la arteria carótida interna (ACI), se separó del nervio vago adyacente y se interrumpió el flujo sanguíneo de la arteria pterigopalatina suturándola a nivel de su origen con un monofilamento de nylon 4-0. La isquemia focal se indujo siguiendo el protocolo de Longa4, de la siguiente manera: se utilizó un monofilamento de nylon 4-0 (Ethilon ®, Ethicon® Co, Inc) cubierta previamente con una solución de poli-l-lisina (0.1% (peso/volumen) (Sigma®), preparado en agua desionizada y secado durante una hora a 60°C. El monofilamento se introdujo 18 mm desde la arteria carótida externa derecha hacia la carótida interna (ACI) hasta alcanzar la parte inicial del segmento de la arteria cerebral media derecha (ACM). La ACE se suturó con un nylon 5-0 en el lugar donde se introdujo la sutura para prevenir la hemorragia. La incisión en el cuello se cerró con seda calibre 3-0. El monofilamento se dejó en su lugar durante 90 minutos y luego se removió para permitir la reperfusión. Los animales control se trataron con los mismos protocolos de anestesia y quirúrgico sin introducción del monofilamento intraluminal. Los animales que mostraron síntomas neurológicos (ver escala), se seleccionaron para el análisis inmunohistoquímico.
A las 2, 8 y 12 horas de isquemia se realizó la prueba neurológica para evaluar la adecuada oclusión de la arteria cerebral media derecha, con la escala de 4 puntos de Longa4:
1. Falla para extender completamente la pata izquierda.
2. Movimientos circulares hacia la izquierda.
3. Caídas hacia el lado izquierdo.
4. Pérdida de movimientos espontáneos con disminución del nivel de conciencia.
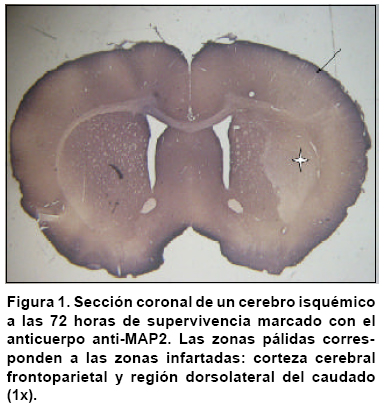
Protocolo inmunohistoquímico. Los animales se prefundieron a las 24 y 72 horas posteriores a la isquemia (n=5), con una mezcla de paraformaldehido, lisina y periodato de sodio (PLP, pH: 7.4) por vía intracardíaca. Con el mismo protocolo de anestesia con ketamina-xilazina (50 mg/ml; 2 mg/ml; 0.8 mg/kg) se perfundieron los animales por vía intracardíaca. Los animales utilizados para evaluar la expresión de PV y GLT1 se agruparon para el sacrificio a las 24 y 72 horas posteriores a la isquemia (n=5), se perfundieron utilizando una mezcla de paraformaldehido, lisina y periodato de sodio (PLP, pH: 7.4). Los cerebros se removieron y se dejaron en el mismo fijador por 24 horas a 4ºC. Por medio de un vibrátomo (Lancer) se obtuvieron secciones coronales seriadas (50 µm), utilizando como referencia la comisura blanca anterior, la región anterior del hipotálamo, el estriado y el pálido ventral, este nivel corresponde a las coordenadas interaural 9.2 mm, bregma 0.2 mm. Para confirmar las alteraciones histopatológicas, se utilizó marcación inmunohistoquímica para la proteína asociada con microtúbulos 2 (MAP2, Kosik, Santa Bárbara CA, diluido 1:100 PBS/TritonX100), la cual es un marcador de injuria neuronal (Figura 1) y NeuN (Chemicon) (1:2500 PBS/TritonX100 0.5%), que marca las poblaciones neuronales, con el propósito de definir claramente el espesor de cada lámina cortical. Los individuos que mostraron alteraciones histológicas por este criterio fueron los que se utilizaron en este estudio.
Con el propósito de identificar neuronas positivas para PV y para GLT1, las secciones flotantes se incubaron durante 12 horas en anti-PV (Sigma®), diluido 1:5000 PBS/triton X-100 y en anti-GLT1 (Novo Castra®) diluido 1:40 en PBS. Se escogió examinar el comportamiento del marcador GLT1 in situ, por los informes sobre labilidad de los transportadores de glutamato en tejido homogenizado. La marcación para ambos anticuerpos se reveló utilizando avidina-biotina siguiendo las instrucciones del fabricante (Vectastain® CA). La actividad de la peroxidasa se reveló, utilizando 3.3 diaminobencidina como cromógeno con peróxido de hidrógeno al 0.01% y contrastando después con níquel. Los animales control (n=5), se procesaron simultáneamente, omitiendo la incubación con el anticuerpo primario.
Análisis a microscopía de luz. Se seleccionaron los cortes de la corteza frontoparietal, que corresponde al área sensoriomotora, porque en el modelo de isquemia utilizado por los autores, el foco isquémico comprende estas áreas corticales y un sector de la región dorso-lateral del caudado. Además, se analizó cualitativamente la región del cíngulo tanto ipsi como contra-lateral, teniendo en cuenta que estas dos regiones están conectadas entre si por fibras comisurales, pero que no corresponden a regiones infartadas por la oclusión de la arteria cerebral media. Los cortes se fotografíaron con una cámara digital Cannon® Power Shot S30 adaptada a un microscopio de luz (Olympus® CH-2 optical modelo CHS). Las imágenes a analizar se lograron mediante la composición de fotografías consecutivas, las cuales se fusionaron digitalmente con el programa Photo Stich® versión 3.1 (2000). Las imágenes obtenidas representaban el espesor completo de la corteza cerebral, sobre las cuales se realizaron los conteos correspondientes utilizando el programa SigmaScan-Pro® 5. Para el procedimiento cuantitativo se hicieron cajones de 100 x 500 micras (100 en el plano coronal y 500 en el plano tangencial). Se tuvo como criterio colocar el cajón en el centro de cada lámina. Para cumplir este criterio la guía fue el espesor de cada lámina determinado en cortes coronales teñidos con NeuN (marcador neuronal), acoplados con los cortes sucesivos para PV y GLT1 y así asegurar la ubicación laminar.
Los datos se analizaron con ANOVA de una vía, seguido por el post-prueba de Neuman Keuls. Se consideraron estadísticamente significativos valores de p<0.05.
RESULTADOS
De los 25 animales operados, 15 presentaron déficit neurológico al recuperarse de la anestesia, llegando a los grados 1, 2 y 3 después del período de recuperación. No se utilizaron animales en el grado 4 (n=10), por su baja supervivencia. Se realizaron cortes coronales sucesivos a partir de la comisura blanca anterior, para hacer el análisis con los marcadores seleccionados teniendo en cuenta las coordenadas mencionadas antes. La región examinada correspondió a la corteza fronto-parietal contra-lateral (izquierda), que se relaciona con la corteza isquémica en espejo. En cada caso la primera sección procesada con el anticuerpo anti-MAP2, permitió medir el tamaño del infarto, aproximadamente 30.8%, que incluyó tanto la corteza fronto-parietal como el caudado putamen (Figura 1). Los cortes teñidos con NeuN permitieron medir el espesor de las láminas con el propósito de facilitar la cuantificación celular en cada capa (Cuadro 1).
Observaciones en el cíngulo. Como se partió de la premisa de que el infarto producido en el hemisferio derecho puede afectar a la corteza contra-lateral del hemisferio izquierdo, se examinó la región del cíngulo diferente al foco y a la penumbra isquémica para observar el comportamiento de los marcadores seleccionados en el modelo. La lesión isquémica no mostró diferencias cualitativas en el cíngulo del hemisferio isquémico ni en el del hemisferio contralateral (Figura 2), mientras que los cambios para PV y GLT1 en las regiones contra-laterales al foco isquémico fueron muy notables, por tanto se decidió hacer una evaluación cuantitativa lámina por lámina de las regiones remotas y establecer la progresión de estos cambios con el tiempo de supervivencia.
Distribución de PV y de GLT1 en la corteza cerebral normal. En la corteza fronto-parietal de animales controles, las neuronas positivas para PV muestran un patrón laminar específico. Es importante mencionar que la capa I carece de células positivas para PV, en su lugar se observa una considerable inmunorreactividad representada en neuritas probablemente pertenecientes a neuronas localizadas en capas inferiores o derivadas de regiones subcorticales. Las capas II a la VI, muestran células positivas para PV con un cuerpo bien definido y procesos dendríticos y axones con diversa orientación claramente marcados. La mayoría de estas células se clasificaron como células en candelabro y células en cesta. El número de cuerpos celulares inmunorreactivos es bajo en las capas II y VI, intermedio en la capa III y alto en las capas IV, V.
La inmunorreactividad para GLT1 se observa homogéneamente distribuida en todas las capas corticales, las células inmunopositivas aparecen como anillos a partir de los cuales emergen procesos cortos.
Inmunorreactividad para PV y GLT1 en la corteza cerebral contralateral al foco isquémico. Mientras que en los controles las neuronas positivas para PV predominan en las capas IV y V, en la corteza contra-lateral al foco isquémico se observa un aumento notorio en la inmunorreactividad a PV en las neuronas de las capas II-III (Figura 3 y Gráfica 1). En la corteza contra-lateral se observa una disminución en la inmunorreactividad para GLT1 en todas las láminas analizadas en los diferentes tiempos de supervivencia; esta reducción es notable en las láminas medio corticales, sobre todo en la lámina III (Figura 4 y Gráfica 2).
Variaciones laminares en la expresión de PV y GLT1 en la corteza contralateral
Lámina I: Como la lámina I carece de cuerpos celulares inmunorreactivos para PV, no se consideró esta capa en el análisis cuantitativo. La inmunorreactividad para GLT1 aparece cualtitativamente disminuída; sin embargo, no se encontraron diferencias en el conteo celular.Lámina II: El número de células positivas para PV aumentó a las 24 y a las 72 horas, y no se presentaron cambios en la expresión de GLT1.Lámina III: El número de células inmunorreactivas para PV se incrementó a las 24 y a las 72 horas y la expresión de GLT1 disminuyó en ambos tiempos de supervivencia.Lámina IV: La inmunorreactividad para PV aumentó a las 24 horas de supervivencia; este incremento fue aún mayor a las 72 horas. Por su parte la inmunorreactividad para GLT1 disminuyó únicamente a las 72 horas de supervivencia.Lámina V: En esta lámina la inmunorreactividad para PV se incrementó a las 24 y 72 horas de supervivencia, mientras que la expresión de GLT1 no presentó cambios.Lámina VI: La inmunorreactividad para PV y para GLT1 no cambió en ninguno de los tiempos analizados.
En resumen, las células inmunorreactivas para PV se aumentaron en las capas II, III, IV y V y permanecieron constantes en la lámina VI. La expresión de GLT1 disminuyó en la capa III en los dos tiempos de supervivencia analizados (24 y 72 horas) y en la capa IV disminuyó sólo a las 72 horas. La expresión de GLT1 no cambia en las capas I, II, V y VI.
DISCUSIÓN
La mayor parte de las interneuronas de la corteza cerebral expresan proteínas atrapadoras de calcio. Entre éstas la calbindina D28K, la calretinina y la parvalbúmina se expresan en interneuronas gabaérgicas y en ellas contribuyen a mantener la homeostasis del calcio5. Se han utilizado procedimientos inmunohistoquímicos para identificar los diferentes tipos de células gabaérgicas presentes en la corteza, teniendo en cuenta que cada proteína se encuentra en diferentes tipos neuronales, con muy poca coexpresión6.
La parvalbúmina se encuentra en células en cesta y en células en candelabro7. Estas células realizan contacto sináptico con el soma y el segmento inicial del axón de neuronas piramidales respectivamente. Las células en cesta forman una importante red inhibitoria de la corteza cerebral, debido a su localización estratégica cerca de los cuerpos de las neuronas piramidales, donde controlan y sincronizan las salidas de las células piramidales. Se ha demostrado que en el hipocampo y en la neocorteza las neuronas gabaérgicas positivas para PV forman una red dual conectada por medio de uniones laxas (gap junctions) y sinapsis químicas entre ellas de tipo inhibitorio. Las primeras son importantes para mantener la sincronía y las últimas pueden estar implicadas en la generación de la actividad oscilatoria en el rango de la frecuencia gama8.
En el presente estudio se demuestran incrementos en la expresión de PV en la corteza contralateral a un foco isquémico posterior a la oclusión de la arteria cerebral media en ratas y disminución en la expresión de GLT1 particularmente en la lámina III cortical. La parvalbúmina es una proteína perteneciente a la familia EF-hand, conformada por un conjunto de proteínas atrapadoras de calcio que como se mencionó antes están implicadas en la transducción directa de señales mediadas por calcio y en el control de su homeostasis5. Varios autores han informado que las proteínas atrapadoras de calcio como calbindina D28K, calretinina y parvalbúmina, tienen un papel neuroprotector al actuar como amortiguadores de calcio que atenúan la sobrecarga inducida por fenómenos excitotóxicos generados por la lesión isquémica9. Sin embargo, este papel ha sido controvertido, sobre todo en el caso de la PV.
Existen informes que indican que el papel de la PV puede ir desde protector hasta tener un efecto deletéreo, por ejemplo en cultivos celulares de neuronas corticales la expresión de parvalbúmina se incrementa con la neurotoxicidad inducida por un agonista del glutamato el N-metil-D-aspartato10. También se ha informado que la expresión inmunohistoquímica de PV puede cambiar en diferentes condiciones experimentales y en diferentes regiones del sistema nervioso. Después de deprivación olfatoria por oclusión unilateral de las nares realizado en ratas y evaluadas dos meses después de la oclusión, se encontró un incremento significativo ipsi y contra-lateral de células positivas a PV en los núcleos olfatorios anteriores dorsal y lateral respectivamente11. Lo anterior indica que la actividad regula la expresión de las proteínas atrapadoras de calcio. Los resultados del presente trabajo muestran un incremento general en el número de neuronas que expresan PV en las capas II, III, IV y V en la corteza contralateral a un foco isquémico. Los autores consideran que estos cambios pueden ser el resultado de la desconexión parcial por pérdida de circuitos comisurales y de probables mecanismos de reorganización sináptica inducidos por el proceso isquémico. En la rata las fibras comisurales se originan en neuronas localizadas en las capas III y V, estos axones son glutamatérgicos y terminan en las capas II-III y V-VI12. Aunque la mayor parte de las fibras comisurales terminan sobre espinas dendríticas de neuronas piramidales, también conectan neuronas gabaérgicas, en especial células en cesta y en candelabro, las cuales expresan parvalbúmina12. Estas interacciones sinápticas son relevantes como una fuente de inhibición, que modulan la actividad de la corteza cerebral.
Teniendo en cuenta que la isquemia focal genera muerte celular en la región del foco, si las neuronas piramidales del foco mueren, los axones que terminan en la corteza contra-lateral se degeneran, causando una disminución de la estimulación de las células en cesta y en candelabro, pero al mismo tiempo dejando vacantes sinápticas que pueden ser ocupadas por axones recurrentes de células piramidales vecinas, por fibras asociativas del mismo hemisferio o por aferentes talámicas, todas las anteriores de carácter excitatorio.
En el presente estudio no hay evidencia directa de esta reorganización sináptica, pero es una posibilidad que es necesario explorar con experimentos nuevos y más amplios. También es necesario señalar que las neuronas comisurales que se proyectan desde la corteza contralateral (exofocales) al foco isquémico, no podrán entonces realizar contactos sinápticos sobre sus blancos específicos. Este nuevo estado implica un contexto morfológico y funcional diferente, que puede inducir cambios espaciales y temporales en la expresión de parvalbúmina, como los demostrados en este estudio, donde se observan variantes en la expresión de PV entre las 24 y 72 horas de supervivencia postisquémica. Es importante anotar que las cortezas ipsi y contra-lateral del giro cíngulo, no presentaron cambios obvios en la expresión de parvoalbúmina como los que ocurren en la corteza contra-lateral al foco. Se podría especular que una diferencia en el sistema de circuitos corticales ipsilaterales vs. los comisurales podrían explicar las discrepancias, sin embargo, esto requiere confirmación experimental más directa.
Los cambios en la expresión inmunohistoquímica de parvalbúmina descritas en el presente trabajo, nos permiten plantear que la señal para la inducción de los cambios remotos implicaría procesos de hiperactividad glutamatérgica en las zonas de injuria, con incrementos en la liberación de glutamato en las regiones remotas.
Expresión de GLT1 después de isquemia en la corteza contra-lateral. La pérdida de la homeostasis de glutamato está involucrada en el inicio de varias condiciones neurológicas incluyendo isquemia cerebral. La homeostasis del glutamato es regulada principalmente por una familia de transportadores de membrana conocidos como transportadores para aminoácidos excitatorios13. Esta familia de proteínas incluye cinco miembros: GLAST (también conocido como EAAT 1), transportador glial encontrado sobre todo en el cerebelo; GLT 1 (o EAAT2), el principal transportador glial del telencéfalo, EAAC1 (o EAAT3), transportador neuronal también de localización en el telencéfalo, EAAT 4, transportador neuronal del cerebelo y el transportador EAAT 5, un transportador neuronalglial presente en la retina14.
Las alteraciones en la recaptura de glutamato debida a cambios en la expresión o función de los transportadores de glutamato se han considerado como una causa de la hiperexcitabilidad15.
Teniendo en cuenta que la lesión isquémica afecta a las proyecciones comisurales, las cuales realizan contactos sinápticos en la corteza contralateral sobre neuronas piramidales y no piramidales y que alrededor de estas sinapsis se encuentra dispuesta una envoltura glial, la cual a través de la presencia de transportadores de glutamato se encarga de mantener la homeostasis del neurotransmisor, se miró además, cómo la isquemia afecta el comportamiento de este transportador en la corteza contra-lateral al foco isquémico.
Se han demostrado cambios en la expresión del transportador GLT1 en diferentes entidades dependiendo de los modelos utilizados, del procedimiento experimental o de las condiciones patológicas. Estos cambios son más evidentes en unas áreas que en otras. Después de isquemia global transitoria en ratas se ha observado que la expresión del RNAm para GLT1 disminuye en la región CA1 del hipocampo y en la región CA3 disminuye sólo en períodos tempranos de supervivencia (día 1)15. Los datos anteriores indican selectividad y especificidad regional en la expresión del transportador GLT1 después de isquemia global. Posterior a isquemia focal transitoria, se ha descrito que los niveles de proteínas y de la expresión del RNAm para GLT1 y EAAC1 disminuyen significativamente (entre 36% y 56%) en el hemisferio isquémico al compararlo con la corteza contra-lateral o con los especímenes control16.
En el presente estudio se observó una disminución significativa en la expresión inmunohistoquímica de GLT1 en la corteza cerebral contra-lateral al foco isquémico, después de oclusión de la arteria cerebral media en ratas. Los resultados muestran una disminución de la inmunorreactividad para GLT1 en las láminas III y IV de la corteza cerebral, mientras que en las capas I, II, V y VI no se observan cambios significativos. En la lámina III la disminución de la inmunorreactividad para GLT1 se inicia a las 24 horas y continúa disminuyendo hasta las 72 horas, mientras que en la capa IV sólo disminuye de manera significativa a las 72 horas. Es posible que la disminución en la expresión de GLT1 en las capas III y IV sea el resultado de la deaferentación de las fibras comisurales que se origina a partir de estas láminas. Otras láminas como la II, V y VI no muestran ningún cambio, posiblemente porque la capa II da lugar a fibras corticocorticales ipsilaterales, la capa V a fibras corticoestriatales y la capa VI a proyecciones corticotalámicas17, de tal manera que los axones que se originan en estas capas no estarían en directa relación con el sitio de la lesión.
Se ha demostrado en cultivos celulares que los astrocitos expresan la proteína GLT1 sólo en la presencia de neuronas. Existe también la evidencia in vivo de que la expresión de GLT1 requiere de la interacción glianeurona. En isquemia cerebral transitoria se observa una correlación positiva entre la pérdida de neuronas piramidales de la región CA3 y la disminución de la proteína y del RNAm para GLT115. En el hemisferio no lesionado la regulación por lo bajo de GLT1, puede obedecer a otros factores diferentes a los que se observan en el hemisferio lesionado.
Se ha descrito ampliamente que la isquemia cerebral focal puede también afectar la función de amplias regiones dentro del mismo hemisferio y del hemisferio contra-lateral, además de las regiones directamente lesionadas por la reducción del flujo sanguíneo. Después de oclusión permanente de la arteria cerebral media se ha descrito en humanos incrementos en la excitabilidad de la corteza contra-lateral. En pacientes con infarto cortical se observa sobre-activación de áreas bilaterales motoras y no motoras18. Un aumento bilateral en la activación de la red motora puede representar un incremento en el reclutamiento de redes neuronales.
Los cambios demostrados en la expresión de GLT1 en el presente trabajo, podrían contribuir a los incrementos en la actividad eléctrica de la corteza contra-lateral al foco isquémico, causado por aumentos moderados en las concentraciones de glutamato.
Como ya se mencionó la expresión de GLT1 por los astrocitos sólo se da en la presencia de neuronas. El péptido pituitario activador de la adenilciclasa (PACAP) es un conocido modulador de la señalización glutamatérgica. Este péptido es esencial para que se exprese el transportador GLT1 en la corteza cerebral19. Con base en los resultados del presente artículo se propone que la desconexión procedente de las regiones isquémicas puede llevar a una disminución en los niveles de PACAP, lo cual puede producir una baja en los niveles de GLT1. Lo anterior ocasionaría un moderado aumento en la concentración de glutamato. La disminución de los niveles de GLT1 lámina específica (III y IV), el incremento en la expresión de PV y en la actividad eléctrica informada por otros20, pueden indicar adaptaciones morfofuncionales en el hemisferio contra-lateral a un foco isquémico. En conclusión, después de isquemia focal, los cambios en la expresión de GLT1 pueden proveer un nuevo estado de regulación de glutamato y un patrón diferente de actividad. Por otro lado los incrementos en la expresión de PV pueden reflejar un mecanismo compensatorio en respuesta a la actividad de glutamato. Estos cambios son más relevantes en la lámina III. Aunque los aumentos en la expresión de PV no se pueden correlacionar con los de la actividad gabaérgica, estos podrían vincularse a cambios en la actividad glutamatérgica provistos por la reorganización sináptica.
AGRADECIMIENTOS
Los autores desean expresar su agradecimiento al doctor Hernán José Pimienta por la revisión crítica del manuscrito. Al doctor Efraín Buriticá por el apoyo en el manejo del software y en el análisis de las imágenes. Este estudio se realizó gracias al apoyo financiero de COLCIENCIAS, proyecto N° 1106-04-11990 y de la Universidad del Valle. El doctor Norberto García-Cairasco recibió apoyo de las fundaciones Brasileras FAPESP, CNPq y PRONEX.
REFERENCIAS
1. Arango-Dávila C, Escobar-Betancourt M, Cardona-Gómez GP, Pimienta-Jiménez H. Fisiopatología de la isquemia cerebral focal: Aspectos básicas y proyección a la clínica. Rev Neurol. 2004; 39: 156-65.
2. Angeleri F, Angeleri VA, Foschi N, Giaquintos S, Nolfe G. The influence of depression, social activity and family stress on functional outcome after stroke. Stroke. 1993; 24: 1478-83.
3. Witte O, Stoll G. Delayed and remote effects of focal cortical infarctions: secondary damage and reactive plasticity. Adv Neurol. 1997; 73: 207-27.
4. Longa EZ, Wenstein PR, Carlson S, Cummins R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 1989; 20: 84-91.
5. Hof P, Glexer I, Condé F, Flagg R, Rubin M, Nimchinsky E, et al. Cellular distribution of the calcium-binding proteins parvalbumin, calbindin, and calretinin in the neocortex of mammals: phylogenetic and developmental patterns. J Chem Neuroanat. 1999; 16: 77-116.
6. Kawaguchi Y, Kondo S. Parvoalbumin, somatostatin and cholcecystokinin as chemicals markers for specific gabaergic interneuron types in the rat frontal cortex. J Neurocytol. 2002; 31: 277-87.
7. DeFelipe J, Jones EG. Parvoalbumin immunoreactivity reveals layer IV of monkey cerebral cortex as a mosaic of microzones of thalamic afferent terminations. Brain Res. 1991; 562: 39-47.
8. Fukuda T, Kosaka T. Ultraestructural study of gap junctions between dendrites of parvoalbumin-containing gabaergic neurons in various neocortical areas of the adult rat. Neuroscience. 2003; 120: 5-20.
9. Figueredo-Cárdenas G, Harris CL, Anderson KD, Reiner A. Relative resistance of striatal neurons containing calbindin or parvalbumin in quinolenic acid mediated excitotoxicity compared to other striatal neuron types. Exp Neurol. 1998; 149: 356-72.
10. Hartley DM, Neve RL, Bryan J, Ullrey DB, Bask SY, Lang P, et al. Expression of the calbinding-binding proteins, parvalbumin in cultured cortical neurons using a HSV-1 vector system enhances NMDA neurotoxicity. Mol Brain Res. 1996; 40: 285-96.
11. Barbado MV, Briñón JG, Weruaga E, Porteros A, Arévalo R, Aijón J, et al. Changes in immunoreactivity to calcium-binding proteins in the anterior olfactory nucleus of the rat after neonatal olfactory deprivation. Exp Neurol. 2002; 177: 133-50.
12. Innocenti GM. General organization of callosal connections in the cerebral cortex. In: Jones EG, Peters A, Editors. Cerebral cortex. Vol 5. Sensory-motor areas and aspects of cortical connectivity. New York: Ed Plenum Press; 1986. p. 291-354.
13. Gegelashvili G, Schousboe A. High affinity glutamate transporters: regulation of expression and activity. Mol Pharmacol. 1997; 52: 6-15.
14. Bar-Peled O, Ben-Hur H, Biegon A, Groner Y, Dewhurst S, Furuta A, et al. Distribution of glutamate trasnporter subtypes during human brain development. J Neurochem. 1997; 69: 2571-80.
15. Bruhn T, Levy LM, Nielsen M, Chistensen T, Johansen FF, Diemer NH. Ischemia induced changes in expression od the astrocyte glutamate transporter GLT-1 in hippocampus of the rat. Neurochem Int. 2000; 37: 277-85.
16. Rao VL, Bowen KK, Dempsey RJ. Transient focal cerebral ischemia down-regulates glutamate transporters GLT-1 and EAAC1 expression in rat brain. Neurochem Res. 2001; 26: 497-502.
17. Valverde F. Estructura de la corteza cerebral. Organización intrínseca y análisis comparativo del neocortex. Rev Neurol. 2002; 34: 758-80.
18. Cao Y, Olhaberriague LD, Vikingstad EM, Levine SR, Welch KM. Pilot study of functional MRI to assess cerebral activation of motor function after poststroke hemiparesis. Stroke. 1998: 112-22.
19. Figiel M, Engele J. Pituitary adenylate cyclase-activating polypeptide (PACAP), a neuron-derived peptide regulating glial glutamate transport and metabolism. J Neurosci. 2000; 20: 3596-605.
20. Neumann-Haefelin T, Witte OW. Periinfarct and remote excitability changes after transient middle cerebral artery occlusion. J Cereb Blood Flow Metab. 2000; 20: 45-52.
LISTA ABREVIATURAS
PV: Parvalbúmina
GLT1: Transportador de glutamato 1
PACAP: Péptido pituitario activador de la adenilciclasa
CA3: Cuerno de Amón 3
NeuN: Antígeno nuclear neuronal
MAP2: Proteína asociada con microtúbulos 2