Caracterización de un modelo organotípico de cultivos de neuronas corticales de humano derivadas de trauma craneoencefálico
David Riascos, MD1, Francisco Guzmán, MD1,2, Efraín Buriticá, MSc3, Mauricio Palacios, MD, MSc4, Martha Isabel Escobar, MSc5, Hernán Pimienta, MSc6
1. Estudiante de Maestría, Centro de Estudios Cerebrales, Universidad del Valle, Cali, Colombia. e-mail: davisdarm@gmx.net
2. Investigador, Centro de Estudios Cerebrales, Universidad del Valle, Cali, Colombia. e-mail: frangupe@hotmail.com
3. Estudiante de doctorado, Centro de Estudios Cerebrales, Universidad del Valle, Cali, Colombia. e-mail: triburi@yahoo.com
4. Profesor Asistente, Sección de Farmacología, Escuela de Ciencias Básicas, Facultad de Salud, Universidad del Valle, Cali, Colombia. e-mail: maopalacios@yahoo.com
5. Profesora Titular, Investigadora Centro de Estudios Cerebrales, Universidad del Valle, Cali, Colombia.
6. Profesor Distinguido, Director Centro de Estudios Cerebrales, Facultad de Salud, Universidad del Valle, Cali, Colombia. e-mail: hernpim@yahoo.com
Recibido para publicación diciembre 20, 2007 Aceptado para publicación junio 26, 2008
RESUMEN
Introducción: El trauma craneoencefálico (TEC) es un problema de salud global que puede generar en los pacientes que lo padecen, muerte, discapacidad y/o alteraciones psiquiátricas con gran impacto sobre su desempeño posterior y sobre su ámbito familiar. En los últimos años se ha avanzado en el conocimiento de los mecanismos fisiopatológicos que subyacen al TCE. Sin embargo, esto no está completamente entendido, como tampoco hay claridad sobre los mecanismos de neuroprotección. Por esta razón cada vez más se buscan modelos que permitan aproximarse al estudio de este síndrome y de esta manera aproximarse a la neuroprotección.
Objetivo: Caracterizar un modelo de cultivo organotípico de neuronas corticales humanas obtenidas de personas que sufrieron TCE y a las cuales se les practicó remoción de la contusión.
Metodología: Se utilizó tejido cortical humano procedente de 4 individuos que sufrieron TCE y a los cuales se les removió la contusión. Se obtuvieron tajadas de corteza cerebral de 1,500-2,000 mm, las cuales se mantuvieron en un flujo continuo de LCRa a 2 ml/min y una mezcla gaseosa de O2 al 95% y CO2 al 5% con burbujeo permanente durante 2, 8 y 14 horas. Se tomó como tiempo cero el momento de obtención de la muestra. Después de cada tiempo se tomaron las tajadas, se cortaron en un vibrátomo de medio líquido a 50 mm y se procesaron inmunohistoquímicamente con los marcadores neuronales de degeneración NeuN y MAP2.
Resultados: Los resultados indican que las muestras de corteza cerebral se pudieron mantener con cierto grado de integridad celular y laminar hasta las 2 horas de cultivo. Se observó que a partir de este tiempo se inicia un proceso de alteración de la citoarquitectura neuronal y laminar, determinada por la pérdida y alteración de la inmunorreactividad a los marcadores NeuN y MAP2. Además se encontró que hay vulnerabilidad celular que compromete en mayor medida a las neuronas localizadas en las láminas corticales III y V.
Conclusiones: Se pudo caracterizar el modelo organotípico de cultivo de neuronas corticales humanas que determinó integridad neuronal y organización laminar clara hasta las 2 horas de evolución, lo cual permitiría la utilización de fármacos neuroprotectores durante este período. Se encontró vulnerabilidad laminar preferencialmente para las capas corticales III y V. El modelo dejó establecer la evolución temporal de las neuronas de la zona contusa.
Palabras clave: Cultivos organotípicos; NeuN; MAP2; Degeneración; Corteza cerebral.
Organotypic human neuronal culture derived from traumatic brain injury
SUMMARY
Introduction: Traumatic brain injury is a global medical problem whose survivors may show disability and neurological or psychiatric sequelae. In the last few years the knowledge of physiopathological mechanisms of TBI has increase but still it is not entirely known. For this reason the research has turn over in one´s mind in new strategies to study this pathology looking for neuroprotection.
Objective: The aim of this work is to develop an organotypic culture of cortical human neurons derived from a contusion tissue obtain from patients that suffered TBI.
Methodology: We used contused brain tissue from 4 TBI patients. Sections between 1,500-2,000 mm were kept in a continuous flow of aCSF 2 ml/min in a mixture of 95% O2 and 5% CO2 for 2, 8 and 14 hours. The initial time (0 hours) was the tissue extraction time. From blocks, sections of 50 mm were obtained and processed for immunocytochemistry to NeuN and MAP2.
Results: The results show that organotypic cultures keep neuron integrity and laminar organization in the cerebral cortex slices from 0 to 2 hours. From this time ahead neuronal morphology and laminar organization is altered especially in neurons located on layers III and V.
Conclusions: Organotypic culture could be maintained from 0-2 hours. Neuronal and laminar integrity could be demonstrated. The model lead to study neuronal behaviour after TBI through different survival times. Laminar selective vulnerability was demonstrated for layers III and V.
Keywords: Organotypic cultures; NeuN; MAP2; Degeneration; Cerebral cortex.
Los estudios histopatológicos y moleculares sobre trauma craneoencefálico (TCE) en general se realizan en modelos experimentales, unos pocos utilizan tejido humano en general post-mortem o derivados de cirugía de epilepsia. Uno de los principales problemas con que se encuentran los investigadores es la heterogeneidad de la respuesta al trauma, lo que ha hecho que las medidas neuroprotectoras no hayan sido efectivas hasta el momento. Por lo anterior, se busca aproximación al problema a través de un modelo que permita visualizar la evolución del evento traumático.
En la literatura existen varios modelos experimentales in vivo e in vitro que estudian la biología molecular y celular del trauma cerebral (TC), cada uno de ellos con ventajas y desventajas en relación con su capacidad para replicar el fenómeno fielmente1. La principal limitación como se mencionó antes, es la heterogeneidad asociada con el evento mecánico, con las características intrínsecas del sujeto que lo padece y con la organización del tejido cerebral lesionado. Con respecto al evento mecánico este es particular para cada caso, en variables como la localización (focal, difuso), la intensidad (leve, moderado, severo) y el mecanismo de acción (inercial, o por impacto)2.
Por otra parte, cada cerebro es único, si bien con una caracterización general de las propiedades biomecánicas propias de la especie, son exclusivos del sujeto el peso, la masa, el patrón de vascularización, el estado metabólico, la morbilidad asociada, entre otras características. Por otro lado, el tejido que lo conforma en sí mismo también es heterogéneo y muy complejo, está constituido por diversos subtipos neuronales de gran variedad no sólo morfológica sino funcional incluso caracterizando subregiones en una misma área3.
Ha sido muy útil el uso de modelos in vitro para estudiar el tejido nervioso en condiciones normales y patológicas porque permite un acceso fácil y repetido de las células y un control preciso del medio extracelular. La heterogeneidad estructural antes descrita se pierde en la mayoría de los estudios, porque en ellos se utilizan ante todo cultivos celulares disociados1, que obviamente no mantienen las relaciones entre las células, o sea su conectividad. Las preparaciones organotípicas son una alternativa en la experimentación básica para el estudio del tejido nervioso conservando de manera aproximada el contexto tisular (citoarquitectura, conexiones y relaciones glia/neurona), bajo condiciones de temperatura regulada y oxigenación permanente. Éstas son de 2 tipos: los cultivos organotípicos propiamente dichos y los cortes cerebrales agudos. En los primeros se agrega a la preparación los factores de crecimiento y medios de sostenimiento especializados, con el fin de lograr mayor supervivencia del tejido a largo plazo. En el segundo, con el fin de estudiar fenómenos agudos, simulando las condiciones in situ, se analizan las tajadas cerebrales sumergidas en líquido cefalorraquídeo artificial (LCRa)4. Los cultivos organotípicos se utilizan en la investigación del TC, sobre todo en roedores, ejerciendo sobre ellos directamente la lesión traumática5. En el caso de seres humanos se han utilizado cortes cerebrales agudos derivados de lobectomías de epilepsia refractaria, de tumores y de material post-mortem, para estudios electrofisiológicos, de viabilidad celular y de neuroprotección en epilepsia e isquemia6-8, pero no para reproducir un modelo de TC.
En la literatura se han utilizado múltiples marcadores neuronales9,10 con el propósito de analizar tanto el estado normal como patológico de las neuronas; entre estos se destacan los anticuerpos contra el antígeno nuclear neuronal (NeuN) y proteína asociada con los microtúbulos (MAP2) (5F9)11,12.
Existe amplia evidencia de que la proteína NeuN es específica de neuronas y el uso de anticuerpos contra ella marca la población total de éstas en la corteza cerebral, permitiendo además la identificación precisa de su organización laminar. Adicionalmente, la identificación inmunohistoquímica de esta proteína, se considera una herramienta confiable para reconocer el tamaño y la forma de las células en comparación con otras técnicas clásicas como Nissl, considerando que mantiene la estabilidad de la marcación frente a variables técnicas tales como el intervalo post-mortem y los tiempos de fijación prolongados9. El anticuerpo 5F9 que se utiliza en el presente estudio para marcar la MAP2, es también selectivo de neuronas, permite la identificación de células piramidales y sus procesos apicales con escasa marcación de interneuronas10,11. Este marcador no sólo permite observar la segregación laminar sino la organización dendroarquitectónica de los procesos apicales10. Al igual que NeuN la expresión inmunohistoquímica de esta proteína es estable ante variables como el intervalo post-mortem y los tiempos de fijación prolongados.
Se ha descrito que algunos cambios morfológicos celulares y subcelulares de estos marcadores se correlacionan con la respuesta celular en varios tipos de lesión, y su integridad se asocia con una mayor viabilidad celular, tanto en el caso de NeuN12,13 como para MAP214. La confiabilidad de los 2 marcadores para valorar integridad estructural en cultivos organotípicos de hipocampo de rata ya había sido informada en neurodegeneración por etanol15.
En el presente estudio se pretende implementar un modelo organotípico con tejido cerebral derivado de personas afectadas por TCE a los cuales se les removió la contusión, caracterizando el momento de máxima preservación estructural cortical y por tanto el tiempo de máxima representabilidad de este tipo de tejido expuesto al modelo. En este estudio se establece una aproximación cualitativa de los cambios neuronales que progresan en el tiempo a través de la marcación del NeuN y la MAP2. Por otra parte se establece el perfil de neurodegeneración cortical in vitro con los 2 marcadores utilizados. Esta información sirve de base para que el perfil sea descrito posteriormente mediante valoraciones cuantitativas y, de esta manera, implementarlo y estandarizarlo como modelo experimental más preciso. El modelo optimizado podría subsanar algunas de las limitaciones propias de los utilizados con más frecuencia, al considerar la heterogeneidad del TCE de humano y la complejidad estructural intrínseca del tejido cerebral. Se logra además un acercamiento ex vivo sobre la evolución histológica de la corteza cerebral de humano in situ, después de TCE. Estas cualidades, en un futuro, podrían imponerlo como una herramienta adecuada para el ensayo de abordajes terapéuticos en neuroprotección en TC.
METODOLOGÍA
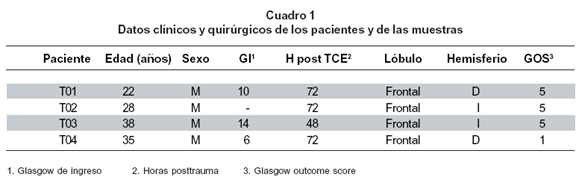
Pacientes y muestras de tejido cerebral. Las muestras de tejido se obtuvieron a través del proyecto de investigación «Estudio cualitativo y cuantitativo del trauma craneoencefálico en humanos» a cargo del Centro de Estudios Cerebrales de la Universidad del Valle, con el aval del Comité de Ética Humana. Las muestras cultivadas eran de 4 sujetos de sexo masculino entre los 22 y 38 años de edad, quienes sufrieron TCE con diagnóstico de contusión cerebral clínica e imagenológica, y quienes fueron llevados a craniectomía decompresiva de emergencia en el Hospital Universitario del Valle (HUV) de Cali, Colombia. El tejido colectado fue el obligatoriamente extraído para decompresión; no se extrajo tejido para fines exclusivos del estudio. La información de los casos, se obtuvo con permiso de fuentes autorizadas del HUV. Otros detalles clínicos por paciente se aprecian en el Cuadro 1.
Sujetos y muestras de tejido control. La IR de NeuN y MAP2 que fue considerada como control provino del estudio del tejido cortical de 14 sujetos de sexo masculino, con edades entre 18 y 50 años, cuya causa de muerte fue diferente a TCE (arma blanca, arma de fuego o accidente de tránsito), con un examen forense sin signos microscópicos de neurodegeneración cerebral y con un intervalo post-mortem entre 8 y 12 horas. Este tejido es parte del banco de placas de la línea de investigación que sobre corteza prefrontal se desarrolla en el Centro de Estudios Cerebrales.
Tajadas cerebrales. Los bloques iniciales de tejido se procesaron en los primeros 5 min luego de su extracción. El tejido se preparó bajo condiciones de esterilidad, a temperatura ambiente y sobre un disco de Petri que contuvo una preparación que contenía LCRa, cuya fórmula incluyó, NaCl 124 mM, KCl 5 mM, NH2PO4 1.24 mM, MgSO4 1.3 mM, NaHCO3 26 mM, CaCl2 2 mM, y glucosa 10 mM a pH controlado de 7.416. Se removieron los coágulos, las meninges, se descartó el tejido inmediatamente adyacente a la cavitación, y se seleccionó el tejido rosado de mayor firmeza, sin microhemorragias. Se realizaron cortes con bisturí de 1,500 a 2,000 mm en dirección piamadre-sustancia blanca, evitando el exceso de manipulación. Se observó que los cortes mantuvieran un suficiente componente de sustancia blanca. Una primera tajada se dispuso para fijación inmediata y correspondió al tiempo 0 (cero).
Corte agudo cerebral. Las tajadas se trasladaron de inmediato a una cámara de conservación de cortes cerebrales vivos, adaptación de la descrita por Krimer y Goldman-Rakic17, dispuestas sobre una camilla compartimentada y ésta a su vez dentro de un contenedor semi-sellado.
Las tajadas se sostuvieron en la interfase dispuesta por un flujo continuo de LCRa a 2 ml/min y una mezcla gaseosa de O2 al 95% y CO2 al 5% con burbujeo permanente, de acuerdo con la mayoría de los autores6,7, a 36°C y pH fisiológico.
La camilla consistió en un anillo de polietileno de 6 cm de diámetro, cuyo fondo era una malla del mismo material hidrofóbico con espacios pequeños; la porción central de la malla presentaba una concavidad central formada por tabiques semicirculares de 5 mm en su segmento más profundo y central, tabiques que dividieron la circunferencia de la camilla en 8 compartimentos radiales. El material plástico al ser hidrofóbico garantizó la no adherencia de los tejidos a la malla, y por otra parte la flotación a toda la estructura. Adicionalmente la malla permitió el paso del gas a burbujeo constante. La compartimentación permitió a cada tajada la misma disponibilidad de nutrientes y de gas evitando la superposición. La concavidad de la camilla proporcionó una adecuada distribución del gas desde el centro de la base hacia su periferia, sin que hubiera un agolpamiento. Toda la estructura flotante, el material y la concavidad permitieron el incremento de la tensión superficial en la interfase líquido/gas, para lograr que las tajadas flotaran.
El contenedor semisellado era de vidrio, diseño del grupo de trabajo, cuyo diámetro de apertura superior más grande fue 10 cm, finalizando en una base circular donde se encontraban integrados 2 conductos también de vidrio, el primero más lateral, constituyó un medidor de nivel ubicado verticalmente, y por el se conectó el tubo de evacuación del LCRa. El otro conducto, para el ingreso del gas, se ubicó en el centro de la base del contenedor, se levantaba 2 cm dentro de él y contenía un filtro de cuarzo fino; este conducto estaba adherido a una tubería por donde se suministraba el gas.
El sellamiento del contenedor se hizo con un disco de caucho de 3 mm de espesor que lo ocluía herméticamente. Sobre el caucho se hicieron 2 perforaciones, por una parte, la aguja de un venoclisis, por donde se proveía el goteo constante y regulado del LCRa y por otra, la evacuación restringida del gas por medio de una aguja gruesa, así se garantizaba la presión positiva dentro de la cámara para lograr una mayor oxigenación de las tajadas.
Las tajadas permanecieron en la cámara por 2, 8 y 14 horas, al cabo del cual se trasladaron al fijador. El tiempo final del procedimiento se seleccionó teniendo en cuenta el intervalo de la mayoría de los cortes con tejido humano que es de 12 horas y el tiempo máximo de supervivencia informada de 24 horas7.
Inmunohistoquímica. Las tajadas se depositaron para fijación en su respectivo recipiente, que contuvo paraformaldehido-lisina-periodato (PLP), a un pH de 7.4. Luego se llevaron a refrigeración a 4°C durante 6 a 8 días. Después de este tiempo, utilizando un vibrátomo (Lancer Vibratome series 1000®) se realizaron secciones coronales de 50 mm de espesor. Se descartaron las primeras 200 mm, y las últimas 300 que adherían el tejido al bloque metálico de sostén, de tal manera que se evitaran las áreas afectadas por la disección. El resto de secciones útiles se distribuyeron regularmente de manera consecutiva entre los marcadores.
Todos los procedimientos de inmunohistoquímica que se describen a continuación, se realizaron en condiciones estándar de laboratorio. Al inicio los tejidos se sumergieron durante 12 minutos en una solución de metanol al 30% y peróxido de hidrógeno al 0.3%. En seguida, se lavaron con buffer fosfato salino (PBS) 3 veces por 5 minutos cada vez. La adhesión a antígenos inespecíficos se bloqueó con suero normal de caballo (Vectastain Elite ABC, Vector Laboratories) al 1.5%, en PBS, el cual se aplicó por 40 min.
Después se incubaron por 18 horas las secciones en los anticuerpos primarios, los cuales estaban diluidos en PBS con tritón al 0.5%, en las siguientes concentraciones: anti-NeuN (Chemicon Internacional-MAB377®) en una dilución 1:2500; y anti-MAP2 (5F9, K. KosiK), 1:100. Luego se lavaron con PBS 3 veces por 5 minutos cada una. Después, las secciones se expusieron por 40 min, en una mezcla de avidina-biotina (anti-ratón de caballo) (Kit ABC Vectastain-Elite PK-6102 Mouse IgG, Vector Laboratories®), en PBS. Terminado este proceso, los cortes se lavaron nuevamente con PBS y se les adicionó una solución que contenía diaminobencidina al 4%, peróxido de hidrógeno al 2% y níquel al 2% en PBS (Peroxidase Substrate Kit; DAB SK-4100, Vector Laboratories®) durante 10 min. Todas las incubaciones anteriores fueron seguidas de 3 lavados con PBS, cada uno de 5 min.
Luego de la inmunomarcación, las secciones se montaron en placas cromaluminadas, se secaron y se deshidrataron progresivamente en alcoholes y xiloles; por último los tejidos se cubrieron con un medio de montaje (Fisher Permount Mounting Media®) y con laminillas.
Registro de imágenes. Las placas histológicas, se observaron al microscopio de luz y se tomaron microfotografías del total de secciones por placa, en los aumentos 4x, 10x, 40x y 100x. Las secciones a fotografiar debieron mostrar integridad del espesor cortical total, además de una pequeña porción de sustancia blanca subcortical. Las microfotografías se realizaron con la cámara digital (Power Shot A85 de Cannon®), acoplada al microscopio de luz (CH-2 Optical modelo CHS de Olympus®). De ser necesaria la reconstrucción fotográfica del espesor total de la corteza, en grandes aumentos, ésta se hacía a partir de la fusión de fotografías consecutivas con la asistencia del programa PhotoStitch de Cannon (versión 3.1, 2000®).
Análisis de datos. Se valoró la IR cualitativamente para cada marcador teniendo en cuenta lo siguiente:
NeuN marcación normal. La IR de NeuN en tejido neocortical post-mortem no patológico, permite identificar en todo el espesor cortical las neuronas de ambos tipos morfológicos propios de la corteza cerebral, piramidales y no piramidales, segregadas claramente en la organización de las 6 láminas neocorticales, con una marcación intensa, con nulo o muy escaso fondo9.
A nivel subcelular se ha descrito su normalidad, la cual es claramente compartimentada, con un claro predominio nuclear en la intensidad, siendo leve en el citoplasma y con alguna extensión a la dendrita proximal. Esta marcación es además íntegra, sin fragmentación o grumos9,13.
MAP2 marcación normal. En el cerebro del ser humano no patológico, la marcación es principalmente de células piramidales con inmunorreactividad de una pequeña porción de células no piramidales. En todo el espesor de un corte coronal esta marcación es intensa, circunscrita y con leve fondo. También es posible distinguir la organización horizontal laminar, siendo identificables sobre todo las láminas II, III y V. Este marcador permite además observar la organización vertical de las dendritas apicales en fascículos, principalmente en láminas supragranulares.
Con respecto a su distribución subcelular, la IR normal en tejido post-mortem control se observa intensa, con una textura homogénea, en cuerpos celulares y dendritas proximales, aunque con cierta extensión a las dendritas distales. La dendrita apical luce además íntegra, sin varicosidades, fragmentaciones o abultamientos.
Registro de datos. Dos observadores de manera independiente identificaron las láminas corticales a 4X sobre los cortes coronales tomando un área de 2,250 x 1,700 micrometros, por los cambios de densidad celular y el fenotipo morfológico típico esperado. Cuando una o un grupo de láminas no era observable o tenía sectores con ausencia de reactividad, sus límites fueron definidos de acuerdo con el nivel de profundidad de cada lámina en la perspectiva coronal. Si la lámina era identificada claramente y presentaba homogeneidad en la densidad en todo el campo observado, se consideraba que estaba presente 100% y se clasificaba con el valor simbólico +/+; si se apreciaba que alrededor de 75% del área presentaba las anteriores características se calificaba como +; si lo hacia 50% se calificaba con +/-; si era una tercera partese calificaba -; si sólo era 25% se calificaba con -/- y si no se encontraba ninguna célula positiva se consideraba ausencia de la lámina y se calificaba con la letra A. La calidad de la marcación de las células reactivas a los marcadores, se calificó de la misma manera teniendo en cuenta el universo de células marcadas.
RESULTADOS
IR para NeuN. En el tiempo 0 horas, tiempo que marca la extracción de la muestra, los especímenes mejor preservados fueron T01, T02 y T04, mientras que T03 presentó un compromiso importante en la calidad y en la cantidad de células positivas para NeuN. Las láminas comprometidas en este período fueron principalmente las piramidales III y V (Cuadro 2).
A las 2 horas en las muestras T01, T02 y T04 se podían aún distinguir las láminas corticales con excepción de las láminas III y V que empezaban a mostrar alteraciones en su IR. Las células comprometidas mostraron núcleos excéntricos y picnóticos. La muestra T03 continuó mostrando un mayor compromiso en la intensidad de la IR de las células y en la delimitación de las láminas; estas prácticamente no son visibles.
A las 8 horas de cultivo en las muestras T01, T02 y T04 se podían aún distinguir las láminas corticales con excepción de las láminas III y V que para estas muestras comenzaban a comprometerse. La muestra T03 continuó mostrando un mayor compromiso en la intensidad de la marcación de las células y en la delimitación de las láminas las cuales prácticamente no eran visibles.
A las 14 horas fue muy difícil distinguir las láminas corticales en la mayoría de sujetos; las escasas células encontradas lucían claramente picnóticas; algunas, sobre todo en las láminas piramidales, sólo se mostraban sus límites. La muestra T02 presentó una mejor calidad de la IR y de conservación de la citoarquitectura. La muestra T03 presentó pérdida de la IR en la mayoría de las láminas con excepción de la lámina VI.
IR para MAP2. A las 0 horas las muestras T01 y T04 mostraron con nitidez las láminas corticales, presentaron conservación de la dendroarquitectura muy similar al control post-mortem, con una IR para MAP2 intensa somatodendrítica y con detalle de la organización de los fascículos dendríticos. La muestra T02 mostró compromiso leve de la IR para MAP2 en las láminas I, II, IV y V. La muestra T03 no presentaba IR para el marcador en ninguna de las láminas corticales y en ninguno de los tiempos siguientes (Cuadro 2). Las láminas con IR comprometida mostraron marcaje fragmentado, lo que daba la impresión de procesos interrumpidos.
A las 2 horas, todas las muestras mostraron una pérdida de la IR. La muestra menos comprometida fue T04, en esta se apreciaron todas las láminas corticales con excepción de la lámina IV. Las muestras T01 y T02 mostraron compromiso mayor de la IR en las láminas I y III para el primero y III, V y VI para el segundo. La mayoría de células con IR alterada mostraron una marcación fragmentada y un límite celular borroso. Ocasionalmente era visible un pequeño segmento inicial de la dendrita apical.
A las 8 horas, aunque fue evidente el compromiso de la cito y dendroarquitectura, dada por la pobre IR en todas las muestras, se debe destacar que la muestra T04 era la menos afectada particularmente la lámina VI. A las 14 horas, los cambios fueron similares a lo descrito para 8 horas, todas las muestras tuvieron cambios drásticos en la pérdida de la calidad de la marcación celular y de la intensidad.
DISCUSIÓN
Uno de los objetivos al utilizar cortes cerebrales agudos es replicar la complejidad estructural del tejido cerebral y aproximarse así al estado in situ; de esta manera es posible manipular el microambiente neuronal. Esta metodología se ha aplicado en varios modelos experimentales y en tejido post-mortem para hacer análisis bioquímicos y moleculares de proteínas implicadas en apoptosis, inflamación y neurotoxicidad18-20, pero no ha sido informado hasta el momento su uso en tajadas derivadas de tejido traumatizado.
En el presente trabajo se aplicó el método de cortes cerebrales agudos de cerebro humano de 4 sujetos sometidos a craniectomía, con el propósito de valorar el grado de conservación estructural de la corteza cerebral. Para lograr este propósito se utilizaron 2 marcadores inmunohistoquímicos de injuria neuronal, que permitieran determinar la organización laminar y dendroarquitectónica de la corteza cerebral, y por otro lado valorar el grado de compromiso y/o supervivencia de las neuronas frente a una lesión.
Partiendo de la base de que la corteza cerebral está conformada por una población neuronal constituida por dos tipos neuronales básicos, con un fenotipo que no sólo atiende a su forma sino a su posición laminar (su localización espacial) y que esto está vinculado con patrones propios de conectividad, se evaluó la existencia de una respuesta diferencial por láminas, atendiendo a esta diversidad. Todas las células identificadas en las tajadas corticales con los 2 marcadores correspondieron a la típica morfología neuronal, identificándose tanto células piramidales como no piramidales con NeuN, y preferencialmente células de morfología piramidal con MAP2.
Las células halladas en los 4 sujetos identificadas con NeuN y en 3 de 4 con MAP2, se encontraron segregadas horizontalmente en las diferentes láminas corticales. Esta segregación horizontal de NeuN ya había sido utilizada como criterio de viabilidad de cultivos organotípicos de larga duración (hasta de 3 meses), a partir de muestras de tejido post-mortem derivado de humano8. Para el caso de MAP2 también se ha utilizado la distribución laminar post-mortem en cerebros no patológicos, para hacer comparaciones con muestras de sujetos post-mortem anóxico-isquémicos.
En los resultados obtenidos se encontró que el grado de compromiso laminar fue diferente, sobre todo a partir de las 2 horas. Esta respuesta diferencial se expresó en la tendencia de una mayor conservación de la lámina VI y una condición menos favorable para las láminas piramidales III y V, desde el comienzo hasta el final del procedimiento.
Además, se pudo establecer que se mantienen en una gran proporción hasta las 2 horas de cultivo las condiciones estructurales normales determinadas por la integridad del citoesqueleto a través de la marcación de MAP2 y la organización laminar de las neuronas marcadas con NeuN.
En tejido derivado de lobectomía realizada a pacientes con epilepsia refractaria y que fueron sostenidos en cámaras de conservación con LCRa, se ha reportado supervivencia neuronal hasta por 24 horas7. Teniendo en cuenta que para este tipo de muestra se espera un grado leve de lesión, en contraste con una mayor generada en la contusión cerebral (más allá del procedimiento técnico), la preservación parcial de la estructura cortical hasta las 2 horas aunque es un tiempo aparentemente corto, permitiría la posibilidad de intentar manipulaciones sobre este tejido y generar un modelo de supervivencia neuronal en un futuro. Los datos obtenidos permiten además establecer una evolución objetiva in vitro de los dos marcadores de neurodegeneración, lo cual permitiría inferir como estos cambios podrían progresar en las zonas lesionadas y adyacentes in situ en el sujeto con TCE.
Obviamente este modelo no replica por completo la situación real, porque se carece del efecto circulatorio y de la respuesta inmune sistémica. Además, otros elementos como el flujo permanente de LCRa podría constituirse en un mecanismo de lavado de sustancias excitotóxicas, las cuales normalmente estarían operando en el sujeto, siendo per se un mecanismo neuroprotector. Bajo estas condiciones, es probable que las tajadas ex vivo tengan una mayor oportunidad de supervivencia que el tejido lesionado y adyacente, sujeto a lesión primaria o secundaria in situ. A pesar de lo anterior, el modelo a futuro, optimizado con una mayor casuística, podría aplicarse como un método novedoso para ensayos farmacológicos.
CONCLUSIONES Y PERSPECTIVAS
El tejido cortical lesionado de humano expuesto a la técnica de corte cerebral agudo mantiene hasta las 2 horas de observación un suficiente grado de integridad estructural, lo cual permitiría manipulación del microambiente.
Se observaron cambios estructurales similares con los 2 marcadores utilizados, esto no sólo valida de nuevo su utilización simultánea, sino que describe con un alto grado de certeza la neurodegeneración aguda de este tipo de muestra. Estos cambios pueden ser susceptibles de ser valorados cuantitativamente permitiendo el establecimiento posterior del perfil de neurodegeneración con precisión. Se debe determinar con estudios más prolongados y con otras técnicas (pruebas de supervivencia celular electrofisiológicas, bioquímicas, histoquímicas), si la pérdida aparente de células inmunorreactivas de los marcadores corresponde a pérdida celular real o a alteraciones transitorias de la IR.
El patrón de neurodegeneración a establecer servirá de base para la optimización futura del modelo experimental. El modelo optimizado tendrá entre otras utilidades, la aplicación de ensayos farmacológicos, los cuales estarían «sincronizados» con la evolución de la neurodegeneración in vitro y ejecutados sobre la heterogeneidad intrínseca real de la lesión traumática del humano.
AGRADECIMIENTOS
Los autores desean expresar su agradecimiento a COLCIENCIAS por la financiación del proyecto de investigación «Estudio cualitativo y cuantitativo del trauma craneoencefálico en humanos: vulnerabilidad, viabilidad y muerte», Código 1106-04-16329, parte de cuyos resultados se consignan en este artículo. Además agradecen a la Universidad del Valle por el apoyo logístico y financiero en la ejecución del proyecto.
REFERENCIAS
1. Lauret C. An overview of in vivo, in vitro, and finite element models developed to study traumatic brain injury. BMTE. 2006; 6: 1-13.
2. Morales D, Marklund N, Lebold D. Experimental models of traumatic brain injury: do we really need to build a better mousetrap? Neuroscience. 2005; 136: 971-89.
3. DeFelipe J. Types of neurons, synaptic connections and chemical characteristics of cells immunoreactive for calbindin-D28k, parvalbumin and calretinin in the neocortex. J Chem Neuroanat. 1997; 14: 1-19.
4. Gahwiler B, Capogna M, Debanne D. Organotypic slice cultures: technique has come of age. Trends Neurosci. 1997; 20: 471-7.
5. Adamchik Y, Frantseva M, Weisspapir M. Methods to induce primary and secondary traumatic damage in organotypic hippocampal slice cultures. Brain Res. 2004; 1001: 125- 32.
6. Burkhart K, Beard D, Lehman R. Alterations in tau phosphorylation in rat and human neocortical brain slices following hypoxia and glucose deprivation. Exp Neurol. 1998; 154: 464-72.
7. O´Connor W, Davidson B, Kaplitt M. Adenovirus vector mediated gene transfer into human epileptogenic brain slices: prospects for gene therapy in epilepsy. Exp Neurol. 1997; 148: 167-78.
8. Verwer R, Hermens W, Dijkhuizen P. Cells in human post-mortem brain tissue slices remain alive for several weeks in culture. FASEB J. 2002; 16: 54-60.
9. Gittins R, Harrison P. Neuronal density, size and shape in the human anterior cingulate cortex: a comparison of Nissl and NeuN staining. Brain Res Bull. 2004; 63: 155-60.
10. Escobar MI, Pimienta HJ, Caviness VS, Jacobson M, Crandall JE, Kosik KS. Architecture of apical dendrites in the murine neocortex: dual apical dendritic systems. Neuroscience. 1986; 17: 975-8.
11. Pimienta HJ, Escobar MI, Cruz JA. Estudio inmunohistoquímico de la corteza cerebral humana utilizando un anticuerpo monoclonal contra la proteína asociada a microtúbulos PAM-2. Colomb Med. 1988; 19: 22-9.
12. Collombet J, Masqueliez C, Four E. Early reduction of NeuN antigenicity induced by soman poisoning in mice can be used to predict delayed neuronal degeneration in the hippocampus. Neurosci Lett. 2006; 398: 337-42.
13. Robertson C, Puskar A, Hoffman G. Physiologic progesterone reduces mitochondrial dysfunction and hippocampal cell loss after traumatic brain injury in female rats. Exp Neurol. 2006; 197: 235-43.
14. Arango C, Cardona G, Pimienta H. Down-regulation of Bcl-2 in rat substancia nigra after focal cerebral ischemia. Neuroreport. 2004; 15: 1437- 41.
15. Noraberg JY, Zimmer J. Ethanol induces MAP2 changes in organotypic hippocampal slice cultures. NeuroReport. 1998; 9: 3177-82.
16. Gawiler BH, Capogna M, Debanne D, McKinney RA, Thompson SM. Organotypic slice cultures: a technique has come of age. TINS. 1997; 20: 471-7.
17. Krimer L, Goldman-Rakic P. An interface holding chamber for anatomical and physiological studies of living brain slices. J Neurosci Meth. 1997; 75: 55-8.
18. Clark R, Kochanek P, Chen M. Increases in Bcl-2 and cleavage of caspase-1 and caspase-3 in human brain after head injury. FASEB J. 1999; 13: 813-21.
19. Ikomonovic M, Uryu K, Abrahamson E. Alzheimer’s pathology in human temporal cortex surgically excised after severe brain injury. Exp Neurol. 2004; 190: 192-203.
20. Zhang X, Liu E, LIU X. Changes in and effective factor of microtubule-associated protein 2 in traumatic neurons. Chin Med J. 2001; 114: 1035-8.