El pretratamiento agudo y subcrónico con fármacos anticonvulsivantes modifica las crisis generalizadas inducidas por el pentilenetetrazol en el ratón
Luisa L. Rocha, MD, PhD*
* Profesora 3D, Departamento de Farmacobiología, Centro de Investigación y Estudios Avanzados del Instituto Politécnico Nacional, México, DF. e-mail: lrocha@cinvestav.mx
Recibido para publicación diciembre 20, 2007 Aceptado para publicación junio 26, 2008
RESUMEN
Objetivo: El incremento en el contenido de GABA cerebral o la administración de un agente GABA-mimético se emplea como un tratamiento antiepiléptico eficaz. Sin embargo, se sugiere que el empleo de fármacos que alteran continuamente la transmisión sináptica puede afectar al sistema nervioso. En el presente estudio se evaluaron los efectos del pretratamiento agudo (una administración) y subcrónico (administraciones diarias por 7 días) de diazepam (DZP; 10 mg/kg, ip), gabapentina (GBP, 100 mg/kg, vo) y vigabatrina (VGB, 500 mg/kg, vo) en las crisis generalizadas inducidas por pentilenetetrazol (PTZ, 80 mg/kg ip).
Materiales y métodos: Ratones macho de la cepa taconic (20-25 g) recibieron tratamiento agudo y subcrónico de DZP, GBP o VGB y 24 h después de la última administración se aplicó PTZ. Se evaluaron las latencias a la primera crisis clónica, a la fase tónica así como la incidencia de muerte.
Resultados: El pretratamiento agudo con DZP protegió 100% a los animales de los efectos del PTZ, mientras que su administración subcrónica redujo la latencia a la crisis clónica (21%; p<0.05), la fase tónica (27%, p<0.05) y muerte (37%, p<0.05). La aplicación aguda de VGB protegió 100% a los animales de los efectos del PTZ, mientras que su aplicación subcrónica aumentó la latencia a las crisis clónicas (32%, p<0.05), aunque facilitó la aparición de la crisis tónica (55%, p<0.05) y la muerte (58%, p<0.05). La administración aguda de GBP elevó la latencia a la crisis clónica (52%, p<0.05), mientras que su administración subcrónica no modificó el efecto producido por PTZ.
Conclusiones: Estos resultados sugieren que el pretratamiento agudo y subcrónico de fármacos que incrementan la transmisión GABAérgica modifican diferencialmente la susceptibilidad a las crisis por PTZ y que su administración repetida puede facilitar la producción de crisis convulsivas.
Palabras clave: Diazepam; Gabapentina; Vigabatrina; Pentilenetetrazol; Epilepsia; Crisis generalizadas.
The acute and subchronic pretreatment with antiepileptic drugs modifies the pentylenetetrazol- induced generalized seizures in mice
SUMMARY
Objetives: The increased GABA content or administration of a centrally active GABA-mimetic agent have been used as a efficacious anticonvulsant therapeutic approach. However, it has been suggested that the use of drugs that continually and noncontingently alter synaptic transmission could alter at the nervous system. The present study was carried out to investigate the effects of acute (one administration) and subchronic (7 daily administrations) treatments with Diazepam (DZP; 10 mg/kg, ip), Gabapentin (GBP, 100 mg/kg. vo) and Vigabatrin (VGB, 500 mg/kg, vo) on pentylenetetrazol-induced generalized seizures (PTZ, 80 mg/kg, ip).
Materials and methods: Male Taconic mice (20-25 g) received acute or subchronic treatment with DZP, VGB or GBP and 24 h after the last administration, the effects of PTZ (latency to the clonus, forelimb extension and death incidence) were evaluated.
Results: Acute DZP protected all animals (100%) to the convulsant effects of PTZ, whereas subchronic DZP decreased the latency to the clonic (21%; p<0.05), tonic (27%, p<0.05) and death (37%, p<0.05). The acute treatment with VGB protect all animals (100%) to the effects of PTZ, whereas its subcronic administration enhanced the latency to clonus (32%, p<0.05), but facilitated the appearance of tonic seizures (55%, p<0.05) and death (58%, p<0.05). The acute administration of GPB increased the latency to clonus (52%, p<0.05), whereas its subchronic treatment did not modify the PTZ-induced effects
Conclusions: The present results indicate that the acute pretreatment with drugs enhancing GABAergic transmission differently modifies the seizure susceptibility, and that the subchronic administration may facilitate the seizure activity.
Keywords: Diazepam; Gabapentin; Vigabatrin; Pentylenetetrazol; Epilepsy; Generalizad seizures.
El incremento en el contenido de GABA cerebral o la administración de un agente GABA-mimético se emplea como una terapia antiepiléptica eficaz1. Sin embargo, se sugiere que el uso continuo de fármacos que alteran continuamente la transmisión sináptica puede no ser la mejor estrategia para el control a largo plazo de las crisis epilépticas2. La exposición prolongada de GABAendógeno o de fármacos que elevan los niveles extracelulares, pueden conducir a un decremento en la función GABAérgica3, y alteraciones en los receptores GABAA4,5, lo cual se asocia con tolerancia y resistencia, sobre todo para los efectos sedantes y antiepilépticos de fármacos como las benzodiacepinas6.
Se ha descrito que la administración crónica de benzodiacepinas produce subsensibilidad al GABA7 y disminución en la habilidad de este aminoácido a incrementar la unión de benzodiacepinas8. Se han informado9 síntomas de retirada o crisis espontáneas en abusadores de benzodiacepinas no-epilépticos después de suspender el fármaco.
El presente estudio fue diseñado para determinar si la administración subcrónica de fármacos que aumentan la transmisión GABAérgica modifica las crisis generalizadas inducidas por pentilenetetrazol (PTZ). Se emplearon compuestos antiepilépticos que activan el sistema GABAérgico tal como vigabatrina (VGB), gabapentina (GBP) y diazepam (DZP). VGB es un análogo estructural de GABA, el cual inhibe irreversiblemente la GABA transaminasa (GABA-T), la enzima responsable de la degradación del GABA10,11. Con respecto a la GBP, aunque ésta fue sintetizada como un análogo estructural de GABA, es inactiva en sus receptores12,13. Sin embargo, se sugiere que GBP actúa presinápticamente potenciando la función del GABA14. DZP, un agonista benzodiacepínico, aumenta la frecuencia de apertura del canal de cloro en la presencia de GABA y aumenta los efectos de este aminoácido15.
MATERIALES Y MÉTODOS
Animales. Se emplearon ratones macho adultos de la cepa taconic, con un peso entre 25 y 30 g al comienzo de los experimentos. Los animales se mantuvieron en cajas individuales con un ciclo luz-oscuridad constante (12:12 h) con acceso ad libitum a agua y comida. Los procedimientos experimentales se realizaron de acuerdo con la Norma Oficial Mexicana NOM-062-ZOO-1999 y el Comité de Ética del Centro de Investigación y de Estudios Avanzados del Instituto Politécnico Nacional (IPN), México, DF (proyecto N° 222/04).
Grupos experimentales. Los animales recibieron una administración diaria de solución salina (vo o ip) por una semana con el fin de habituarlas a la manipulación experimental. Después recibieron uno de los siguientes tratamientos:
a. Tratamiento agudo (n=10 por fármaco). Se administró solución salina (0.1 mg/kg, vo o ip) diariamente durante 7 días. Veinticuatro horas después de la última administración los animales recibieron una dosis de DZP (10 mg/kg ip, Sigma-Aldrich), VGB (500 mg/kg, vo, Sigma-Aldrich) o GBP (100 mg/kg, vo, Sigma-Aldrich). Un grupo control (n=20) se llevó a cabo en paralelo con la evaluación de cada fármaco, para lo cual los animales se manipularon de acuerdo con lo descrito, excepto que recibieron sólo vehículo.
b. Tratamiento subcrónico (n=20 por fármaco). Los ratones se trataron diariamente durante 8 días con DZP, VGB o GBP en las dosis indicadas antes. El grupo control (n=20) se manipuló igual que el anterior.
El DZP se disolvió en vehículo (0.5% Tween 80 y solución salina), mientras la GBP y la VGB se disolvieron en solución salina.
Crisis inducidas por pentilenetetrazol (PTZ). Las crisis inducidas por PTZ se evaluaron 24 h después de la última administración de solución salina o fármaco. Los ratones de los grupos control, tratamiento agudo y subcrónico de los diferentes fármacos se colocaron en contenedores individuales y se les aplicó una solución de PTZ (Sigma; 80 mg/kg, ip) preparada en ese momento. Inmediatamente después, se evaluó la latencia a la crisis clónica, a la fase tónica, así como la incidencia de muerte. Los animales control y experimentales se evaluaron en paralelo.
Análisis estadístico. Los valores de las latencias a la crisis clónica, tónica e incidencia de muerte para cada uno de los grupos experimentales se compararon con el respectivo grupo control y se analizaron estadísticamente por medio de una prueba t de Student, aplicando un nivel de significancia de 0.05. Los resultados se presentan como promedio ± error estándar y porcentaje de cambio en comparación al grupo control.
RESULTADOS
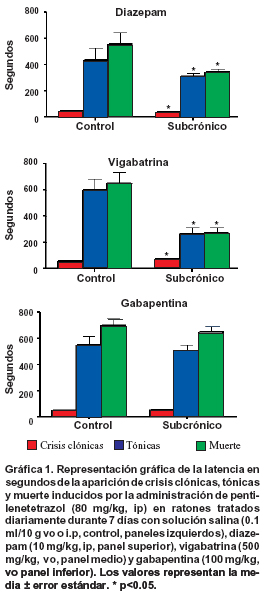
Efecto del DZP en las crisis producidas por PTZ. El pretratamiento agudo con DZP protegió 100% a los animales de la fase tónica y la muerte. Los ratones pretratados subcrónicamente con DZP mostraron una reducción en la latencia a la primera crisis clónica (control, 47±3.3 seg; DZP, 37±2.7 seg; 21%, p<0.05), a la fase tónica (control, 432±96 seg; DZP, 312±23 seg; 27%, p<0.05) y a la muerte (control, 555±90 seg, DZP, 346±22 seg; 37%, p<0.05). La tasa de mortalidad fue similar entre el grupo control y los animales tratados subcrónicamente con DZP (Gráfica 1).
Efecto de la VGB en las crisis producidas por PTZ. Al igual que DZP, el pretratamiento agudo con VGB protegió 100% a los animales de la fase tónica y la muerte. Los animales pretratados subcrónicamente con VGB mostraron un aumento en la latencia a la primera crisis clónica (control, 55±3.1; VGB, 73±2.9, 32%, p<0.05),pero acortó las latencias a la fase tónica (control, 600±88; VGB, 267±46; 55%, p<0.05) y a la muerte (control, 653±83, VGB, 272±42; 58%, p<0.05). El índice de mortalidad no se modificó con el tratamiento subcrónico deVGB (control, 70% vs VGB, 60%) (Gráfica 1).
Efecto del GBP en las crisis producidas por PTZ. La administración aguda de GBP sólo elevó la latencia a la primera crisis clónica (control, 72±7.3; GBP, 110±37.5, 52%, p<0.05). Sin embargo, murió 88% de los animales. Con respecto a la administración subcrónica, GBP no modificó la latencia a los diferentes componentes de las crisis inducidas por PTZ. No obstante, el índice de mortalidad fue menor en el grupo tratado subcrónicamente con GBP (40%) que en los animales control (60%) (Gráfica 1).
DISCUSIÓN
Los resultados obtenidos del presente estudio apoyan la idea de que los fármacos antiepilépticos pueden empeorar los desórdenes epilépticos y alterar la transmisión GABAérgica provocando un desequilibrio entre los circuitos inhibidores y excitadores16. Sin embargo, existen pocos estudios enfocados en analizar estos efectos, sobre todo de fármacos cuyo mecanismo de acción es la activación del complejo GABAA.
Se describe que el tratamiento subcrónico con VGB conduce a un decremento del umbral electroconvulsivo17 y no previene el desarrollo de crisis secundarias como consecuencia del estatus epiléptico18. Asimismo, se ha informado que VGB es un potente fármaco antiepiléptico en dosis agudas. Sin embargo, con la administración subcrónica, su efecto antiepiléptico disminuye después de la segunda semana de tratamiento en el modelo de «kindling» amigdalino19. De acuerdo con lo anterior, se ha demostrado que la eficacia antiepiléptica con el tratamiento a largo plazo de inhibidores de la GABA-T es limitada debido al desarrollo de mecanismos compensatorios tal como una reducida actividad de la GAD17.
Respecto a las benzodiacepinas, se sabe que el DZP produce sus efectos a través de su acción en el complejo GABAA. El DZP entra al cerebro y es depurado del mismo rápidamente. Sin embargo, su administración diaria y repetida se asocia con un pico máximo de concentración a las 2 h después de su inyección y a una acumulación progresiva del mismo a nivel cerebral20. Bajo esta última condición, la ocupación del receptor a benzodiazepinas por el DZP a nivel cerebral está bajo una fluctuación importante. Lo anterior puede producir un fenómeno similar a un síndrome de abstinencia al final del período de 24 h, el cual se revierte ante una nueva administración del DZP. Es posible que esta situación sea un mecanismo por el cual el pretratamiento repetido con DZP facilita las crisis inducidas por PTZ. Otro probable mecanismo puede ser que la administración crónica de DZP produce un decremento en la sensibilidad postsináptica de GABA7.
Con respecto a GBP, los datos encontrados en el presente proyecto están parcialmente de acuerdo con lo descrito por otros autores. Los resultados del presente artículo sugieren que la administración repetida de GBP no modifica la actividad epiléptica inducida por el PTZ, un efecto debido probablemente a que este fármaco es eliminado rápidamente y no produce metabolitos secundarios que se acumulen en el cerebro11-14.
Se desconocen los mecanismos que están implicados en el incremento de la susceptibilidad a las crisis convulsivas por fármacos antiepilépticos que ejercen su mecanismo de acción a través de la activación del complejo GABAA, aunque entre ellos se pueden sugerir los efectos farmacodinámicos secundarios por altas dosis o efectos secundarios en otros neurotransmisores o neuromoduladores.
CONCLUSIONES
Los resultados obtenidos en el presente estudio demuestran que los efectos inicialmente anticonvulsivantes de un fármaco que favorece la neurotransmisión gabaérgica, pueden cambiar y llegar a ser proconvulsivantes después de su administración repetida. Aunque al momento se desconocen los mecanismos por los que se producen estos efectos, es posible que sean la causa de la refractoriedad farmacológica que algunos pacientes epilépticos muestran después de varios años de tratamiento. Se deben realizar estudios con el propósito de diseñar nuevas estrategias farmacológicas que eviten los efectos adversos de los tratamientos crónicos de medicamentos antiepilépticas.
AGRADECIMIENTOS
El presente estudio fue parcialmente financiado por el Consejo Nacional de Ciencia y Tecnología (45943-M). Se agradece el apoyo técnico de Magdalena Briones Velasco, Leticia Neri Bazán y Héctor Vázquez Espinosa.
REFERENCIAS
1. Olsen WR, Avoli M. GABA and epileptogenesis. Epilepsia. 1997; 38: 399-407.
2. Gale K. GABA and epilepsy: basic concepts from preclinical research. Epilepsia. 1992; 33 Supl 5: 3-12.
3. Gyenes M, Farrant M, Farb DH. «Run down» of GABAA receptor function during whole-cell recording- a possible role for phosphorylation. Mol Pharmacol. 1988; 34: 719-23.
4. Calkin PA, Barnes EM. GABAA agonists down-regulate GABAA/benzodiazepine receptor polypeptides from the surface of chick cortical neurons. J Biol Chem. 1994; 269: 1548-53.
5. Yu R, Ticku MK. Chronic neurosteroid treatment produces functional heterologous uncoupling at the GABAA/benzodiazepine receptor complex in mammalian cortical neurons. Mol Pharmacol. 1995; 47: 603-10.
6. Braestrup C, Nielsen M, Squires RF. No change in rat benzodiazepine receptors after withdrawal from continuous treatment with lorazepam and diazepam. Life Sci. 1979; 24: 347-50.
7. Gallager DW, Lakoski JM, Gonsalves SF, Rauch SL. Chronic benzodiazepine treatment decreases postsynaptic GABA sensitivity. Nature. 1984; 308: 74-7.
8. Brett RR, Pratt JA. Changes in benzodiazepine-GABA receptor coupling in an accumbens-habenula circuit after chronic diazepam treatment. Br J Pharmacol. 1995; 116: 2375-84.
9. Lukas SE, Griffiths RR. Precipitated diazepam withdrawal in baboons: effects of dose and duration of diazepam exposure. Eur J Pharmacol. 1984; 100: 163-71.
10. Lippert B, Metcalf B, Jung MJ, Casara P. 4-amino- hex-5-enoic acid, a selective catalytic inhibitor of 4- aminobutyric acid aminotransferase in mammalian brain. Eur J Biochem. 1977; 74: 441-5.
11. Schechter PJ, Tranier Y, Grove J. Attempts to correlate alterations in brain GABA metabolism by GABA-T inhibitors with their anticonvulsant effects. En: Mandel P, DeFeudes FV, Editors. GABA-biochemistry and CNS functions. New York: Plenum Press; 1979. p. 43-57.
12. Dooley DJ, Bartoszyk GD, Hartenstein J, Reimann W, Rock DM, Satzinger G. Preclinical pharmacology of gabapentin. En: Golden Jubilee Conference and Northerm European Epilepsy Meeting. Abst. 8. York: University of York; 1986.
13. Suman-Chauhan N, Webdale L, Hill DR, Woodruff GN. Characterization of 3H-Gabapentin binding to a novel site in rat brain: homogenate binding studies. Eur J Pharmacol. 1993; 244: 293-301.
14. Taylor PC, Gee SN, Su TZ, Kocsis DJ, Welty FD, Brown PJ, et al. A summary of mechanistic hypotheses of gabapentin pharmacology. Epilepsy Res. 1988; 29: 233-49.
15. Haefely W, Kyburz E, Gerecke M, Mohler H. Recent advances in the molecular pharmacology of benzodiazepine receptors and in the structure-activity relationship of their agonist and antagonist. Adv Drug Res. 1995; 14: 165-322.
16. Perucca E, Gram L, Avanzini G, Dulac O. Antiepileptic drugs as a cause of worsening seizures. Epilepsia. 1998; 39: 5-17.
17. Loscher W. Anticonvulsant and biochemical effects of inhibitors of GABA amitransferase and valproic acid during subchronic treatment in mice. Biochem Pharmacol. 1982; 31: 837-42.
18. Halonen T, Nissinen J, Pitkanen A. Chronic elevation of brain GABA levels beginning two days after status epilepticus does not prevent epileptogenesis in rats. Neuropharmacol. 2001; 40: 536-50.
19. Rundfelt C, Loscher W. Development of tolerance to the anticonvulsant effect of VGB in amygdala-kindled rats. Eur J Pharmacol. 1992; 213: 351-66.
20. Fernándes C, Arnot MI, Irvine EE, Bateson AN, Martin IL, File SE. The effect of treatment regimen on the development of tolerance to the sedative and anxiolytic effects of diazepam. Psychopharmacology. (Berl). 1999; 145: 251-9.