Implementación de un método mediante el uso de sustratos tritiados como herramienta diagnóstica de la deficiencia de OCTN2
José Henry Osorio, DVM, PhD*
* Departamento de Ciencias Básicas de las Salud, Laboratorio de Patología Molecular, Universidad de Caldas, Manizales, Colombia. e-mail: jose.osorio_o@ucaldas.edu.co
Recibido para publicación agosto 29, 2007 Aceptado para publicación septiembre 18, 2008
RESUMEN
Introducción: El transporte de carnitina dentro de la célula es mediado por el transportador mitocondrial de los ácidos grasos de cadena larga. La deficiencia primaria de carnitina se debe a una deficiencia del transportador OCTN2.
Objetivos: El presente estudio tuvo como objetivo el análisis de las tasas de oxidación de sustratos tritiados por fibroblastos de pacientes que presentaban deficiencia primaria de carnitina y controles.
Materiales y métodos: Fibroblastos de pacientes y controles se incubaron con [3H]-palmitato y [3H]-miristato y se determinó la oxidación de los mismos en nmol/h/mg proteína.
Resultados: Encontrándose deficiente la oxidación de sustratos tritiados en más de 60% por parte de los fibroblastos procedentes de los pacientes que presentaban la deficiencia de OCTN2.
Conclusión: Esta técnica modificada permite el diagnóstico in vitro de la deficiencia primaria de carnitina.
Palabras clave: OCTN2; Transportador de carnitina; Deficiencia primaria de carnitina.
Implementation of a method using tritiated substrates as a diagnostic tool for OCTN2 deficiency
SUMMARY
Introduction: The transport of carnitine into the cell is mediated by a high-affinity sodium-dependent plasmalemmal carnitine transporter, OCTN2. Carnitine is a zwitterion essential for the mitochondrial oxidation of long-chain fatty acids. Primary carnitine deficiency is a consequence of the deficiency of OCTN2.
Objective: The objective of the present study was to analyse the oxidation rate of tritiated substrates by fibroblasts from patients suffering OCTN2 deficiency and controls.
Materials and methods: Fibroblasts from patients and controls were incubated with [3H]-palmitate and [3H]-miristate and the oxidation of these substrates were measured in nmol/hour/mg protein.
Results: We found depressed the oxidation of tritiated substrates in fibroblasts from patients suffering the deficiency of OCTN2 in more than 60%.
Conclusion: This modified technique enables us the in vitro diagnosis or primary carnitine deficiency.
Keywords: OCTN2; Carnitine transporter; Primary carnitine deficiency.
El fallo hereditario en el transportador de carnitina (OCTN2) se conoce como deficiencia primaria de carnitina (Mckusick 212140)1. Su presentación clínica puede debutar desde los primeros meses de vida (forma precoz), hasta pacientes con varios años de edad (forma tardía). La sintomatología es variada e incluye hipoglicemia con hipocetonemia, muerte súbita incluso neonatal, debilidad muscular, cardiomiopatía o anemia que responde mal al tratamiento con hierro. Puede presentarse hiperamonemia y elevación de transaminasas, con niveles séricos muy bajos de carnitina.
El diagnóstico por laboratorio de esta deficiencia incluye básicamente la determinación de carnitina libre y total en suero. Al análisis estos pacientes no presentan acumulación significativa de acilcarnitinas en plasma ni acilglicinas en orina. Para el diagnóstico utilizan fibroblastos o linfocitos de los pacientes sospechosos, incubados en presencia de diferentes sustratos, tratando de demostrar el defecto en la membrana plasmática del transportador de la carnitina2.
El presente trabajo tiene como objetivo realizar una comparación entre las tasas de oxidación de sustratos tritiados ([3H]-palmitato y [3H]-miristato) por fibroblastos de individuos que presentan deficiencia primaria de carnitina y controles, con el fin de establecer si esta técnica se puede emplear como herramienta diagnóstica de personas que sufren deficiencia primaria de carnitina.
MATERIALES Y MÉTODOS
El presente estudio es de tipo experimental. El material biológico empleado fueron los fibroblastos de 2 pacientes con deficiencia de OCTN2. Esta deficiencia se confirmó por estudios moleculares. Como controles se utilizaron 20 cultivos diferentes de fibroblastos normales, una incubación de cada muestra con [3H]-palmitato y una incubación de cada muestra con [3H]-miristato. A cada uno de los dos pacientes que presentan la deficiencia de OCTN2 se le realizaron 5 incubaciones independientes con ([3H]-palmitato y 5 incubaciones independientes con [3H]-miristato. El mismo procedimiento anterior se realizó con los fibroblastos de los pacientes pero agregando carnitina al medio de cultivo.
Se cultivaron los fibroblastos de pacientes y controles (4-20 pasajes) en MEM (Medio de cultivo similar al medio basal Eagle's, con bicarbonato y HEPES [4-(2-hidroxietil)-1-ácido piperazinaetanosulfurico], suplementado con 10% (v/v) suero de bovino recién nacido y 1% (v/v) de antibiótico (gentamicina) a 37°C, en estufa con 5% CO2/95% de aire. Después de alcanzar el punto de confluencia (80% a 100%), las células se lavaron dos veces con PBS y la solución se tripsinizó (1 ml de tripsina-EDTA a 37°C), y luego se neutralizó mediante la adición entre 3 ml y 5 ml de MEM. Las células se transfirieron y se centrifugaron a 337 x g (5 min, 20°C) en tubos cónicos de 10 ml (0.8-1.2 mg proteína), quedando listas para ser incubadas en presencia de sustratos tritiados. Se utilizó el método de Lowrry et al.3 para la determinación de la proteína.
El método utilizado para la incubación de los fibroblastos en presencia de sustratos tritiados, fue el de Manning4 con modificaciones. La secuencia metodológica es la siguiente:
Para obtener las mezclas radioactivas se prepararan las siguientes soluciones: Solución A: Ácido palmítico 12.5 mg/1 ml de etanol al 95% o ácido mirístico 12.5 mg/1 ml etanol 95%; Solución B: Albúmina 25 mg/ml = 75 mg/30 ml de PBS 1. Reactivo C: ácido [9,10)(n)-3H] palmítico (diluido en tolueno, 50-62 mCi/mmol, 1 mCi/ml) (Amersham) o ácido [9,10)(n)-3H] mirístico (Diluido en tolueno, 40-60 Ci/mmol, 1mCi/ml) (Amersham). Se mezcla en un tubo plástico de 3 ml, 25 µl de A + 3.8 µl de C (3.8 µCi), y el solvente se evapora bajo gas nitrógeno. Se agregan 2.5 ml de B y se analiza la mezcla en el contador de centelleo (LS3801-Beckman), (50 µl de la solución + 10 ml de líquido de centelleo (Ready Safe). Luego la mezcla se lleva al baño de ultrasonido durante 15 min y se a incubación al baño a 37°C durante 40 min; después se lleva de nuevo al baño de ultrasonido durante 30 min, y se centrifuga durante 20 min a 5000 rpm. Se traspasa el máximo de volumen sobrenadante a otro tubo plástico de 3 ml, y se analizan 50 µl de la solución, como se describió antes.
Para preparar las columnas de intercambio iónico se usan las resinas Dowex 1 X 8-200 ó Dowex 1 X 2-400, se agrega agua destilada hasta que se hidrate. Se sellan al mechero pipetas Pasteur, aproximadamente a 3 cm de la punta, y se aísla el cuerpo de la pipeta de la punta, mediante la introducción de algodón comprimido, tratando de que el volumen de algodón ocupe aproximadamente 1 cm. Se toma igual volumen de agua que de resina, se lleva a agitación suave y mientras se agita se toman 2.5 ml y se depositan cuidadosamente en la pipeta, previa humectación total del algodón con agua milli Q para evitar la retención de burbujas de aire que puedan hacer caminos en la resina. Es recomendable conservar las pipetas en posición vertical. Después de depositar la resina verificar que no queden burbujas de aire y que la pipeta no pierda agua, para que la resina permanezca hidratada; luego las columnas se conservan en refrigeración hasta su uso.
Para evaluar la oxidación de [3H]-palmitato por los fibroblastos se toma el pellet de células previamente resuspendido en 500 µl de PBS. Se utilizan bandejas de incubación con capacidad para 24 pozos. El blanco contiene 40 µl (0.05 µCi) de mezcla radioactiva y 160 µl de PBS; las muestras contienen 60 µl de células resuspendidas, 40 µl (0.05 µCi) de mezcla radioactiva y 100 µl de PBS 2. La bandeja se envuelve en papel de aluminio y se incuba a 37°C durante 4 horas en cámara de CO2 5%, aire 95%. La reacción se detiene, se deja la bandeja en hielo y se agrega a cada pozo 200 µl de ácido acético 10%. El contenido de los pozos se traspasa a los tubos para microcentrífuga y se centrífuga a 5000 rpm durante 5 min; se transfiere 360 µl de la mezcla a un tubo de microcentrífuga que contiene 50 µl de NaOH 1 M. Esta mezcla se mantiene en hielo hasta el momento de aplicar a la columna. Para la aplicación a la columna de intercambio iónico se parte con cuidado la punta sellada de la pipeta Pasteur (columna), se deja un vial bajo la misma, se escurre su contenido, se aplica luego 455 µl de mezcla de reacción, y se deja escurrir de nuevo. Para el goteo se lava la columna tres veces con 500 µl de agua milli Q, recogiendo todo el producto del lavado. Se desecha la columna y se agrega a cada vial 10 ml de líquido de centelleo, agitando fuertemente para su posterior análisis.
De acuerdo con el Artículo 11 literal a de la Resolución N° 8430 de 1993 del Ministerio de Salud, de Normas Científicas, Técnicas, y Administrativas para la Investigación en Salud, el presente estudio se consideró sin riesgo. Los pacientes firmaron el consentimiento informado y el trabajo lo aprobó el respectivo comité de ética.
RESULTADOS
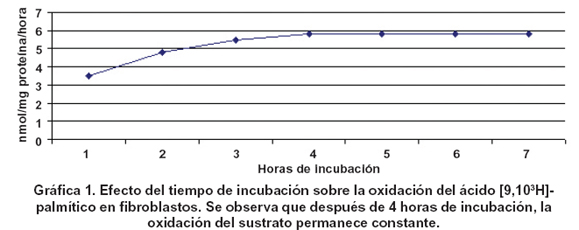
Se determinó que después de 5 horas de incubación en presencia de sustratos tritiados, los fibroblastos no modifican la cantidad producida de 3H2O (Gráfica 1). Al estudiar el efecto del tiempo de almacenamiento de las células refrigeradas sobre la oxidación del sustrato, se encontró que después de 24 horas de conservación de las muestras los resultados son muy diferentes (inferiores), por lo cual, no son de confianza. Cada vez que se prepara una nueva mezcla radioactiva se obtiene mucha variabilidad en las dpm resultantes, tal vez debido a que la unión con la albúmina no es muy constante. Este hecho da lugar a un rango de valores control muy amplio. Después de estudiar 20 controles, se decidió que era mejor hacer cálculos en función de los controles paralelos, tal como lo sugirieron otros autores5 (3 controles paralelos como mínimo). El Cuadro 1 muestra la oxidación de palmitato y miristato tritiados en nmol/hora/mg proteina y el porcentaje de oxidación de los sustratos tritiados por parte de los fibroblatos de los pacientes comparados con los controles paralelos. Los porcentajes de oxidación son similares tanto para el palmitato como para el miristato tritiados (30% a 40% comparado con los controles). Al realizar análisis estadístico mediante la prueba t de Student se encontró diferencia significativa (p<0.05) entre los pacientes y los controles.
DISCUSIÓN
El diagnóstico de la deficiencia primaria de carnitina comienza con la sospecha clínica y las manifestaciones son variadas, como se ha mencionado antes, pero los estudios de laboratorio son definitivos para la confirmación de la misma. Niveles séricos muy bajos de carnitina (<10 µM), en contraste con el aumento de la excreción urinaria de carnitina, con aciduria dicarboxílica poco relevante, son hallazgos importantes en pacientes sospechosos de la deficiencia. Los estudios in vitro de estos pacientes incluyen la utilización de fibroblastos y linfocitos entre otros6. En los fibroblastos se encuentran preservadas las relaciones entre la oxidación de ácidos grasos, los sistemas de transferencia de electrones y otras vías que interactúan en el metabolismo intermediario. La integración de estos sistemas es esencial para el estudio de la organización y control de las enzimas involucradas en la ß-oxidación mitocondrial, lo que hace este tipo de células ideal para el presente estudio. A partir del desarrollo de los ensayos para medir las tasas de oxidación de ácidos grasos en células mediante la incubación con substratos radioactivos, se avanzó notablemente en el diagnóstico de las deficiencias de la ß-oxidación mitocondrial de los ácidos grasos. Moon y Rhead desarrollaron en 19877, un método de valoración de 3H2O en fibroblastos con ácidos grasos tritiados. La liberación de tritio unido a los carbonos 9 y 10 del palmitato depende de tres mecanismos:
1. La acción de una acyl-CoA deshidrogenasa formando un 2,3-enoyl-CoA ester y transfiriendo 50% del tritio a la proteína de transferencia de electrones (FADH).
2. La reacción de la 3-hidroxiacil-CoA deshidrogenasa que remueve la mitad del tritio remanente, el cual finaliza en el NADH.
3. El ciclo del ácido tricarboxílico que libera el 25% restante.
La incorporación final del tritio al agua, es por tanto dependiente de la re-oxidación de esos cofactores en la cadena de transporte de electrones. Los complejos 2, 3, y 4 de la cadena respiratoria se requieren para el paso del tritio que viene de la proteína de transferencia de electrones y los complejos 1, 3 y 4 para la re-oxidación del NADH, y la prueba se puede utilizar también en ciertos defectos de la cadena respiratoria8. Manning et al.4 postularon que [9,10)(n)-3H]-miristato posee claras ventajas sobre [9,10-3H]-palmitato para la detección de transtornos tales como la deficiencia de acil-CoA deshidrogenasa de cadena media MCAD y las formas leves de la deficiencia múltiple de deshidrogenasas (MAD) donde la ß-oxidación se encuentra detenida a nivel de los sustratos con 8 átomos de carbono.
Otros estudios9,10 utilizando esta técnica informan niveles de oxidación de ácidos grasos en varias deficiencias de esta vía. Sin embargo, no hay informes de estudios de deficiencia primaria de carnitina con esta técnica. En este estudio se encontró para esta deficiencia una tasa de oxidación que oscila entre 30% y 40% comparada con los normales, pero se alcanza una oxidación similar a los controles, después de adicionar carnitina al medio de cultivo. Este comportamiento se correlaciona perfectamente con el comportamiento in vivo, donde la administración de dosis farmacológicas de carnitina consigue en muchos casos una remisión clínica total. Al igual que otros autores4,5,10, existe una gran variabilidad en las tasas de ß-oxidación medida con los ensayos con miristato y palmitato tritiados, por eso sólo se deben tener en cuenta los resultados por línea celular promedio de las determinaciones por triplicado en un solo ensayo, en presencia por lo menos de dos o tres controles, porque los rangos de oxidación en nmoles/mg proteína/hora son muy amplios.
El coeficiente de variación obtenido al trabajar con esta prueba fue similar al obtenido por otros5, y al igual que ellos, se encontró que a pesar de la buena estabilidad a corto plazo de la mezcla radio-activa, existen problemas de reproducibilidad originados en la unión de los substratos a la albúmina sérica bovina. Los resultados obtenidos con mezcla radiactiva fresca inmediatamente utilizada después de su preparación, muestran casi el doble de actividad observada en relación con las mezclas utilizadas de preparación previa5. La prueba estándar para el diagnóstico de esta deficiencia es la determinación de carnitina libre y total en sangre, preferiblemente usando espectrometría de masas en tendem. Los pacientes presentan niveles muy bajos de carnitina libre y total asociados con los signos clínicos producto de la pobre degradación de ácidos grasos de cadena larga y muy larga; sin embargo, es una técnica costosa y al alcance de pocos laboratorios.
Los resultados obtenidos en el presente estudio son de alguna manera comparables a los obtenidos mediante espectrometría de masas, por cuanto los fibroblastos de los pacientes presentan pobre degradación de ácidos grasos y tiene la ventaja de poderse usar en muestras post-mortem, donde no se dispone de sangre para la determinación por espectrometría de masas. Es posible concluir entonces que la valoración de agua tritiada, es un buen método para confirmar una deficiencia primaria de carnitina. Esto es importante debido a que en Colombia, los errores hereditarios de la ß-oxidación mitocondrial de los ácidos grasos, apenas comienzan a ser informados11 y se necesitan herramientas diagnósticas para hacer frente a este tipo de problemas.
REFERENCIAS
1. Osorio JH, Pourfarzam M. Early diagnosis of neurometabolic diseases by tandem mass spectrometry. Acylcarnitine profile from cord blood. Rev Neurol. 2004; 35: 11-6.
2. Longo N, Amat di San Filippo C, Pasquali M. Disorders of carnitine transport and the carnitine cycle. Am J Med Genet C Semin Med Genet. 2006; 142: 77-85.
3. Lowry OH, Rosebrough NJ, Farr AL, Randall RJ. Protein measurement with the Folin phenol reagent. J Biol Chem. 1951; 193: 265-75.
4. Manning NJ, Olpin SE, Pollit RJ, Webley JA. Comparison of 9.10-3HPalmitic and 9.10-3Hmyristic acids for the detection of defects of fatty acid oxidation in intact cultured fibroblasts. J Inher Metab Dis 1990; 13: 58-68.
5. Olpin SE, Manning NJ, Carpenter K, Middleton B, Pollit RJ. Differential diagnosis of hydroxydicarboxylic aciduria based on release of 3H2O from [9,10-3H]-myristic and [9,10-3H]-palmitic acids by intact cultured fibroblasts. J Inher Metab Dis. 1992; 15: 883-90.
6. Schimmenti LA, Crombez EA, Schwahn BC, Heese BA, Wood TC, Schroer RJ, et al. Expanded newborn screening identifies maternal primary carnitine deficiency. Mol Gen Metab. 2007; 90: 441-5.
7. Moon A, Rhead WJ. Complementation analysis of fatty acid oxidation disorders. J Clin Invest. 1987; 79: 56-94.
8. Venizelos N, Von Dobeln U, Hagenfeld L. Fatty acid oxidation in fibroblasts from patients with defects in ß-oxidation and in the respiratory chain. J Inher Metab Dis. 1998; 21:409-15.
9. Nada MA, Rhead WJ, Sprecher H, Schulz H, Roe CR. Evidence for intermediate channeling in mitochondrial ß-oxidation. J Biol Chem. 1995; 270: 530-5.
10. Ventura FV, Costa CG, Struys EA, Ruiter J, Allers P, Ijlst L, et al. Quantitative acylcarnitine profile in fibroblasts using U-13Cpalmitic acid : an improved tool for the diagnosis of fatty acid oxidation defects. Clin Chem Acta. 1999; 281: 1-17.
11. Osorio, JH, García F, Sánchez A. First report for 625G>A polymorphism in the short chain acyl-CoA dehydrogenase gen in South America. J Inher Metab Dis. 2005; 28: S1, 09.