Malaria vivax en niños: aspectos clínicos y respuesta a la cloroquina*
Jaime Carmona-Fonseca, MSc1, Rosa M. Uscátegui, MSc2, Adriana María Correa, MSc1
RESUMEN
Introducción: En Colombia, no hay información actualizada sobre malaria vivax en niños.
Objetivo: Describir el cuadro clínico-paraclínico de la enfermedad y evaluar la eficacia de la cloroquina (dosis estándar) para curar el ataque agudo de paludismo vivax en niños (4-10 años).
Metodología: Diseño experimental, balanceado, no ciego; 82 pacientes, residentes en Turbo o El Bagre. Seguimiento, 30 días.
Resultados: Los síntomas y signos concordaron con la literatura. Hubo desnutrición de largo plazo en 62%, anemia en 53%, retinol bajo (19 μg/dl), recuento leucocitario normal, pruebas hepáticas y creatinina normales. A los 25-28 días postratamiento todas las alteraciones, excepto la desnutrición, habían desaparecido. Falla de la cloroquina: dos posibles fallas tardías. Proporción de falla según tres técnicas de análisis según la intención de tratar: 2.4% (0 a 24%), según el protocolo 2.6% (0 a 25%), según el peor escenario 7.3% (0 a 29%).
Conclusión: El cuadro clínico-paraclínico fue similar al de los adultos. El paludismo, más que la desnutrición, fue responsable de las alteraciones clínicas-paraclínicas. La cloroquina sola, sin primaquina, resultó altamente eficaz para el ataque agudo de malaria vivax en niños y debe conservarse como primera opción terapéutica.
Palabras clave: Malaria; Paludismo; Plasmodium vivax; Cloroquina; Eficacia; Colombia.
Vivax malaria in children: clinical features and response to chloroquine
SUMMARY
Introduction: In Colombia is not very common to find updated information about vivax malaria in children.
Aims: Describe the clinical and paraclinical disease picture and evaluate the standard dose of chloroquine effectiveness as a cure for the acute attack of vivax malaria in children between 4 and 10 years old.
Methods: Experimental design, balanced, not blind, 82 patients and habitants in El Bagre and Turbo, Colombia. Follow-up: 30 days.
Results: Symptoms-signs agreed with the known. There were found 62% long-term malnutrition, 53% anemia, low retinol (19 μg/dl), normal leukocyte count, normal liver tests and normal creatinine coefficient. After 25-28 day of treatment, all alterations had disappeared on children except malnutrition. According with the analysis techniques, the chloroquine late failure proportion was: by the intention to treat 2.4% (0 to 24%), by the protocol 2.6% (0 to 25%), and in the worst-case scenario 7.3% (0 to 29%).
Conclusion: The clinical and paraclinical depict was similar than adults. Malaria, was the main responsible for clinics and paraclinical alterations. Chloroquine, without primaquine, proved highly effective for the acute attack of vivax malaria in children and should be retained as the first therapeutic option.
Keywords: Malaria; Plasmodium vivax; Chloroquine; Efficacy; Colombia.
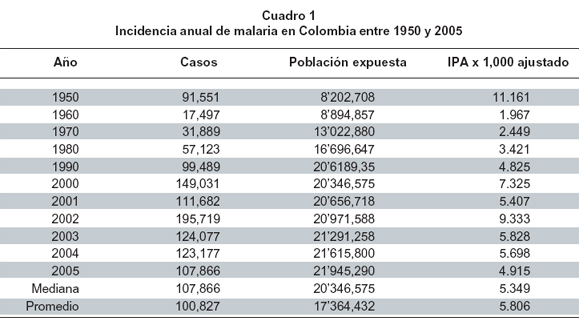
La malaria ha tenido tendencia creciente durante más de 50 años en Colombia1 y entre 1950 y 2005 la incidencia anual ha estado entre 1,967 por mil expuestos, en 1960, y 11,161 en 1950, con un valor de mediana de 5,349 (corresponde a 107,866 casos y una población expuesta proyectada de 20'346,575 habitantes) (Cuadro 1)1. Los datos se refieren siempre a incidencia ajustada por riesgo de exposición y no a incidencia en la totalidad de la población colombiana (menos de la mitad está expuesta a paludismo). Los valores ajustados y sin ajustar son muy diferentes; por ejemplo, en 2004, la incidencia no ajustada, informada por las agencias estatales, fue de 2,719 por mil2, mientras que la ajustada fue 5,698.
El departamento de Antioquia generó entre el año 1995 al 2001, 16% y 45% de los casos de malaria de Colombia1. Plasmodium vivax predomina en el país, con excepción de la región del Pacífico, y produce entre 54% y 69% de los casos, según el año examinado1. En Antioquia, la relación vivax: falciparum entre 1985 y 1999 varió de 1.6 a 4.7, con promedio de 2.53. En Antioquia, 31% de la población es menor de 15 años, 64% tiene entre 15 y 64 años y 5% es mayor de 64 años. En la región de Urabá, 43% es menor de 15 años, 54% tienen entre 15 y 64; el porcentaje de mayores de 64 años es 2.5%. En Bajo Cauca hay una situación muy parecida a la anterior6. En las dos regiones y sin discriminar por especie, la cantidad de casos es mayor en el grupo de 15 a 44 años (52%), seguido por 5 a 14 (29%), 0 a 4 (9%), 45 a 60 (5%), 60 y más (2.5%) y menores de 1 año (1%). Según la especie, este orden se mantiene en P. vivax pero en P. falciparum los grupos entre 45 y 60 y 0 y 4 años intercambian posiciones3. En el Cuadro 2 aparece la distribución por sexo y edad de la malaria vivax en Turbo (Urabá) y El Bagre (Bajo Cauca) entre los años 2000 y 20033. En el primer lugar los hombres aportan 59% de los casos y en el segundo participan con 61%. El índice parasitario anual (IPA) por cada mil habitantes expuestos a paludismo fue 39 por mil en Turbo y 156 por mil en El Bagre-Zaragoza entre los años 1996 y 20003. Además, hay un asunto crucial para considerar en la población de estas dos regiones palúdicas: por lo general padecen de forma simultánea de parasitosis intestinales y desnutrición4.
Los síntomas y signos clínicos son similares para la malaria por cualquier especie5 y ni aislados ni en grupos pueden predecir el diagnóstico de malaria ni diferenciar la especie de Plasmodium responsable en personas que viven en áreas endémicas, como ha sido recientemente enfatizado para el caso de niños residente en áreas de baja endemia6.
En Colombia, las manifestaciones clínicas de la malaria vivax en niños han sido poco divulgadas. Una búsqueda en abril de 2007 en PubMed (vivax, children, Colombia) y en LILACS (vivax, niños, Colombia) sólo produjo estos resultados: en PubMed hubo 18 referencias pero únicamente una se refirió a datos sobre clínica7 y otra a tratamiento8; en LILACS hubo dos referencias y una de ellas (presentación de tres casos) se refirió a clínica y tratamiento.
En el informe de Echeverri et al.7 104 pacientes de Turbo tuvieron estos síntomas y signos: fiebre 99%, cefalea 99%, escalofrío 91%, sudoración 78%, palidez palmar o conjuntival 46%, mareo 33%, vómito 39%, diarrea 13%, ictericia 15%, epigastralgia 34%, hepatomegalia 17% y esplenomegalia 10%. De los 104 pacientes, 30% eran menores de 15 años y en ellos la existencia de anemia no se asoció con ninguna de estas variables (p>0.05): sexo, oficio ni antecedentes de malaria. Hubo muy débil correlación entre el nivel de hemoglobina y las variables tiempo de residencia en la zona (r=-0.13), edad (r=0.37) y parasitemia (r=0.40). La anemia grave (<5 g/dl) se encontró en 1% de los enfermos.
En general, en áreas endémicas e hiperendémicas la prevalencia de malaria aumenta con la edad, desde 0 a 10% en los primeros tres meses de vida hasta 80% y 90% hacia los 12 meses, valor que persiste alto durante la niñez inicial. La mortalidad es más alta durante los dos primeros años de vida. Hacia la edad escolar se ha adquirido una importante inmunidad protectora y en muchos lugares la parasitemia asintomática se observa hasta en 75% de los escolares de primaria9. En regiones de baja endemia, donde usualmente la Organización Mundial de la Salud (OMS o WHO por sus iniciales en inglés) y los expertos clasifican a Colombia en conjunto, la inmunidad es baja y las infecciones graves ocurren en toda edad, inclusive en adultos. En estas zonas la morbi-mortalidad palúdica tiende a ser muy alta9. En zonas de baja endemia, antes de los dos meses de edad la infección plasmodial es muy rara y si sucede es leve; en niños menores de cinco años, en especial los menores de dos años, la enfermedad tiende a ser atípica y grave; en niños de más edad, la malaria tiene curso similar a como sucede en adultos9.
Con la aplicación de protocolos de la OMS/WHO, se ha evaluado la respuesta terapéutica antimalárica (RTA) en paludismo falciparum frente a nueve tratamientos10, con eficacia variable según el tratamiento, donde amodiaquina-sulfadoxina-pirimetamina (AQ-SP) ha sido eficaz en 98% de los pacientes. En esos grupos ha habido hombres y mujeres, niños y adultos, pero la cantidad de personas menores de 12 años ha sido relativamente escasa. También se examinó la RTA en el paludismo vivax y se halló siempre eficacia de 100%, tanto con cloroquina sola11 como asociada con primaquina12,13. Los niños evaluados han sido muy escasos (13 entre 33 pacientes en Turbo, en el estudio de Blair et al.11). Lacharme et al.12 evaluó pacientes adultos en Turbo (n=30) y en Zaragoza (n=66) con el tratamiento estándar cloroquina-primaquina, que fueron seguidos por 16 días; el trabajo de Blair et al.11 examinó 33 pacientes en Turbo, con el protocolo OMS-2001, con seguimiento por 28 días; se administró sólo cloroquina en la forma estándar; la investigación de Carmona et al.13 evaluó en Turbo y El Bagre 210 mayores de 14 años, tratados simultáneamente con cloroquina y primaquina, con aplicación del protocolo OMS-2001, con 28 días de seguimiento. El trabajo de Castillo et al.8 examinó 44 pacientes y 36 fueron niños de 10-14 años; la eficacia de la cloroquina fue 100% en niños y adultos8. Otro estudio colombiano sobre evaluación de la eficacia de la cloroquina, sin primaquina, no incluyó niños14.
En resumen, en Colombia hay ausencia casi total de información sobre manifestaciones clínicas y de laboratorio de esa enfermedad infantil y sobre la eficacia del tratamiento estándar (cloroquina) para el ataque agudo en niños. Esta situación motivó el presente trabajo, basado en los hallazgos clínicos y de laboratorio obtenidos al evaluar la RTA en 82 niños de 4-10 años con paludismo vivax, tratados con cloroquina como monoterapia para el ataque agudo.
MATERIALES Y MÉTODOS
Clase de estudio unidad de análisis y diseño muestral. Este informe de carácter descriptivo, transversal y prospectivo, se refiere a 82 pacientes con paludismo por P. vivax. Los niños se captaron según el orden de llegada, si satisfacían los criterios de inclusión y si sus acudientes daban el consentimiento informado escrito.
La muestra se calculó según modelos conocidos15 con base en:
a. El tamaño de la población de niños de 4-10 años con malaria, en Turbo y El Bagre, entre los años 2000 y 2003; n=3,182
b. Un intervalo de confianza de 95%
c. Un error de muestreo de 10%
d. Una proporción del «fenómeno» de 50%, para forzar una muestra de máximo tamaño. Se obtuvo un tamaño de muestra de 93 niños con malaria (por cualquier especie), que se aproximó a 100 para compensar posibles pérdidas en el seguimiento.
Los pacientes palúdicos se captaron según el orden de llegada a los puestos urbanos de malaria en cada municipio, a donde llegaban por iniciativa propia. La captación se hizo a partir del mes de julio de 2004 y duró hasta julio de 2005. Los niños se captaron y se asignaron en forma aleatoria a uno de los cuatro grupos de tratamiento. Cada niño fue seguido durante 30 días.
Población de referencia. La población de referencia la integran niños entre 4 y 10 años, de cualquier sexo, residentes en las zonas urbanas o rurales de los municipios de El Bagre y Turbo, que consultaron al puesto de diagnóstico de malaria por presentar síndrome febril y a quienes se les demostró, mediante examen de gota gruesa, que tienen infección con Plasmodium vivax, excluyendo las infecciones mixtas.
Criterios de inclusión en el estudio. Los pacientes con malaria fueron admitidos si cumplían todos estos requisitos:
1. Tener malaria por una única especie (excluye las malarias «mixtas»)
2. Tener parasitemia entre 1,000 y 50,000 parásitos asexuales/ml
3. Residir en El Bagre o en Turbo, en área rural o urbana
4. Tener entre 4 y 10 años de edad
5. Acudir voluntariamente al puesto de diagnóstico de malaria
6. No tener enfermedad aparente adicional a la malaria
7. No tener malaria complicada según criterios de OMS
8. Aceptar participar en el estudio mediante consentimiento informado y escrito firmado por su acudiente
9. No haber tenido otro episodio de malaria en los 30 días previos
Criterios de exclusión en el estudio:
1. Presentar alguna otra enfermedad, trauma, accidente o envenenamiento
2. No cumplir con las citas para evaluación los días 1, 2, 3, 7-8, 14-15 y 28-31
Diagnóstico y tratamiento de la malaria y medición de la respuesta terapéutica. Cada niño fue evaluado por los investigadores en siete ocasiones: antes del tratamiento, a las 24, 48 y 72 horas de tratamiento, los días 7-8, 14-15 y 28-30. Los evaluadores eran médicos generales con amplia experiencia en esta labor en pacientes con malaria y capacitados para evaluación antropométrica nutricional en niños. En todas las siete evaluaciones se midieron los signos vitales y en seis de ellas se hizo examen de gota gruesa para paludismo (se exceptuó el control a las 48 horas de tratamiento). A cada uno de los participantes se le hicieron, además, tres evaluaciones médicas generales completas: pretratamiento, día 7-8 y día 28-30.
El diagnóstico parasitológico de malaria se hizo según las recomendaciones de la OMS16. Las gotas gruesas se tomaron, se procesaron, se leyeron e interpretaron por una bacterióloga profesional, con experiencia de varios años en esta tarea. El control de calidad a las gotas gruesas se hizo en el laboratorio del grupo de investigación en Medellín (Sede de Investigación Universitaria), por profesionales con amplia experiencia en este trabajo. Los medicamentos antimaláricos se obtuvieron en la Dirección Seccional de Salud de Antioquia (DSSA) y se aplicaron según los esquemas del Ministerio de Protección Social de Colombia y la DSSA, acompañados con agua, así:
Cloroquina: dosis total 25 mg/kg peso corporal, fraccionada en tres días: inicial, 10 mg/kg; y luego cada 24 horas 7.5 mg/kg en cada uno.
Primaquina: 0.25 mg/kg/d por 14 días, tomada el día 28-30, después de evaluar la RTA de la monoterapia con cloroquina, en el último control.
El tratamiento con cloroquina se dio con supervisión directa por los investigadores. Se observó al paciente durante la primera media hora; en caso de vómito, se repitió la dosis completa; entonces, se repetía la observación (30 minutos) y si el paciente vomitaba de nuevo se excluía y se remitía al hospital municipal. La primaquina no se dio con supervisión sino que se entregó al acudiente, luego de explicarle cómo se administraba y la importancia de suministrarlo puntual y completo.
La RTA se midió con criterios clínicos (desaparición de los síntomas y los signos hallados en la evaluación de ingreso) y parasitarios (eliminación de la parasitemia, según la gota gruesa y extendido de sangre). La curación del paludismo se evaluó durante una fase de seguimiento entre 28 y 30 días, al final de los cuales, si no había manifestaciones clínicas ni parasitemia, se consideraba curado. La presencia de manifestaciones clínicas, de parasitemia o de ambas implicó la declaración de no curado. Para evaluar esta RTA se aplicó el protocolo de la «Red de Farmacovigilancia en Malaria en Colombia. Evaluación in vivo» (septiembre 2002), para evaluar la RTA tanto en malaria por P. falciparum como por P. vivax. Este protocolo está basado y es adaptado del protocolo «Evaluación de la eficacia terapéutica de los medicamentos para el tratamiento del paludismo por Plasmodium falciparum sin complicaciones en las Américas», creado por la OMS17. El protocolo aplicado concuerda, en esencia, con el protocolo de la OMS para evaluar la RTA en malaria por P. vivax. La RTA de los pacientes al tratamiento cloroquina-primaquina clasifica en falla precoz (la encontrada hasta 24 horas después de terminar la toma de cloroquina), falla tardía (la que ocurre después y hasta el día 28) y respuesta adecuada (exitosa). Para declarar la falla tardía se requirió siempre la presencia de parásitos en la gota gruesa de sangre periférica, acompañados o no de síntomas y signos clínicos17.
Tratamiento antiparasitario y suplemento de vitamina A. Además del tratamiento antimalárico, algunos pacientes recibieron vitamina A y/o albendazol-secnidazol. Los antiparasitarios se administraron por vía oral, cada uno en dosis única, igual para cada niño, cualquiera fuese su edad (4-10 años); cada uno recibió sendos frascos de albendazol en suspensión 4% en frasco de 10 ml (400 mg) de laboratorios MK (Colombia); secnidazol en suspensión 3.3% en frasco de 15 ml (500 mg) de laboratorios Biogen (Genéricos Medicalex) (Colombia). La vitamina A (Retiblan® de laboratorios Procaps, Colombia), en cápsulas de 100,000 UI y cada niño recibió 200.000 UI.
Exámenes de química sanguínea y hematología. A cada niño se le tomaron en total 10 ml de sangre. Se hicieron estas mediciones antes del tratamiento y los días 8 y 30: hemograma completo, proteína C reactiva (PCR) y retinol; antes del tratamiento y el día 8: alanino amino transferasa (ALT), ferritina, bilirrubinas directa e indirecta, creatinina; así:
- Hemoglobina, como parte del hemograma completo: medida como cianometahemoglobina, en un equipo automático Celltac Auto Nihon Khodan® MEK 8118 (Nihon Khodan Co, Tokio, Japan), en el laboratorio clínico del «Hospital Francisco Valderrama», de Turbo, y en el laboratorio «Medicauca», en El Bagre. En ambos lugares, se encargaron de la medición laboratoristas profesionales. Los valores de referencia para clasificar anemia fueron los recomendados por la OMS según la concentración de hemoglobina (Hb) así: para los niños de 4 años <11 g/dl y entre 5 y 10 años <12 g/dl.
- Retinol: se evaluó en el Laboratorio de Nutrición del Instituto Nacional de Salud (Bogotá). La determinación del retinol en plasma se hizo por el método de cromatografía líquida de alta resolución (HPLC), con un cromatógrafo líquido Water 600 E con detector UV. Se tomaron como deficientes los valores inferiores a 20 µg/dl.
- Ferritina: la determinación de ferritina se hizo en suero mediante inmunoensayo enzimático de micropartículas (MEIA). Los puntos de corte empleados para la determinación de ferropenia fueron (µg/l): 18-23 leve; 12-17.9 moderada, <12 grave. El análisis se hizo en el laboratorio clínico de la «IPS Universidad de Antioquia», Medellín.
- Proteína C reactiva (PCR): se midió en suero, mediante un estuche BioSystems (PCR) Látex, por la técnica de turbidimetría. Se consideró inflamación cuando la concentración de PCR estaba por encima de 8 mg/l, valor recomendado por el Laboratorio Clínico de la IPS de la Universidad de Antioquia, donde fueron procesadas estas muestras.
En el laboratorio clínico del «Hospital Francisco Valderrama», de Turbo, y en el laboratorio «Medicauca», en El Bagre, se hicieron estos exámenes:
- Alanino amino transferasa: método enzimático mediante fotocolorimetría cinética con fotocolorímetro RA-50 (Biosystems).
- Bilirrubinas total y directa: método enzimático mediante fotocolorimetría cinética con procedimiento de Organon Tecnika.
- Creatinina: método enzimático mediante fotocolorimetría cinética con procedimiento de Organon Tecnika.
También se hizo examen coprológico en el inicio del estudio (antes del tratamiento), el día 8 (siete días después de tomar los antiparasitarios) y el día 30 (al finalizar el seguimiento, que corresponde a 29 días después de tomar los antiparasitarios). Se hizo «examen directo» y, si este tenía ausencia de todo parásito se pasaba al «examen por concentración». La evaluación se hizo en el Laboratorio de Parasitología Intestinal de la Facultad de Medicina de la Universidad de Antioquia, en Medellín.
Consideraciones éticas. Cada acudiente del niño recibió explicación detallada del proyecto y firmó el consentimiento informado escrito. El estudio fue avalado por el Comité de Ética del Centro de Investigaciones Médicas de la Universidad de Antioquia.
Análisis estadístico. Para el análisis de los datos se usaron los programas Epi-Info 6.00 y SPSS versión 10. El efecto «respuesta al tratamiento antipalúdico» se trabajó como una variable cualitativa con tres valores: respuesta adecuada, falla precoz, falla tardía. El análisis fundamental consistió en describir las variables con sus medidas de tendencia central y dispersión, básicamente promedio aritmético y desviación estándar.
Las proporciones de incidencia de falla se analizaron de tres maneras: por intención de tratar, según el protocolo, por el peor escenario. Con esos procedimientos, las proporciones calculadas tienen este orden de magnitud: peor escenario > protocolo > intención de tratar así:
a. Por intención de tratar: el numerador contiene las fallas encontradas al final del seguimiento (día 120) y no tiene en cuenta lo que pudo sucederle a los perdidos y excluidos; el denominador consiste en los pacientes que iniciaron el estudio (incluye a los perdidos y a los excluidos); corresponde a fallas/pacientes al inicio; esta incidencia es una medida bruta (no ajustada) del fenómeno, porque no considera las pérdidas.
b. Según el protocolo: el numerador lo conforman las fallas al final del seguimiento (es igual al numerador usado en intención de tratar); el denominador se compone sólo con los pacientes que llegaron hasta el final del seguimiento (día 120) (no incluye a los perdidos y los excluidos durante el seguimiento, por lo que este denominador es menor que el aplicado en el análisis por intención de tratar). Como consecuencia del manejo de los denominadores, las proporciones según el protocolo son mayores que las calculadas con la intención de tratar; corresponde a fallas/pacientes al final; esta incidencia es una medición ajustada del fenómeno, porque tiene en cuenta (ajusta) los sujetos perdidos.
c. Por el peor escenario: el numerador contiene las fallas encontradas al final del seguimiento más las pérdidas durante el seguimiento; el denominador se trabaja como en intención de tratar (todos los que iniciaron). Las proporciones calculadas con esta técnica son las mayores de todas tres; corresponde a fallas + pérdidas/pacientes al inicio. Esta incidencia es una medición ajustada del fenómeno y, además, es más sólida que la medición según el protocolo porque toma las pérdidas como fallas.
RESULTADOS
Se captaron 93 niños con malaria, entre ellos 82 con paudismo por P. vivax y se logró la medición del efecto RTA en 78; las cuatro pérdidas ocurrieron en la primera semana, en El Bagre, en niños residentes en lugares muy distantes en la zona rural y a quienes no fue posible encontrar, a pesar de la búsqueda activa por los investigadores. Las características demográficas y clínicas de esos cuatro niños fueron similares a las del grupo que permaneció hasta la evaluación final el día 28-30.
En Turbo se evaluaron 46 pacientes (56%: 46/82) y en El Bagre 36 (44%); 55% residían en zona rural y 45% en zona urbana. La distribución de esta zona fue muy diferente entre los municipios: la vivienda estaba en zona rural para 43% de los niños de El Bagre y para 59% de aquellos de Turbo (chi2 M-H= 5.73; gl=1; p= 0.01665090). Los hombres representaron 62% de los pacientes, sin diferencia por municipio (p= 0.78092801). La edad de los niños también fue similar en los dos lugares (p= 0.42072391): 4 años (12%), 5 (21%), 6 (8%), 7 (15%), 8 (15%), 9 (18%) y 10 años (11%).
Esos niños estaban fuertemente afectados por parásitos intestinales (82%), tanto protozoos como helmintos, que fueron patógenos 80% de las veces. Tenían notorio déficit nutricional según la antropometría (indicadores antropométricos expresados en unidades Z y considerados como sugestivos de desnutrición cuando su valor está por debajo del punto correspondiente a la mediana menos una unidad Z): 62.4% padecían «desnutrición de largo plazo», definida con los indicadores peso/edad (desnutrición global) y talla/edad (desnutrición crónica), es decir 62.4% tenía desnutrición por uno o por ambos índices.
La parasitemia previa al tratamiento osciló entre 80 y 40,040 parásitos/ml, con promedio aritmético de 9,603 (mediana 7,060; media geométrica 6,174), desviación estándar de 7,924, percentil 25 de 4,120 y percentil 75 de 13,470.
En el momento de ingreso al estudio (pretratamiento), el estado clínico de los pacientes se caracterizó por la presencia de estos síntomas: fiebre 99%, escalofrío 94%, cefalea 93%, astenia 82%, sudoración 78%, mialgia o artralgia o ambas 77%, dolor abdominal 54%. Los signos más frecuentes fueron: palidez conjuntival 65% y palidez palmar (Cuadro 3). Los signos vitales mostraron temperatura axilar de 37.7 ± 1.1ºC, frecuencia respiratoria 25±9 por minuto y pulso 94±19 por minuto.
La evolución de la parasitemia y de la temperatura corporal aparecen en el Cuadro 4. A las 24 horas de tratamiento con cloroquina se hallaron 12 (15%: 12/82) pacientes sin parásitos y en los parasitados el promedio era 1,024 por ml (contra 9,500 antes del tratamiento); a las 72 horas de tratamiento (24 horas después de terminar la cloroquina) 90% (73/81) estaba sin parásitos y en quienes los portaban no había temperatura mayor de 37.5ºC. Los días 7-8 y 14-15 la totalidad de los 78 niños en quienes se pudo evaluar la RTA se halló sin parásitos y sin síntomas ni signos de tipo palúdico. El día 28-30 se logró captar a estos 78 niños y se encontraron parásitos y fiebre en 2 (2.6%: 2/78), de ellos es decir que hubo 2 fallas y fueron tardías. Las dos fallas ocurrieron en el grupo que recibió antiparasitarios y vitamina A, además de la cloroquina. La proporción de falla según tres técnicas de análisis fueron: por intención de tratar: 2.4% (0 a 24%), por protocolo 2.6% (0 a 25%), por peor escenario 7.3% (0 a 29%). No hubo diferencia estadísticamente significativa entre los cuatro grupos en la frecuencia de falla (chi2= 6.36; gl= 3; p= 0.09555974), lo que permite decir que la adición de vitamina A a la cloroquina y antiparasitarios careció de efecto en la respuesta terapéutica. Un paciente tenía 32 y el otro 13,640 parásitos/ml; ambos se evaluaron el día 30. Uno era de Turbo y el otro de El Bagre; sus parasitemias iniciales fueron 13,470 y 5,800 parásitos/ml, respectivamente; una niña y un niño, con edad de 6 y 7 años, peso corporal 16.2 kg y 21.7 kg, talla 107.3 cm y 123.9 cm, respectivamente.
La evolución de la temperatura corporal, medida por el médico, fue la siguiente: antes del tratamiento, 51% (42/82) estaba sin fiebre (<37.6ºC); a las 24 horas 79% (64/81) estaba sin fiebre; a las 48 horas nadie tenía fiebre (>37.5ºC); a las 72 horas 97% (77/79) estaba afebril y los dos niños con fiebre no tenían parasitemia (luego no son falla del tratamiento); los días 7-8 y 14-15 nadie tenía fiebre y los día 28-30 hubo 2 niños (2.6% de 74) que tenían fiebre y parásitos en sangre (2 fallas clínicas y parasitarias tardías).
Durante los primeros 7-8 días de seguimiento las quejas sintomáticas del paciente fueron frecuentes, aunque en general leves y siempre pasajeras; esas quejas se confundieron siempre con síntomas propios de la malaria: fiebre subjetiva, malestar, debilidad, cansancio, cefalea, anorexia. Nunca hubo ninguna queja grave ni que obligara a intervención médica para instaurar un tratamiento adicional, o a hospitalizar el paciente. Así, los efectos adversos, entendiendo por ello las quejas de los pacientes durante el tiempo de seguimiento, fueron siempre leves, transitorios y nunca dejaron secuela manifiesta.
La evolución temporal de las variables de la hemoglobina, el hemograma y de otras de bioquímica sanguínea se resume en el Cuadro 5. Los valores promedio indican que los niños padecían anemia al llegar al estudio, la cual persistía el día 8 pero el día 30 prácticamente ya no estaban anémicos, según el promedio. En los treinta días, la hemoglobina aumentó 1.4 g/dl, aunque 56% de los niños tenía anemia. En todas las tres mediciones, la relación entre los valores de hematocrito y hemoglobina fue 3:1. Antes del tratamiento, la hemoglobina fue estadísticamente similar en niños y niñas (10.5±1.7; 10±1.7 g/dl, respectivamente) (p=0.166528), pero por edad sí hubo diferencia (p=0.024686), que desapareció al controlar, mediante estratificación, la influencia del sexo (hombres: p=0.102252; mujeres: p=0.484032) (Cuadro 5A). En general, tanto en hombres como en mujeres, antes del tratamiento había anemia en todos los grupos de edad, según el promedio. El día 30, la hemoglobina fue estadísticamente similar en niños y niñas (11.7±1; 11.8±1.3 g/dl, respectivamente) (p=0.815935) y no hubo diferencia por edad (p=0.058106). En general, ese día 30 en hombres y en mujeres, la anemia casi había desaparecido en los diferentes grupos de edad, situación contraria previa al tratamiento.
Los promedios de hemoglobina fueron similares entre quienes estaban con parásitos intestinales, tanto antes del tratamiento (p=0.831772) como el día 30 (p=0.172333). Antes del tratamiento antipalúdico y de recibir algunos vitamina A, otros antiparasitarios intestinales (albendazol+secnidazol), otros vitamina A y los antiparasitarios y otros ninguno de ellos (excepto el tratamiento antipalúdico); los promedios de hemoglobina fueron iguales entre esos cuatro grupos (p=0.464392); lo mismo sucedió el día 30 (p=0.330250).
Antes del tratamiento, entre 10 niños de cuatro años de edad hubo 8 con palidez conjuntival (80%) y en los 8 hubo 6 (75%) que tienen anemia (hemoglobina <11 g/dl); en 70 niños entre 5 a 11 años, hubo 43 con palidez (51%) y en estos 43 hubo 39 (91%) con anemia (hemoglobina <12 g/dl). Además, el promedio de hemoglobina se relacionó con la palidez conjuntival, pues quienes la presentaron sólo tuvieron 9.9±1.5 g/dl comparado con 11±1.8 g/dl en quienes no la manifestaron (K-W= 5.946; gl=1; p=0.014747).
Antes del tratamiento, los niños mostraron un recuento de leucocitos de 7,462±2,761 por ml, que es normal; el día 8, luego de curada la malaria, la cuenta subió a 9,914±3,200 y el día 30 llegó a 10,436±4,021, que supera levemente el límite de leucocitotosis (10,000 leucocitos/ml). Los neutrófilos bajaron de 54% antes del tratamiento a 46% los días 8 y 30, mientras que los eosinófilos subieron al pasar de 4% antes del tratamiento a 8.5% el día 8 y 13.5% el día 30. Los basófilos representaron 0.2% antes del tratamiento, 0.4% el día 8 y cero el día 30. Los linfocitos estuvieron relativamente estables en las tres mediciones, alrededor de 40%, e igual sucedió con los monocitos, que estuvieron alrededor de 2%. En resumen, durante el episodio malárico hubo normalidad en cuanto al recuento leucocitario y se pasó, en los 30 días siguientes, hacia una muy leve leucocitosis, la cual se notaba desde el día 8. La fórmula leucocitaria se caracterizó por la disminución de neutrófilos y basófilos, con aumento de eosinófilos, mientras los linfocitos y monocitos permanecieron estables (Cuadro 5B).
El retinol estuvo muy bajo en el pretratamiento (18.9±6.9 mg/dl), pero el día 8 ya estaba normal y así permaneció el día 30, con valores alrededor de 31 mg/dl (Cuadro 5C). La ferritina estaba elevada antes del tratamiento (298±207 mg/l), pero el día 8 era normal (32±31 mg/l). La PCR estaba muy alta antes del tratamiento (76±63 mg/l) (normal: <8 mg/l) y bajó a valores normales el día 8 (8±12 mg/l), en los que persistió hasta el día 30 (6±15). La enzima ALT estuvo normal antes del tratamiento (12±9 UI/l) y el día 8 (12±9 UI/l). La bilirrubina directa se encontró en 0.077±0.087 mg/dl en pretratamiento y se redujo a una tercera parte el día 8 (0.028±0.022 mg/dl). La bilirrubina total fue 0.592±0.572 mg/dl antes del tratamiento y de 0.274±0.175 mg/dl el día 8. La creatinina sérica no cambió entre los días 1 y 8, con valores alrededor de 0.7 mg/dl.
DISCUSIÓN
Este grupo de 82 pacientes tuvo el tamaño calculado según los criterios explicados y duplica el tamaño indicado por los protocolos OMS para evaluar la RTA. Las pérdidas fueron pocas y no afectaron el número que se debía examinar, pues la RTA se pudo medir el día 28-30 en 95% (78/82) de los niños.
La supervisión directa y estricta a los niños en el momento de tomar la cloroquina garantiza que el medicamento se ingirió y que tampoco se perdió por vómito o por diarrea. El control diario y la garantía efectiva a los pacientes de que el médico estaba disponible las 24 horas durante los cuatro días de aplicación de la cloroquina reducen la posibilidad de que los pacientes hayan consumido otros antimaláricos por su cuenta y riesgo.
El cuadro clínico observado es similar a lo descrito para los adultos en Turbo13. De todos los hallazgos se quiere llamar la atención sobre la palidez conjuntival presente en 2 de cada 3 niños, que sugiere no sólo el estado tóxico infeccioso actual sino que también habla de la posibilidad de anemia, común en los niños de las zonas endémicas de paludismo, tal como lo hallado antes en niños con malaria vivax18, lo mismo que en los adultos afectados13,19. La OMS enfatiza la importancia de buscar la palidez conjuntival o palmar para sospechar anemia pues se sabe que su presencia se asocia de manera significativa con la anemia19, tal como sucedió en esta investigación.
Es muy clara la anemia que afecta a estos niños con paludismo vivax residentes en Urabá y Bajo Cauca y también la rápida recuperación que presentaron ellos, quienes en un mes alcanzaron una situación prácticamente normal, después de ganar en promedio 1.4 g/dl de hemoglobina (56% de los niños tenían anemia). En esa recuperación lo esencial parece haber sido el tratamiento antimalárico, sin influencia del tratamiento antiparasitario intestinal ni del suplemento de vitamina A, ni de ambos. Cabe recordar que 80% de los niños estuvieron afectados por parásitos intestinales patógenos y por notorio déficit nutricional según la antropometría; además, fue obvio el bajo nivel sanguíneo de retinol, inclusive después de curado el ataque palúdico, cuando 4% mostró menos de 20 mg/dl de retinol, 49% entre 20 y 30 mg/dl, 32% estuvo entre 31 y 40 mg/dl y sólo 15 % estaba entre 41 y 48 mg/dl. Se esperaría que el tratamiento (parásitos intestinales y vitamina A) de esas causas de anemia se reflejara en mayores valores de hemoglobina, como en efecto ocurrió, lo que sugiere que es conveniente dar a los niños con malaria tratamiento adicional para los parásitos intestinales y la deficiencia de esa vitamina. Es pertinente anotar que los valores de deficiencia nutricional aquí hallados concuerdan con informes previos de los autores en esas mismas poblaciones y zonas4,18,20,21 y en otras similares donde la malaria también es endémica22,23.
La eficacia de la cloroquina para curar el ataque agudo de malaria vivax fue contundente en este grupo, pues a las 24 horas 80% de los niños estaba sin fiebre (temperatura <37.6ºC) y 15% había eliminado los parásitos circulantes, mientras que al completar 72 horas de tratamiento (24 horas después de tomar la última dosis de cloroquina) 97% estaba afebril y sin parásitos y 90% carecía de parásitos y fiebre, de tal forma que no hubo fallas precoces ni de tipo «clínico» (presencia de fiebre) ni parasitológico (presencia de parásitos en sangre). En el control del día 7-8 todos estuvieron sin parásitos y sin fiebre y así continuaron hasta el día 28-30 cuando dos niños aparecieron con parasitemia y fiebre, constituyendo dos fallas tardías clínicas y parasitarias. Este hallazgo confirma la altísima eficacia de la cloroquina pero difiere de la eficacia de 100% hallada antes en adultos en esos dos mismos municipios11. Esta falla de 2.6% es bastante inferior a la encontrada por Soto et al.14 de 11%, según los hallazgos en 16 soldados en los Llanos Orientales, quienes recibieron sólo cloroquina en dosis estándar y en Urabá (11 personas); en la primera zona hubo 6.2% de fallas (1/16) y en la segunda hubo 18.2% (2/11). Recientemente, en adultos de Turbo y El Bagre, hemos encontrado eficacia de 100% del tratamiento simultáneo con cloroquina y primaquina contra paludismo vivax13, lo cual se ha repetido otra vez en Turbo en adultos y niños (datos sin publicar).
No se debe afirmar que estos dos pacientes aquí descritos constituyan casos de «malaria vivax resistente a cloroquina» porque, de acuerdo con Ruebush et al.24, se deben fijar criterios claros y precisos para aceptar una infección por P. vivax como cloroquino-resistente. Ellos proponen tres criterios:
1. Haber recibido completamente y en la forma preestablecida y con supervisión adecuada el tratamiento estándar con cloroquina.
2. La recurrencia de la parasitemia debe ocurrir dentro de los 28 días de seguimiento, contados a partir del inicio del tratamiento.
3. En el momento de la recrudescencia, los niveles en sangre de cloroquina y de desetil-cloroquina deben ser mayores de 90-100 ng/ml.
De acuerdo con estos autores sólo dos informes sobre falla en Suramérica satisfacen tales criterios: el de un viajero de Guyana, en 1996 y los dos pacientes de la Amazonia peruana, en 200324. Según esto, los pacientes del informe de Soto et al.14 no pueden clasificarse definitivamente como fallas porque no se midió la cloroquina en el momento de la reaparición de los parásitos, lo que tampoco se hizo en los dos niños de la presente investigación, quienes además se detectaron con parásitos y fiebre el día 30 y no el 28, diferencia ésta de muy discutible valor (según el protocolo, la falla se califica hasta el día 28, pero estos niños fueron evaluados el día 30); se trata, entonces, de posibles pero no seguras fallas. Conviene, en consecuencia, emprender análisis en diferentes regiones del país, con aplicación del protocolo OMS y de los criterios propuestos por esos autores.
Hay propuestas de «tratamiento corto» (en realidad son de dosis total menor que la estándar) con cloroquina, con primaquina o con ambas para curación del ataque agudo, generadas en Belém, Pará, Brasil (Cuadro 6)25-28. Esos estudios indican, en general, que la curación del ataque agudo se logra con dosis únicas de 10 mg/kg de cloroquina (en lugar de 25 mg/kg en tres fracciones), bien sea como tratamiento exclusivo o asociado con primaquina.
Se ha encontrado elevada eficacia de la cloroquina contra el ataque agudo de la malaria vivax tanto en adultos11-13 como en estos niños y conviene resaltar el hallazgo en estos últimos, quienes en general se considera que tienen menos desarrollada la inmunidad específica antimalárica que los adultos de las mismas zonas endémicas, debido a que se desarrolla gradualmente, después de muchos ataques durante varios años29. Esta gran capacidad curativa que conserva la cloroquina en adultos y niños, tras más de 50 años de uso continuo, no siempre en condiciones adecuadas, es un argumento muy importante a favor de ese medicamento.
Un asunto adicional tiene que ver con las recurrencias del paludismo vivax que suceden después del día 28, según el protocolo, las cuales ya no se refieren a la curación del ataque agudo sino a la instauración de un nuevo ciclo parasitario a partir de las formas hepáticas de P. vivax conocidas como hipnozoítos. En el mundo y en particular Colombia, se dice que el problema de la malaria vivax no es la curación del ataque agudo sino estas recurrencias tardías (posteriores al día 28), comúnmente mencionadas como recaídas y para las cuales es indispensable el tratamiento con primaquina. Varios estudios sobre este problema30 indican que únicamente es útil la dosificación estándar de primaquina: 0.25-0.30 mg/kg/día por 14 días (recurrencias de 15% a los 120 días en adultos), que el esquema 0.50 mg/kg/día por 7 días en niños menores de 15 años, en forma parcialmente supervisada, presentó 30% de recurrencias en 120 días y que, en adultos, los esquemas que dieron dosis total menor que la estándar tuvieron recurrencias por encima de 50% (en proceso de publicación).
Declaración de conflictos. Los autores manifiesta no tener ninguno conflicto para manifestar.
AGRADECIMIENTOS
A los directivos, empleados y pacientes de los hospitales locales de Turbo y El Bagre por su colaboración y participación en la investigación. Al personal del Grupo Grupo Salud y Comunidad, Universidad de Antioquia, por su trabajo en el campo (captación, seguimiento y evaluación de los pacientes).
REFERENCIAS
1. Carmona-Fonseca J. La malaria en Colombia, Antioquia y las zonas de Urabá y Bajo Cauca: panorama para interpretar la respuesta terapéutica antimalárica. Parte 1. Iatreia 2003; 16: 299-318.
2. Ministerio de la Protección Social de Colombia. Organización Panamericacana de la Salud. Situación de la salud en Colombia. Indicadores básicos 2005. Bogotá: MinProtección, 2005.
3. Carmona-Fonseca J. La malaria en Colombia, Antioquia y las zonas de Urabá y Bajo Cauca: panorama para interpretar la respuesta terapéutica antimalárica. Parte 2. Iatreia 2004; 17: 34-53.
4. Carmona-Fonseca J. Malaria, desnutrición y parasitosis intestinal en los niños colombianos: interrelaciones. Iatreia 2004; 17: 354-69.
5. Krause PJ. Paludismo (Plasmodium). En: Behrman RE, Kliegman RM, Jenson HB, editores. Nelson Tratado de Pediatría. 16a ed. 2 volúmenes. México: McGraw Hill-Interamericana; 2001. p. 1050-4.
6. Luxemburger C, Noster F, Kyle DE, Kiricharoen L, Chongsuphajaisiddhi T, White NJ. Clinical features cannot predict a diagnosis of malaria or differentiate the infecting species in children living in an area of low transsmision. Trans R Soc Trop Med Hyg. 1998; 92: 45-9.
7. Echeverri M, Tobón A, Álvarez G, Carmona J, Blair S. Clinical and laboratory findings of Plasmodium vivax malaria in Colombia, 2001. Rev Inst Med Trop São Paulo. 2003; 45: 29-34.
8. Castillo CM, Osorio LE, Palma GI. Assessment of therapeutic response of Plasmodium vivax and Plasmodium falciparum to chloroquine in a malaria transmission free area in Colombia. Mem Inst Oswaldo Cruz. (Rio de Janeiro) 2002; 97: 559-62.
9. Kakkilaya BS. Kakkilaya's Malaria Site. Malaria in children [sitio en internet]. (fecha de acceso julio 28 de 2006). Disponible en: http://www.malariasite.com/malaria/Children.htm
10. Blair S, Carmona-Fonseca J, Piñeros JG, Ríos A, Álvarez T, Álvarez G, et al. Therapeutic efficacy test in malaria falciparum in Antioquia, Colombia. Malaria J. 2006; 5: 14 (revista en línea). http://www.malariajournal.com/content/6/1/47
11. Blair S, Tobón A, Echeverri M, Álvarez G, Carmona-Fonseca J. Adecuada respuesta clínica y parasitológica de Plasmodium vivax a la cloroquina en Colombia (Turbo, Antioquia), 2001. Infectio. 2002; 6: 21-6.
12. Lacharme L, Carmona-Fonseca J, Tobón A, Blair S. Respuesta de P. vivax al esquema terapéutico cloroquina-primaquina en Zaragoza y Turbo, Colombia, 1998. Infectio 1998; 2: 90-4.
13. Carmona-Fonseca J, Álvarez G, Blair S. Malaria por Plasmodium vivax: curación del ataque agudo con tres dosis diferentes de primaquina y dosis fija de cloroquina. Antioquia, Colombia, 2003-2004. Biomedica. 2006; 26: 353-65.
14. Soto J, Toledo J, Gutiérrez P, Luzz M, Llinas N, Cedeño N, et al. Plasmodium vivax clinically resistant to chloroquine in Colombia. Am J Trop Med Hyg. 2001; 65: 90-3.
15. Martínez-Bencardino C. Muestreo. Bogotá: Ecoe; 1984. p. 45-7.
16. López-Antuñano FJ. Diagnóstico microscópico de los parásitos de la malaria en la sangre. En: López-Antuñano FJ, Schmunis G, editores. Diagnóstico de malaria. Volumen 512. Washington: OPS-OMS; 1988. p. 39-50.
17. World Health Organization. A general guide for the assessment of therapeutic efficacy of chloroquine for vivax malaria (working draft). Version 3. Geneva; WHO. 07-05-2001.
18. Blair S, Álvarez G, Campuzano G. Relación entre anemia y malaria en una población rural de Colombia. Bol Dir Malariol Saneam Amb. (Venezuela) 1997; 37: 7-13.
19. Muhe L, Oljira B, Degefu H, Jaffar S, Weber MW. Evaluation of clinical pallor in the identification and treatment of children with moderate and severe anaemia. Trop Med Int Health. 2000; 5: 805-10. Erratum in: Trop Med Int Health. 2001; 6: 326.
20. Blair S, Carmona J, Correa A. Malaria en niños: relaciones entre nutrición e inmunidad. Rev Panam Salud Publica. 2002; 11: 5-14.
21. Blair S. Álvarez G, Villa A, Carmona-Fonseca J, Ríos L. Estado nutricional y niveles de inmunoglobulinas y citoquinas en niños con malaria. An Pediatr. (Barcelona) 2003; 58: 418-24.
22. Correa AM, Guzmán V, Carmona-Fonseca J, Blair S, Morales DM. Alimentación y malaria: una aproximación biosocial. Invest Educ Enfer. 2002; 20: 30-47.
23. Guzmán V, Correa A, Carmona-Fonseca J, Blair S. Seguridad alimentaria y nutricional en un espacio de riesgo para malaria. Arch Latinoam Nutr. 2003; 53: 227-37.
24. Ruebush II TK, Zegarra J, Cairo J, Andersen EM, Green M, Pillai DR, et al. Chloroquine-resistant Plasmodium vivax malaria in Perú. Am J Trop Med Hyg. 2003; 69: 548-52.
25. Abdon NP, Pinto AY, Da Silva RS de Souza JM. Avalição da resposta aos esquemas de tratamento reduzidos para malária vivax. Rev Soc Bras Med Trop. 2001; 34: 343-8.
26. Da Silva RS, Pinto AY, Calvosa VS, de Souza JM. Esquemas terapêuticos encurtados para o tratamento de malária por Plasmodium vivax. Rev Soc Bras Med Trop. 2003; 36: 235-9.
27. Pinto AY, Azevedo CH, da Silva JB, de Souza JM. Assessment of chloroquine single dose treatment of malaria due to Plasmodium vivax in Brazilian Amazon. Rev Inst Med Trop Sao Paulo. 2003; 45: 327-31.
28. Pinto AY, Ventura AM, Calvosa VS, Silva Filho MG, Santos MA, Silva RS, Souza JM. Clinical efficacy of four schemes for vivax malaria treatment in children. J Pediatr (Rio Janeiro). 1998; 74: 222-7.
29. Mannana BA, Patela K, Malhotraa I, Ravindranb B, Sharmaa S. How specific is the immune response to malaria in adults living in endemic areas? J Vect Borne Dis. 2003; 40: 84-91.
30. Álvarez G, Piñeros JG, Tobón A, Ríos A, Maestre A, Blair S, et al. J. Efficacy of three chloroquine-primaquine regimens for treatment of Plasmodium vivax malaria in Colombia. Am J Trop Med Hyg. 2006; 75: 605-9.